二氧化氮制取实验装置和除气操作的改进
2021-03-18李旭娃
李旭娃

摘要: 常用的制取二氧化氮气体的装置,在制备时会有产物气体逃逸。使用传统的除去二氧化氮余气的方法也会使有害气体泄漏。为此对二氧化氮制取实验装置进行改进,对二氧化氮气体的除去采用倒吸法,并将倒吸法的应用进行推广。运用倒吸法除去二氧化氮气体的方法内容和改进过程,对激发学生兴趣、培养化学学科核心素养是很好的教学资源。
关键词: 二氧化氮; 制取装置; 余气处理; 倒吸法; 实验改进
文章编号: 1005-6629(2021)02-0059-04
中图分类号: G633.8
文献标识码: B
高中化学教材对于NO2及其性质的介绍主要安排在“氮和氮的氧化物”一章中。氮的氧化物有很多,涉及的问题也很复杂。在红棕色的NO2气体中,总是伴随着无色的N2O4的存在。它们之间存在着平衡关系2NO2(g)N2O4(g) ΔH<0,这种变化关系不仅具有明显的颜色特征,而且正反应是放热反应,也是气体体积减小的反应。所以,NO2与N2O4之间的转化是一种能够由温度或压强的改变而引起化学平衡移动的具有明显颜色变化的最典型的化学反应,学生能够直接感知温度或压强引起的化学平衡的移动。因此,长期以来各种不同版本的化学教材中,都无不将这个反应编入化学平衡移动条件的教学中[1~3]。所以,NO2在化学平衡教学中是一种十分重要的气体物质。
然而,NO2是一种有毒有害气体。在制取NO2时,用通常的制气装置难免会有NO2释放于空气中。在制取NO2和化学平衡实验之后,要除去NO2余气,如果处理不当,也会有NO2逃逸至空气中。这些释放的气体,会污染环境。
因此,采取怎样的方法防止NO2的逸散,是化学教师和实验室工作人员必须研究的课题,之前曾有该实验改进的一些文章发表[4],但还不够完善。1 二氧化氮制取装置的改进
1.1 常用制取装置的缺陷性
在化学教学中,NO2气体常用铜和浓硝酸反应制取。少量的NO2制取一般在试管中进行,而化学平衡实验中的NO2用量较大,需要用容量较大的烧瓶来制取。通常将制气烧瓶与玻璃导管相连接,再将玻璃导管插入集气烧瓶中。如图1所示。
在制取气体过程中,将铜与浓硝酸混合后,其反应是持续进行的,从导管排出的气体也是持续进行的。这就使产生气体的排出过程与气体的收集过程不相吻合。如: (1)更换集气瓶时气体就会释放至空气中,收集的瓶数越多,气体释放得越多。(2)收集结束后,制气烧瓶内的铜和硝酸还会继续反应,生成的气体还会继续释放至空气中。即使将导管插入NaOH溶液中,气体排出较快时,仍有较多气泡会从溶液中逸出污染空气。
1.2 改进方法及特点
针对上述缺陷,对于NO2的制取装置进行如下改进。
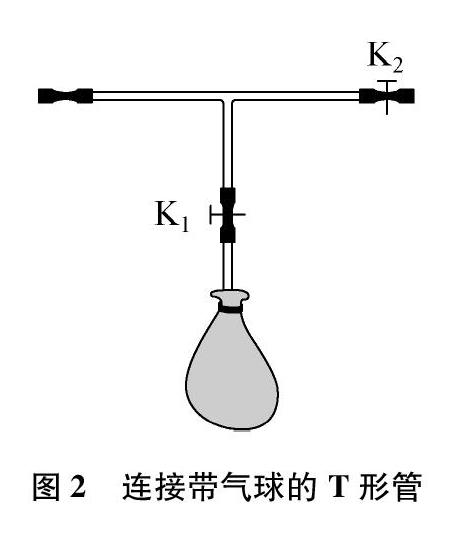
在图1相应的装置中,将胶管从中间剪断,连接1个T形管(将T形管直管两端与胶管相连)。
在T形管的侧管(位于直管中间,
且与直管垂直的部分)配上止水夹K1,在T形管的右侧配上止水夹K2。在侧管上连接玻璃管,在玻璃管上绑1个气球,如图2所示。这样,就可使气体的制取和气体的收集在封闭条件下进行。
2 除气操作的改进
在除去烧瓶中的NO2气体时,通常的做法是去掉胶塞,向其中加入NaOH溶液,通过摇动,使NO2与NaOH溶液反应而除去。但这种操作在去掉胶塞时,气体会从瓶口向外扩散,在加入NaOH溶液时也会将气体排出瓶外。
那么,能不能在不取下胶塞的情况下让NaOH溶液进入呢?
2.1 制气烧瓶中气体的除去
2.1.1 倒吸法的引入
由教材中的喷泉实验可知,当容器内部的气压小于外界大气压时,溶液就会自动进入容器内。
铜和浓硝酸制取NO2的反应剧烈,不需加热,反应后混合物的温度也不高(用手触摸瓶壁时有热感)。制取NO2后,烧瓶中剩余的铜和硝酸还会继续反应(但越来越慢),生成气体,放出热量,形成温度升高和气压增大的趋势。同时,体系内的热量会透过瓶壁而放出,形成气压减小的趋势。所以,制取气体时,瓶内气压大于外界大气压,气体会排出。当制取气体结束后,随着冷却瓶内气压变得小于外界大气压,这时,如果将导管插入NaOH溶液中,就会发生倒吸现象,NO2气体在封闭条件下与吸入的NaOH反应而被除去。这种通过倒吸除去气体的方法叫做倒吸法。装置的气密性是否良好,是形成倒吸的关键。
2.1.2 除气操作
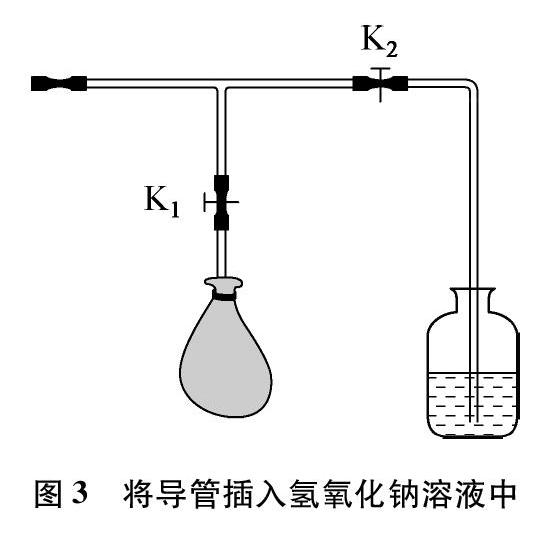
在气体收集完畢,制气反应很慢时,关闭K2,打开K1,让气球与制气烧瓶相连通,将导管插入盛有NaOH溶液的细口瓶中,如图3所示。当内部气压小于外界大气压时(气球变瘪),关闭K1,打开K2,这时就会形成倒吸,NaOH溶液进入瓶内。再打开K1。
2.1.3 生成物及其现象
(1) 在制气烧瓶中,Cu与HNO3反应生成Cu(NO3)2、 NO2、 NO(主要在反应后期生成)、H2O等,而NO2、 NO会与H2O反应生成HNO2,电离出NO-2,与Cu2+形成Cu(NO2)2的绿色溶液[5](当大量的氢氧化钠溶液进入之后,硝酸铜的浓度大大减小。因此,氢氧化钠溶液进入后溶液的绿色,只是亚硝酸铜溶液的颜色)。
当NaOH溶液倒吸进入烧瓶后: ①在溶液中生成Cu(OH)2、 Cu(OH)2·Cu(NO3)2等;②NO2等气体与吸进瓶内下落的NaOH溶液在运动状态下充分接触而反应: 2NaOH+2NO2NaNO3+NaNO2+H2O, 2NaOH+NO2+NO2NaNO2+H2O,在少量水中生成大量的NaNO2,沉入底部后,与Cu2+生成大量的可溶性黄绿色固体Cu(NO2)2[6, 7];③NaOH溶液中因种种原因混入了Na2CO3,因此,在酸性区域中有CO2气体生成;④红棕色消失。
在NO2与NaOH溶液反应的过程中,气体转化成了液体或固体物质,使气压减小,故倒吸能持续进行。在倒吸过程中,由于局部过浓,发生竞争反应,在浓度不同的区域,生成不同的物质,有些物质不稳定,放置时会发生转化。
(2) 在倒吸发生后,烧瓶中的现象随反应物Cu和HNO3的比例、NaOH溶液的浓度、倒吸控制情况的不同而不同。本文实验中的NaOH溶液浓度为10%。
如果Cu过量,而且使NaOH溶液间接地分几次吸入(不振荡),静置时混合物中会出现一系列五彩缤纷的迷人现象: ①倒吸刚完成时,底部为绿色液体,上部为蓝色和绿色分布不均匀的絮状混合物,有些类似蓝绿色珍珠。②随着静置,絮状混合物向中部聚集,绿色成分减少,底部和上部在10分钟之内形成清液(变化快慢随吸入氢氧化钠的量和混合程度的不同而不同,下同)。底部的许多气泡(CO2)不能逸出,附着于絮状物下部。絮状物中逐渐出现轻度黑色[是因为Cu(OH)2分解成了CuO];絮状物底部呈绿色[是因为底部溶液的pH小,使易溶的Cu(NO2)2不易转化成难溶的Cu(OH)2,故Cu(NO2)2不易消失]。整个现象类似水中生物世界。③再静置10多分钟后,絮状物完全变黑。这是因为上部的OH-透过絮状物进入下部溶液中,pH增大,可溶性的Cu(NO2)2转化成难溶的Cu(OH)2,又进一步分解为CuO。其现象俨然是山川大地笼罩在水雾中的景象。
从倒吸开始到絮状物完全变黑的过程,从不同的时段、不同的角度去观察,都可以看到变幻奇特的“水中世界”,不禁使人浮想联翩,心驰神往。
如果使倒吸一次性完成,其现象就会有所不同。有些像玉石翡翠,有些像蓝绿钧瓷……,随着静置时间的变化而不断变幻着。
如果制气烧瓶中硝酸过量,而且倒吸进入的NaOH溶液相对较少,那么,除去气体后再振荡,得到的则是鲜艳美丽的绿色溶液。
2.2 集气烧瓶中气体的除去
除气时,集气烧瓶与带有气球的T形管相连,再将T形管与玻璃导管相连,将玻璃导管插入NaOH溶液中(因内外气压相等,而且玻璃导管中有空气,使二氧化氮与NaOH溶液不易接触,倒吸难以发生)。然后关闭K2,打开K1,用热毛巾捂住烧瓶,使气体受热膨胀,气压增大,气体进入气球中。片刻后,关闭K1,去掉热毛巾,打开K2,再用冷毛巾捂住烧瓶,气体遇冷收缩,气压减小,形成倒吸,NaOH溶液进入瓶内。再打开K1。
NaOH溶液进入集气瓶后,与瓶内气体反应,生成NaNO3、 NaNO2和H2O, NO2、 N2O4、 NO被除去,使红棕色的气体变为浅黄色的溶液。
3 实验改进的意义
3.1 在化学教学中的应用
通过上述改进,使NO2的制取和除去的方法内容以及操作过程成为一种具有丰富内涵的优质教学资源。根据教学的需要,可以进行灵活处理: 可以拓展和延伸、可以压缩和删减,也可以侧重或淡化。
制气装置的改进,倒吸现象的发生过程,烧瓶中的迷人现象,都会使学生产生很大的兴趣。在这样一种难得的氛围中,用科学且有趣的方法除去有毒有害气体,会使学生对于所经历的过程和所学的知识印象深刻,永久难忘。
(1) 这些内容和过程可以在时间充裕的课堂(如习题课、复习课等)、化学课外活动、兴趣小组活动中进行,以激发学生的学习兴趣和学习热情。
对于高年级学生,这种有趣的活动过程可以起到复习巩固、拓展知识的作用。对于还未学习二氧化氮知识的学生,会引发其强烈的求知欲和探究欲。对于还未学习化学的低年级学生,其趣味性和神奇性会深深地吸引他们,使其形成对化学科学的向往和追求。
在有关NO2的课堂教学中,笔者在自己任课的班级尝试采用倒吸法除去制气瓶中的NO2,收到了很好的效果。
(2) 整个教学内容和过程,涉及到多方面知识和问题。如化学式、化学方程式、化合价、化学平衡、气压的大小关系、物质的稳定性与倒吸的关系、物质状态的变化、颜色的变化、生成物的不稳定性及其转化、气体污染的严重性、治理环境的紧迫性和责任感、倒吸的创造性利用等,将这些方法和内容通过归纳、整理、分类、细化,实施在教育教学的活动中,可以从多个维度去培养学生的化学学科核心素养。
3.2 倒吸法的应用推广
制取气体的装置,不论是否加热,如有必要,利用上述装置和操作方法,都可以引发倒吸的发生。利用倒吸法可以除去多种残留的有毒有害气体。在中学阶段,除了NO2外,还有SO2、 Cl2、 HCl、 H2S、 NH3等都可以用倒吸法除去。其中SO2、 Cl2、 HCl、 H2S等气体用NaOH溶液,而NH3则用盐酸溶液吸收。
不同的气体性质不同,制取气体装置的特点也有所不同。(1)制取气体的反应,有的需要加热,有的不需要加热。有的反应放热多,有的反应放热少。(2)有的气体溶解度大,有的气体溶解度小,这两种情况影响着倒吸的发生与快慢。除去残留气体时,通过一定时间的冷却(有的不需要冷却)后,再用手触摸烧瓶,当其不发烫(一般在60℃以下,此时的倒吸不会导致容器的破裂)时,再利用气球的胀瘪程度,可以作为判断内外气压大小的标志。以此为依据,决定采取引发倒吸的方法和时机。除去气体时,气球中的气体不能太多(如果其中有较多的气体时,收集起来另行处理),以便于制气烧瓶中倒吸的发生。
通过实践,利用倒吸法除去上述各种气体的实验均获得了成功。
参考文献:
[1]人民教育出版社课程教材研究所化学课程教材研究开发中心编著. 化学·选修4[M]. 北京: 人民教育出版社, 2007: 28.
[2]人民教育出版社化学室编著. 化学·必修加选修(第二册)[M]. 北京: 人民教育出版社, 2003: 44.
[3]人民教育出版社化学室编著. 化学(选修·第三册)[M]. 北京: 人民教育出版社, 1995: 13.
[4]李大塘. 一氧化氮和二氧化氮的制取及其性质实验新裝置[J]. 化学教学, 2001, (2): 52.
[5][6]卢荣耀. 几种常见铜盐溶液的颜色问题[J]. 中学化学教学参考, 2012, (4): 47.
[7]亚硝酸铜是否溶于水: https://wenda.so.com/q/1362809634068610.
