膳食补充剂中蛋白同化雄性类固醇检测研究进展
2021-03-18张贻豪袁毓灵徐友宣陆江海
张贻豪 袁毓灵 徐友宣 陆江海
1 国家体育总局反兴奋剂中心(北京100029)
2 北京体育大学(北京100084)
蛋白同化雄性类固醇(Anabolic androgenic steri⁃ods,AAS)是一类睾酮的衍生物,其结构如图1所示。AAS是兴奋剂检测中阳性率最高并且处罚力度最大的一类违禁物品[1]。随着竞技体育的不断发展,补充合理的膳食补充剂已经成为运动员取得优秀运动成绩的一种必要辅助手段[2],但是多年来关于膳食补充剂中检测出AAS 的阳性案例较多[3]。长期服用含AAS 污染的膳食补充剂不仅对食用人群的身体健康造成伤害,并且还会导致运动员在兴奋剂检测中呈现阳性结果[4]。运动员服用膳食补充剂之前AAS的检测已经成为必不可少的环节,检测的前处理方法与仪器方法是实验的两个关键点,本文从这两个方面进行综述。此外,有研究者通过对AAS 的化学结构进行修饰,从而设计出新型人工合成的AAS[5,6],人工合成的AAS 不仅能逃避现有立法和检测手段对兴奋剂阳性案例事件的处罚,还可以使药物的作用效果更好;这些人工合成的AAS 受到一些不法团队和运动员的追捧,还有流向膳食补充剂市场的动向[7,8]。不断出现的新型人工合成AAS是兴奋剂检测中的难点与重点。

图1 蛋白同化雄性类固醇骨架结构示意图
1 检测前处理方法的进展
1.1 基质干扰
膳食补充剂的产品类型越来越多,基质也越来越复杂,检测样品的基质类型有:片剂、胶囊、软胶囊、口服液、油状物、蛋白粉等[9]。在化学分析中,基质是指样品中除分析物以外的组分,由于基质常常对分析物的检测过程有显著干扰,膳食补充剂中AAS 的有效提取是样品前处理的关键,检测的预处理步骤可以使AAS处于正确的物理状态,再进行仪器检测分析,从而减少基质的干扰[10]。蛋白质与油脂的存在对膳食补充剂中AAS检测的干扰较大,尤其是使用气质联用法时,油脂的存在会影响目标药物的保留时间从而可能造成AAS检测中假阴性事件的发生,此外油脂的干扰不仅会影响色谱柱的使用寿命,还会影响目标药物与衍生化试剂的结合效率。因此,如何从不同基质中有效地把所有目标药物快速提出并去除杂质的干扰是前处理的重点。
1.2 目标药物提取方法
液液萃取法是目前提取目标药物的主要手段[11],但对于不同基质的样品来说,提取的效果会有差异,为了确保膳食补充剂中AAS 的检测效果,需要对不同基质样品中AAS的提取效果进行探究。国内外的相关文献报道的膳食补充剂中AAS前处理步骤的原理较为相似,具体试验流程大致是:取样品加入试管、添加碱性物质调节pH、加入有机溶剂进行液液萃取(LLE),震荡离心后取有机层溶液,将有机溶液在氮气下吹干后加入衍生化试剂并加热20分钟[12]。但具体的前处理步骤却有所差异,具体差异为:加入的碱性溶液不同、选择的有机提取液不同。
1.2.1 碱性物质的选择
AAS 为中性至弱碱性物质,在有机溶剂提取过程中加入碱性溶液有利于去除大量基质的干扰以及AAS从水相中提出,Abbate[13]、Baume[14]、Parr[15]等团队使用KOH 调节溶液的pH;Martello[16]、Thalmayr[17]、Odoardi[18]、房克艳[19]等团队使用NaOH 调节pH,KOH 与NaOH 均为强碱,Schanzer[20]等通过探究AAS的回收率与溶液的pH 的关系发现,强碱可以使部分甾体药物的羟基电离,从而降低AAS在有机溶剂中的提取效果;虽然强碱的加入容易造成部分AAS 的回收率下降,但其可以与油脂发生皂化反应并有利于去除样品中的油性杂质。
Kim[21]、Hajer[12]等团队使用碱性缓冲盐来调节溶液的pH;其中Pozo[22]等在样品中加入0.3 g 质量比为2︰1 的NaHCO3与K2CO3的混合缓冲盐,Hajer[12]等在加入4 mL NaOH 溶液后再加入1 g 碳酸盐使样品的溶液pH保持在9~11之间,Kim[21]等在样品中加入Na2CO3溶液调节样品溶液的pH值为10;在处理不含油脂的样品时,碱性缓冲盐的加入既可以为溶液提供一个碱性的环境有利于提取甾体药物,同时也不会引起溶液pH过高造成甾体药物回收率的降低,在处理非油脂基质的样品时适合用碱性缓冲盐调节溶液的pH。
房克艳[19]、白兆鹏[23]等团队在样品中加入强碱的同时再加入MgCl2溶液,强碱和MgCl2可以与油脂发生化学反应使油脂生成絮状沉淀物,通过震荡后离心可以将絮状物沉淀至下层,通过转移上层有机溶液的方法将油脂沉淀物有效去除。该方法不仅可以利用强碱除去油脂,还可有效避免因pH过高而降低AAS在有机溶剂中的提取效果。
1.2.2 有机体提取液的选择
在样品中加入有机提取液,进行液液萃取过程可以将目标药物从样品中提出,并有助于初步排除部分不溶于有机溶剂的杂质。现有文献中提取目标药物所使用的有机溶剂有所不同,叔丁基甲醚(MTBE)、乙醚、正己烷、正戊烷、甲醇这五种有机溶剂是相关研究中主要的提取液。
Martello[16]、Hajer[12]、Stranorossi[24]、Balcells[25]等团队使用正戊烷和乙醚混合溶液作为膳食补充剂中AAS检测的提取剂,Hajer 通过对比各类有机溶剂对8 种AAS的回收率的影响,发现正戊烷/乙醚为7.5︰2.5 的比例混合时提取效果最佳[12],但乙醚为受控物质不易获取,因此该提取方式在常规实验中不易得到应用。Geyer[26]、Parr[15]、Thalmayr[25]、Baume[27]等团队用95%的甲醇水进行液液萃取,且上述团队在使用有机溶剂提取目标药物之前,增加了正己烷/正戊烷清洗杂质的步骤。从上述文献中可知,该前处理方法去除杂质的效果较好,尤其在处理油脂基质的样品时,能较好地排除样品基质的干扰,但该前处理方法经历两次提取过程,操作较为繁琐。Abbate[13]、房克艳[19]、续倩[28]等团队使用正己烷和MTBE作为提取液进行提取,其中Abbate[13]等使用正己烷作为提取液萃取样品中的目标药物,续倩[28]等使用叔丁基甲醚提取样品中的甾体药物,这两种有机溶液在常规实验中容易获取,且前处理流程较为简便,但上述文献中使用该提取方法检测的药物种类较少,若要证明其在常规实验中的可行性还需要验证该提取方法对其他甾体药物的回收效果。
油脂类样品是膳食补充剂中常见的基质类型,Po⁃zo[22]、Parr[15]、Geyer[26]、Martello[16]、Hajer[12]、Baume[27]等团队的研究中均未包含此基质样品的前处理方案。Neves[3]、Odoardi[18]、房克艳[19]、白兆鹏[23]等团队的研究中包含油脂基质,但其使用的仪器方法为液质联用法;油脂的存在对使用液质联用法检测AAS 的干扰较小,但该类仪器方法无法满足对多数饱和环AAS 的检出,且上述研究所包含的AAS种类数均为10种左右。
2 检测的仪器方法进展
兴奋剂的检测已经成为多学科相互交融的领域[29]。1976年蒙特利尔奥运会,放射免疫法(RIA)作为初筛检测方法是最早用来检测AAS的手段。该方法的原理是使用放射性的标记抗原和未标记抗原(待测物)与不足量的特异性抗体竞争性的结合,反应后分离并测定放射性而求得待测物的量。RIA 具有简便易行、灵敏性强、特异性高、检出限低等优点,但该方法有时会出现交叉反应、假阳性反应、不能满足对AAS大量代谢物检测要求的缺点。随着毛细管柱分离能力的提高和质谱技术的不断完善,色谱法能有效地对有机化合物进行分离,质谱法可以对分离后的物质进行有效地定性分析,色谱法与质谱法的有效结合可以对复杂有机化合物进行高效的定性与定量分析。
目前蛋白同化雄性类固醇的检测主要依靠气相色谱质谱联用法与液相色谱质谱联用法,Martínezsanz 等[9]对以往的膳食补充剂中蛋白同化制剂检测相关文献进行总结,发现使用以上两种检测方法以及两种检测方法结合的形式占总体相关研究的75%。虽然气质联用法和液质联用法是膳食补充剂中蛋白同化制剂的常用检测手段,但是两者都有一定局限[30]。气质联用法能较好检测出AAS 并能实现对其代谢物的检测,且该方法灵敏、稳健,成为检测此类药物的主要检测手段。但是随着四氢孕三烯酮(THG)(如图2所示)等一类药物的出现,该类药物因分子内含有共轭双键,使用气质联用的方法检测效果较差[31]。气质联用方法检测AAS的另一个局限是需要衍生化,前处理步骤比较繁琐。液质联用法能弥补气质联用法不能对THG这类药物检测的问题,且具有前处理步骤相对简单的优势。但是由于多数AAS 分子极性较弱,尤其是饱和环的AAS 在电喷雾电离(ESI)和大气压化学电离(APCI)技术检测中灵敏度低,不适合用液质联用法的方法检测,因此,液质联用法只能作为AAS 检测的辅助手段,气质联用法依然是目前检测该类药物的主要方法。气相-串接质谱(GC/MS/MS)可以消除基质干扰并可以克服气相单极质谱(GC/MS)在选择离子扫描(SIM)中存在离子信息少、定性不准确的问题,从而可以大幅提高检测样品中微量成分的分析,尤其是复杂基质中微量分析的准确性,因此使用GC/MS/MS的仪器方法检测膳食补充剂中的AAS 效果较好。随着气相色谱-高分辨质谱的发展,AAS检测的精确度和灵敏度有望大大提高,气相色谱串联四级杆静电场轨道离子阱质谱(GC/QE)分辨率高、灵敏度强、降噪能力好,且GC/QE 检测的质量范围较宽,可能实现对AAS二相代谢物的检测,但该仪器尚不成熟、价格昂贵,目前很少用于实际检测。
图2 四氢孕三烯酮的结构图
除上述方法之外,酶联免疫法(ELISA)和生物亲和质谱检测方法(Bio-MS)也是膳食补充剂中AAS 检测的辅助手段。ELISA 检测的原理是让抗体与酶复合物结合,然后通过显色方法来检测,该类检测方法具有检测速度快、费用低廉、仪器容易携带等优点。Bio-MS是用于生物分子分析的质谱技术,该方法可以测定上万甚至几十万相对分子质量的物质,且具有灵敏度高、准确度高、检测快速等优点。ELISA 与Bio-MS 还加强了对未知阳性药物的检出能力[32]。肽类激素多用生化方法检测,但上述两种检测方法重现性差、特异性和灵敏性待提高、检测结果难以判断,因此在AAS检测中只是辅助的检测手段。此外,红外光谱、紫外光谱、核磁共振等仪器方法也可用于AAS结构的分析[33]。
3 AAS质谱裂解规律的研究进展
气相色谱-串接质谱法与液相色谱-串接质谱法是目前检测AAS 的主要手段,质谱法对AAS 的检测是建立在已获得标准药物裂解产生已知碎片的基础上,对于未知结构的人工合成AAS 的检测具有一定的局限性。通过对已知AAS衍生物的质谱裂解规律进行归纳总结有助于筛选出类似母核结构的未知人工合成AAS,克服质谱法对未知结构甾体药物无法检出的不足。其中Willi 等团队使用气质联用的方法在AAS 质谱裂解途径方面做了大量研究[34],总结出该类药物不同结构的特征离子碎片及裂解方式并在AAS的质谱谱图解析中广泛使用。
3.1 甾体母核裂解方式
AAS 的裂解方式受其A 环结构的影响较大,Frag⁃kaki[35]等根据AAS 的A 环结构特点将该类药物分为6类,每类AAS的裂解途径均比较相似,例如1,4-二烯-3-羰基类的AAS 均可以从C-9/C-10 和C-7/C-8 处断裂产生m/z 206 碎片离子,该类AAS 衍生化后产生m/z 206 的裂解方式如图3所示;4-烯-3-羰基类的AAS 衍生化后可以从C-9/C-10 和C-7/C-8 处断裂产生m/z 208碎片离子;1-烯-3-羟基类的AAS衍生化后可以从C-1/C-10 和C-3/C-4 处断裂产生m/z 142 碎片离子。通过对上述已经分类AAS 裂解途径的整理,可以了解AAS断裂方式与其A环结构的关系。
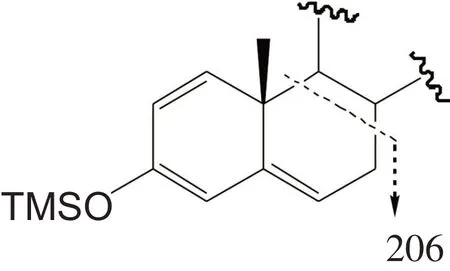
图3 m/z 206碎片离子产生的方式
3.2 特征离子的裂解方式
m/z 129、143、169、218、231 均是AAS 全扫谱图中常见特征离子碎片,这些特征离子碎片的出现同样与AAS的结构特点密切相关[33,34]。例如m/z 129碎片离子是17-羟基类AAS 的特征离子碎片;m/z 143碎片离子是17-甲基,17-羟基类AAS 的特征离子碎片;m/z 169碎片离子是17-羰基类AAS的特征离子碎片;m/z 218、231碎片离子是17-甲基-16,17-二羟基类AAS的特征离子碎片。这些裂解规律在日常检测中的应用有助于下一步建立更合理的检测窗口以提高样品初筛的效率,同样也在为样品初筛中检出未知类似物并初步预测药物的结构提供依据。
4 小结与展望
膳食补充剂的基质复杂,实验前处理方案对不同基质中目标药物的提取效果会有差异,为了提高不同基质样品中AAS 的检测能力,需要结合文献对不同基质的前处理方案进行探究和改进,尤其油脂基质样品的前处理方法是目前研究中的难点。
质谱法具有结果确定、准确度高、检测快速等优点,气质联用法和液质联用法是目前AAS 检测常用的仪器方法,由于AAS多数药物极性较低,气质联用的仪器方法是目前检测该类药物的主要手段。
一些特征离子碎片的产生有多个途径,比如m/z 129、169碎片离子,除了Fragkaki 总结的产生途径外还有其他的裂解方式[35]。m/z 147 也是AAS 裂解常见的碎片离子,但在现有文献中并未提到,AAS的质谱规律需要得到更全面的总结,才能更好地在日常检测中较好地运用。
