低温下运动对肥胖大鼠白色脂肪棕色化及相关调节因子表达的影响
2021-03-18翁锡全王朝格林宝璇陈丽娜胡永芳林文弢
翁锡全 王朝格,4 林宝璇 陈丽娜 胡永芳 林文弢
1 广州体育学院(广东广州510500)
2 昌江一中(江西景德镇333000)
3 广州医科大学(广东广州510500)
4 上海体育学院(上海200438)
肥胖引起各种慢病及并发症的问题已成为当今医学面临的最重大挑战之一[1]。肥胖是由于机体长期处于正能量平衡导致多余的能量转化成甘油三酯( tri⁃glyceride,TG)储存在脂肪组织(adipose issue,AT)中并堆积在体内而形成的[2]。因此,逆转肥胖机体正能量平衡状态是治疗的关键。早期治疗肥胖的方法大多都集中在减少能量的摄入[3],但迄今为止,这些方法均未达到良好的效果,因为在减少能量摄入的同时机体会代偿性降低能量消耗,因此,越来越多的研究转向如何增加肥胖机体的能量消耗[4]。近些年来,棕色脂肪组织(brown adipose tissue,BAT)是该领域研究热点之一。BAT 具有氧化脂肪酸并释放热量的能力。然而,成年哺乳动物体内的BAT量很少,肥胖人群体内更少[5-7],因此,如何增加体内BAT 含量成为研究的焦点。研究发现[8],冷暴露或运动均可促进白色脂肪组织(white adi⁃pose tissue,WAT)棕色化,使WAT转化为与BAT功能相似的米色脂肪组织。米色脂肪组织和BAT的一个共同特点是具有高表达的解偶联蛋白1(uncoupling pro⁃tein 1,UCP1),UCP1 可使呼吸链与氧化磷酸化解偶联,增加机体能量消耗,从而促进脂肪有氧氧化过程[9]。在调节BAT产热和WAT棕色化的过程中腺苷酸活化蛋白激酶(adenosine 5’-monophosphate -activated protein kinase,AMPK)起着重要作用[3],且过氧化物酶体增殖物激活受体γ辅助激活因子α(peroxisome prolif⁃erator-activated receptor γ coactivator-1α,PGC-1α)是唯一可通过冷诱导在非BAT细胞系中激活UCP-1表达上调的蛋白[10],同时也发现[11],运动可能通过AMPK信号通路激活PGC-1α过表达进而增加UCP1 的表达,促进白色脂肪棕色化,增加机体能量消耗,进而逆转正能量平衡,达到减脂降体重目的。本研究以营养性肥胖SD 大鼠为研究对象,观察5 周低温环境下运动后大鼠内脏脂肪、皮下脂肪、棕色脂肪质量及其与体重的比率变化,腹股沟脂肪AMPK、PGC-1α、UCP-1 蛋白表达变化,探讨低温运动对肥胖大鼠白色脂肪棕色化及相关调节因子的影响,为低温运动减肥提供方法与理论依据。
1 材料与方法
1.1 动物分组与干预方案
4 周龄雄性SD 大鼠[SCXK(粤)2011-0015]以高脂饲料喂养9 周建立营养性肥胖大鼠模型,判定标准为高脂膳食大鼠体重超过普通膳食大鼠体重的20%[12],且统计学上体重、Lee’s指数、血脂四项、血糖等指标均与普通饲料膳食大鼠有显著性差异[13]。成模率为80%。取造模成功的大鼠32 只随机分为常温安静组(normal temperature sedentary group,NTS组)、常温运动组(nor⁃mal temperature exercise group,NTE 组)、低温安静组(cold environment sedentary group,CES 组)、低温运动组(cold environment exercise group,CEE 组),每组8只,分笼饲养。实验在智能人工气候室进行,常温环境温度控制在24℃~26℃,低温环境温度控制在3℃~4℃,相对湿度均为50%~60%。运动组隔天进行2 次跑台运动,每次30 min,间歇10 min,跑速为25 m/min,坡度为0,持续5 周,安静组不运动。实验期间大鼠仍以高脂饲料[购自广东省医学实验动物中心,许可证号SCXK(粤)2013-0002,能量比:蛋白质17.5%,脂肪37%,碳水化物45.5%]饲养,自由饮食,每天记录食量、称体重和测体长,并计算Lee’s 指数(Lee,s 指数=[14]。
1.2 样品采集与检测
所有大鼠在实验结束后禁食12 h,测量体长、称重,给予10% 水合氯醛(0.3 ml/100 g)麻醉,固定,采用Micro-CT LCT200检测内脏脂肪、皮下脂肪、棕色脂肪和体脂质量及其与体重的比率,并以棕色脂肪CT扫描图像进行3D 软件重建灰度图,获取灰度值,随后解剖采集腹股沟脂肪,用预冷生理盐水清洗,滤纸吸干组织表面水分后备用。
取腹股沟脂肪100 mg后置于液氮中充分研磨后,加入预先加好蛋白酶抑制剂(CW0037,康为世纪公司)的RIPA 裂解液(CW2333S,康为世纪公司)中,充分混匀,冰上裂解1h后离心取上清。使用BCA蛋白测定试剂盒(CW0014,康为世纪公司)测定所有样品的蛋白浓度,加入相应比例的RIPA 裂解液将浓度调为一致,再加入5X 上样缓冲液(CW0027S,康为货号),混匀后沸水浴10 min,10% SDS-PAGE 凝胶电泳100 V、120 min,250 mA、90 min 转膜,3%的BSA 室温封闭1 h。用1%BSA-TBST 1︰1000稀释一抗(AMPK、PGC-1α、UCP1、GAPDH),4℃摇床过夜。次日洗膜后,加入HRP标记的二抗(1︰3000)室温孵育1 h。5次TBST洗膜后置于化学发光成像系统(天能5200),均匀滴加ECL 化学发光试剂(34095,Thermo Scientific)进行曝光显影,使用Image J软件进行图像分析,以目的蛋白与内参蛋白比值代表AMPK、PGC-1α及UCP1蛋白相对表达量。
1.3 统计学分析
采用SPSS 22.0软件进行统计分析,数据均以平均值± 标准差表示,组间比较采用单因素方差分析,P<0.05为显著性差异,P<0.01为非常显著性差异。
2 结果
2.1 5周实验前后大鼠食量、体重及Lee’s指数变化
由表1可知,5 周实验干预后,与常温组(常温安静、常温运动)比较,低温组(低温安静、低温运动)食量显著或非常显著增加(P<0.05,P<0.01),但运动组(常温运动、低温运动)均显著低于其对应的安静组(常温安静、低温安静)(P<0.05);低温运动组体重最低,显著或非常显著低于其余三组(P<0.05,P<0.01),常温运动组体重也比常温安静组显著下降(P<0.05);低温运动组大鼠Lee’s 指数显著低于常温安静组、低温安静组(P<0.05)。
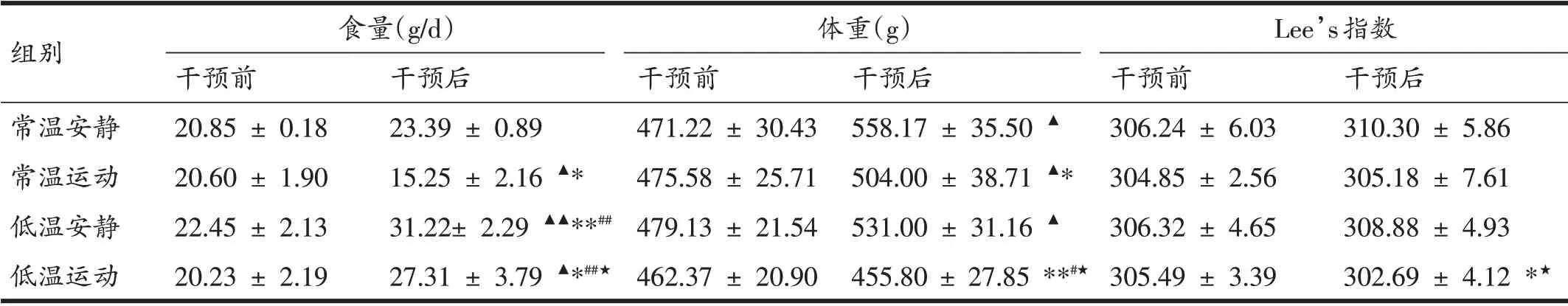
表1 5周实验前后大鼠食量、体重及Lee’s指数比较(n=8)
2.2 5周实验后大鼠内脏脂肪、皮下脂肪、棕色脂肪、体脂质量及其与体重的比率
从LCT200 检测棕色脂肪3D 重建灰度图可见,灰度值从低到高依次为常温安静组、常温运动组、低温安静组、低温运动组,以低温运动组大鼠棕色脂肪覆盖面大、灰度值最高(图1);表2显示,5周实验后,与对应安静组比较,运动组大鼠内脏脂肪、皮下脂肪和脂肪总质量均显著下降(P<0.05,P<0.01),且以低温运动组大鼠内脏脂肪、皮下脂肪、脂肪总质量最少;低温运动组大鼠内脏脂肪率、体脂率均显著低于常温安静组、常温运动组和低温安静组(P<0.05,P<0.01),其次是常温运动组显著低于常温安静组和低温安静组(P<0.05,P<0.01);低温安静组皮下脂肪率显著高于常温运动(P<0.05),而低温运动组显著低于常温安静组和低温安静组(P<0.05)。棕色脂肪率结果显示,低温组(低温安静、低温运动组)都显著高于常温组(常温安静、常温运动组)(P<0.05),四组中低温安静组最高,而常温安静组最低,低温运动组略低于低温安静组,常温运动组略高于常温安静组,但无统计学意义(P>0.05)。

图1 Micro-CT检测棕色脂肪3D重建灰度图

表2 5周实验后大鼠内脏脂肪、皮下脂肪及棕色脂肪、体脂质量及其与体重的比率
2.3 5 周实验后大鼠腹股沟脂肪AMPK、PGC-1α及UCP1蛋白的表达
图2显示,5 周干预后,低温运动组大鼠腹股沟脂肪AMPK、PGC-1α、UCP1 蛋白表达较其余三组均显著上调(P<0.05,P<0.01),常温运动组、低温安静组三种蛋白表达也比常温安静组显著上调(P<0.05,P<0.01),且低温安静组AMPK、UCP1 表达较常温运动组显著上调(P<0.05)。

图2 5周实验后大鼠腹股沟脂肪AMPK、PGC-1α及UCP1蛋白的表达
3 讨论与分析
3.1 低温下运动对肥胖大鼠食量、体重及Lee’s指数的影响
近些年来,基于低温暴露或寒冷刺激使机体产热增加而促进脂肪代谢达到减肥的原理已在日常生活中应用。不同的是,运动可使机体分泌抑制食欲的激素而限制对能量的摄入[15],如King 等研究表明[16],跑步90 min后会导致血浆生长素释放肽浓度和主观饥饿感明显降低。Martins 等发现实验组以65% VO2max进行耐力运动后胃肠肽类激素酪酪肽(peptide tyrosine ty⁃rosine,PYY)和胰高血糖素样肽(glucagon-like pep⁃tide-1,GLP-1)显著升高,且能量摄入显著少于对照组[15]。此外,一项对比不同强度耐力运动对食欲影响的研究中显示,高强度(75% VO2max)较低强度(50%VO2max)的耐力运动在运动后血浆GLP-1 和PYY 浓度显著升高,进食量降低[17]。这些研究都表明,耐力运动通过影响调节食欲的激素进而降低食欲减少能量摄入。而运动引起的食欲调节激素反应受环境温度影响而变化,低温环境下运动可使促进食欲的激素分泌增多而增加能量的摄入。Tomasik 等证明血浆生长素释放肽浓度在2°C 时明显高于30°C[18]。Crabtree 等发现[19],与20℃环境比较,在8℃环境中运动后能量摄入显著增加。Wasse 等发现[20],在10℃环境中运动后能量摄入显著高于30℃。本研究是在不控制饮食的前提下进行,实验结束时虽未对调控食欲的相关激素进行测定,但从5 周干预期间每天食量来看,首先,低温安静组每天食量非常显著高于常温安静组,这进一步证实了低温环境下可引起能量摄入增加;其次,不管是常温还是低温环境,运动组每天食量均低于安静组,说明无论是在常温或者低温环境下运动均可抑制大鼠食欲。当然由于寒冷刺激,低温运动组每天食量较常温运动组多,但又比低温安静组少,说明运动对低温刺激引起的能量摄入增加有一定抑制作用。
尽管低温环境下大鼠食量增加,但从大鼠体重来看,不管是安静还是运动状态,低温环境下的大鼠体重都较常温组低,且以低温运动组大鼠体重降低最为明显,说明低温暴露或/和运动通过交感神经兴奋促进机体产热作用远大于能量摄入,从而更容易使肥胖大鼠体重下降,这一结果与国内外研究一致[21-24]。此外,从反映大鼠肥胖程度的另一指标Lee’s 指数来看,有研究指出有氧或者耐力运动可以降低高糖高脂饮食大鼠Lee’s 指数[25-27],本研究结果表明低温暴露或/和运动可不同程度降低高脂饮食肥胖大鼠Lee’s指数,但低温暴露和运动单一刺激效果不具有统计学意义,只有低温下运动能有效改善大鼠肥胖程度。因此,认为低温下运动能够更好地逆转肥胖大鼠的正能量平衡,并抑制其食量,达到减肥的效果。
3.2 低温下运动对肥胖大鼠白色脂肪棕色化的影响
基于脂肪在体内分布、形态和功能差异,通常将哺乳动物的脂肪分为白色脂肪组织和棕色脂肪组织。在大鼠体内,WAT主要分布于内脏和皮下组织,BAT主要分布于肩胛间、肩胛下、腋下等部位。WAT 以TG 的形式储存能量,TG 须经水解、动员成为游离脂肪酸形式才能被其他组织氧化释放能量,而BAT 细胞含有大量线粒体,可直接氧化脂肪酸释放能量。因此,可通过增加机体BAT产热达到减脂目的。近些年来的研究也发现[28],通过寒冷、低氧、运动或营养、激素等刺激引起体内多重调控机制将WAT 转化为具有类似BAT 功能的另一种脂肪组织类型米色脂肪组织,这个过程称为白色脂肪棕色化,且白色脂肪棕色化的发生主要集中在皮下腹股沟脂肪组织(subcutaneous adipose tissue,SAT)中。因此,通过调节不同类型脂肪组织增殖改变脂肪组织在体内的分布可达到降体重的目的。
低温和运动均可对不同类型脂肪组织有特定的影响。Lehnig等发现[29],运动可以减少SAT中脂肪细胞的大小和脂质含量,同时还增加SAT 中脂肪细胞内线粒体数量,改善糖、脂代谢水平,但与SAT相反,运动刺激虽然减少内脏脂肪(visceral adipose tissue,VAT)的质量,但没有增加VAT中与糖、脂代谢相关基因的表达水平及线粒体数量,这可能是因为运动主要激活了皮下白色脂肪细胞转变为米色脂肪细胞。运动刺激促进SAT 白色脂肪棕色化效应与低温刺激的效应是一致的。Vitality 等发现[30],低温刺激小鼠损失的白色脂肪组织中细胞数量与新增的米色脂肪组织中细胞数量相等。Rosenwald 等研究也显示[31],在8℃低温中小鼠的SAT 中出现米色脂肪细胞,恢复常温后消失。但运动和低温对BAT 的影响却是矛盾的,无论是长期或短期低温刺激都可增加BAT的体积和质量[32-33],增加机体非颤抖性产热,以提高低温环境下机体体温调节能力。与BAT 产热方式不同,运动过程中则以肌肉收缩产热提高机体的核心体温[34],因此,在运动过程中可能会抑制BAT 的产热活动[35]。Wu 等发现[36],高糖高脂饮食诱导的大鼠BAT 活性增高,经过8 周跑台运动后活性降低;Larue 等研究结果显示[37],运动可使低温中大鼠体重、WAT质量和BAT活性均有所下降。从本研究结果来看,在高脂自由饮食的条件下,无论是常温运动还是低温运动均能显著减少肥胖大鼠VAT和SAT质量及其比率,使体脂减少,体脂率下降,但常温下运动的大鼠BAT 质量及其比率无明显变化,而低温下运动的大鼠BAT 质量虽没有显著增加,但其比率却显著高于常温下生活和运动的大鼠,提示单纯运动对激活BAT 增殖作用不大;从低温暴露的肥胖大鼠来看,其VAT、SAT及其比率未明显下降,但BAT 质量及其比率则显著增加,全身体脂及体脂率有所下降,这说明长期生活在低温中的肥胖大鼠为维持体温,更加依赖BAT 和SAT 棕色化后的产热,白色脂肪棕色化增强。以上结论可从棕色脂肪3D 重构灰度图得到进一步说明。棕色脂肪3D重建灰度图是根据CT对全身棕色脂肪的扫描结果,其灰度值代表体内棕色及棕色化脂肪组织的总和。5周实验后,低温安静组大鼠棕色脂肪灰度值仅次于低温运动组,说明低温能显著诱导BAT 活性增强及白色脂肪棕色化效应提高,总体棕色脂肪组织活性增强。当然对于低温下运动的大鼠来说,一方面运动抑制低温诱导的棕色脂肪组织增殖,但另一方面却促进了皮下脂肪组织的白色脂肪的棕色化效应,结果使低温运动组大鼠整体棕色脂肪组织灰度值最高。因此,我们认为,低温下运动更能有效促进白色脂肪棕色化效应,减少肥胖大鼠体内白色脂肪组织,降低体脂率,这对改善由白色脂肪组织增多而引起的相关代谢疾病有着积极作用。
3.3 低温下运动对大鼠腹股沟脂肪AMPK、PGC-1α、UCP1蛋白表达的影响
本研究通过检测大鼠腹股沟脂肪组织中AMPK、PGC-1α及UCP1 蛋白表达来观察低温或/和运动中白色脂肪棕色化相关蛋白和信号通路的变化。AMPK 是细胞能量调节器,AMPK 可通过上调乙酰乙酸辅酶A羧化酶、细胞色素C和UCP1等基因表达来促进白色脂肪棕色化,同时,AMPK 能激活PGC-1α;PGC-1α是白色脂肪棕色化过程中的重要转录因子,是线粒体生物合成、氧化磷酸化和BAT 产热的主要调节因子,PGC-1α可上调UCP1 的表达。UCP1 是线粒体内膜蛋白,其功能是通过解偶联使ATP 合成受阻来增加产热过程,因此,UCP1 被认为是白色脂肪棕色化的标志性蛋白。研究表明,寒冷和运动均可激活骨骼肌和脂肪组织中AMPK的表达,同时,寒冷刺激一方面通过诱导脂肪组织的成纤维细胞生长因子21(Fibroblast growth factor 21,FGF21)表达而上调PGC-1α水平,促进皮下白色脂肪棕色化作用[38];另一方面低温可通过β3 肾上腺素受体-环腺苷酸-蛋白激酶A 信号通路,诱导脂肪组织中UCP1蛋白的表达[39],缺乏UCP1或PGC-1α的小鼠实验表明[40],PGC-1α可能是唯一可以在非BAT细胞系中有效激活UCP1 增强的因子。关于运动对白色脂肪组织的调节作用,Xu等的研究指出[41],运动后小鼠的白色脂肪组织中线粒体数目和PGC-1α、UCP1 等棕色脂肪组织标志基因水平升高,提示运动促进小鼠皮下脂肪棕色化。本研究结果支持了上述观点,同时观察到,低温暴露刺激大鼠腹股沟脂肪组织中AMPK、PGC-1α、UCP1蛋白的表达比常温下运动显著上调,而低温下运动又比单一低温暴露更能促进大鼠腹股沟脂肪组织中AMPK、PGC-1α及UCP1 蛋白的表达。其原因可能是常温下运动仅通过骨骼肌的收缩引起AMPK、PGC-1α在肌肉过表达,然后才诱导皮下脂肪中UCP1 表达,而低温刺激则通过颤抖性产热使骨骼肌收缩和激活交感神经系统引起的非颤抖性产热的共同作用,从而使腹股沟AMPK、PGC-1α、UCP1 表达量更多。当然,大鼠在低温下运动,为适应机体产热耗能增多,除了骨骼肌能量代谢外,还可通过激活BAT 和诱导腹股沟脂肪组织中AMPK、PGC-1α、UCP1 过表达来促进白色脂肪棕色化增加产热,因此,低温运动组大鼠腹股沟脂肪组织中AMPK、PGC-1α、UCP1 蛋白表达量最高,表明其腹股沟白色脂肪组织发生棕色化效应最明显,大鼠脂肪酸氧化能力提高,热量释放增加,从而减少身体脂肪组织的堆积,达到减脂、降体重的效果。
4 小结
综上所述,低温、运动以及低温下运动均可促进白色脂肪棕色化效应,减少体内白色脂肪组织的含量,达到减脂、降体重效果,其中以低温下运动效果最明显,这种效应与肥胖大鼠腹股沟脂肪组织中AMPK、PGC-1α、UCP1蛋白表达上调同步。
