运动对生长发育期高脂饲养大鼠棕色脂肪组织功能调控相关基因表达的影响
2021-03-18宋鸽邓懿敏徐瑞冯俊鹏倪震严翊
宋鸽 邓懿敏 徐瑞,2 冯俊鹏 倪震 严翊
1 北京体育大学运动人体科学学院(北京100084)
2 南京体育学院运动健康学院(南京210014)
3 北京体育大学中国运动与健康研究院(北京100084)
高脂饮食会引起机体营养过剩,从而显著改变细胞代谢水平,引发胰岛素抵抗、脂质积累异常以及骨骼肌和脂肪组织中细胞因子表达和分泌的异常,从而造成肥胖和与肥胖相关的代谢性疾病[1-5]。以快餐饮食为代表的“西方饮食”现在越来越受青少年儿童的喜爱,而这种饮食以高脂、低营养素的特征已诱发越来越多的儿童肥胖,并且这种饮食模式已经成为影响青少年儿童健康的主要危险因素[6,7]。
近50年来,全球超重与肥胖儿童数量骤增,而近几年,发达国家地区超重与肥胖儿童数量虽然庞大,但增长较为平缓,相反,在发展中国家增长率逐年上升[8]。近30年来,我国儿童超重率与肥胖率显著增加,虽然低于欧美发达国家水平,但因为人口基数大,我国超重肥胖儿童的数量仍十分惊人[9]。而早期的营养过剩可能会永久性改变机体能量和葡萄糖的稳态,从而增加成人肥胖与患糖尿病的风险[10-12]。
近些年来,虽然运动已成为防治能量失衡引起的儿童青少年超重/肥胖的有效手段之一,但其作用机制尚不明确。有研究指出运动可以促进白色脂肪棕色化,但运动对棕色脂肪组织的影响研究较少。有研究指出,机体的棕色脂肪组织含量还与发育阶段性成熟水平[13,14]高度相关。鉴于此,本研究通过动态观察高脂饲养对生长发育期大鼠棕色脂肪组织(brown adi⁃pose tissue,BAT)功能调控相关基因——骨形态发生蛋白-4(bone morphogenetic protein-4,BMP-4)、过氧化物酶体增殖物激活受体γ辅激活因子1α(peroxisome proliferative activated receptor-γ coactivator-1α,PGC-1α)、过氧化物酶体增殖物激活受体γ(peroxisome pro⁃liferator-activated receptor gamma,PPAR-γ)和解偶联蛋白-1(uncoupling protein 1,UCP-1)mRNA 表达的影响,以及运动的动态干预效果,为运动防治儿童青少年超重/肥胖提供实验依据,探索运动防治儿童青少年超重/肥胖的可能靶点。
1 对象与方法
1.1 动物与分组
54 只3 周龄SPF 清洁级雄性SD 大鼠,购自北京维通利华实验动物中心,许可证编号:SCXK(京)2012-0001,进行体重与体长测量,适应性喂养3 天后,随机选6 只设置为基础对照组,而后随机分为标准安静组(C组)、标准运动组(CE组)、高脂安静组(HC组)、高脂运动组(HE组),每组12只。各组大鼠分别在6周龄、8周龄时随机宰杀6只(表1、图1)。大鼠标准笼饲养,饲养环境温度控制在20℃ ± 3℃,相对湿度为50%~60%,昼夜时间为12 小时,标准组大鼠喂饲普通饲料(D12450B,脂肪占总能量的10%,糖类占总能量的70%,3.85 kcal/g),高脂组大鼠喂饲高脂饲料(D12451,脂肪占总能量的45%,4.73 kcal/g),每天记录摄食量,并在每周结束时计算每只鼠该周日均摄食量和日均摄食能量。所有大鼠均自由饮食、饮水。动物实验符合北京体育大学动物伦理委员会要求。

表1 实验动物分组
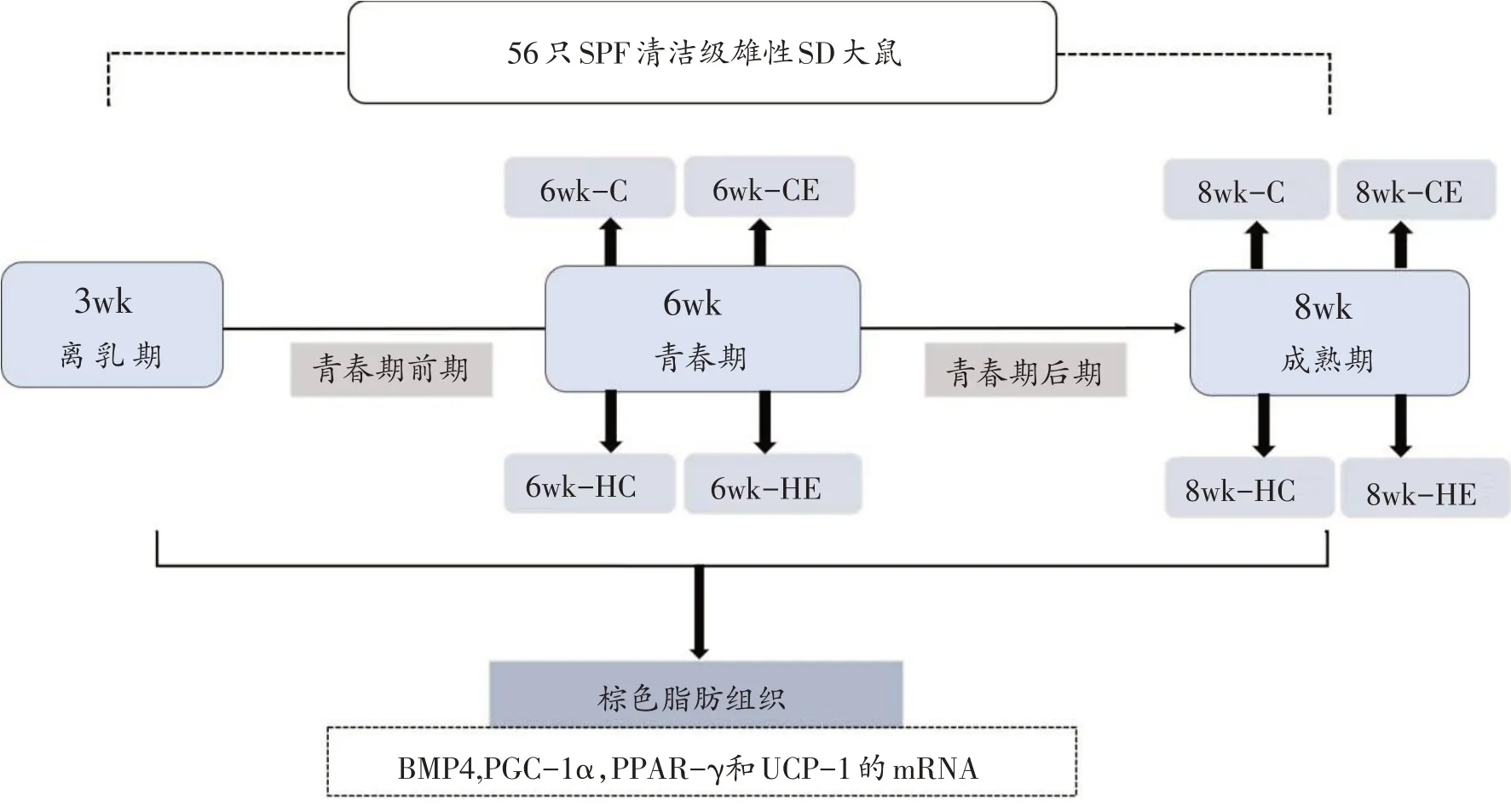
图1 实验分组流程图
1.2 运动方案
运动组大鼠使用动物跑台(大鼠跑台DSPT-208,杭州段式制造)进行运动训练。经过3 天适应性训练后,运动组大鼠进行5周,每周5天,每天1小时的跑台训练。运动干预强度为60%~70%最大摄氧量,每两周测定一次大鼠的最大摄氧量,进行速度校准。大鼠最大摄氧量的测试方案采用Leandro[15]等的改良方案,测试仪器为开放环路量热计(Oxymax Deluxe System,哥伦布仪器,美国),根据所测得的最大摄氧量对应的跑台速度,确定不同最大摄氧量百分比运动强度对应的跑台运动速度。每次训练的时段相同。
1.3 取材
依据课题组前期研究结果,分别在大鼠3周龄(幼儿期)、6周龄(青春期前期)和8周龄(青春期后期)时,每组随机选取大鼠6 只进行腹腔2%戊巴比妥钠(0.25 ml/100 g)麻醉后,进行体重与体长测量及Lee’s 指数(Lee’s 指数[16]=体重^(1/3)/体长×1000)计算,而后腹主动脉取血致死,取大鼠肩胛部棕色脂肪组织,迅速用干净锡纸包好后放入液氮冷冻,之后存入-80℃冷冻保存。
1.4 mRNA相对含量的测定
1.4.1 总RNA的提取、浓度测定和逆转录
使用TIANGEN动物组织总RNA提取试剂盒(离心柱型)按照说明书提取上述脂肪组织的总RNA,并使用紫外分光光度计Thermo NANODrop2000 测定浓度及纯度,剔除不合格样品。后使用TOYOBO ReverTra Ace qPCR-RT Kit 通过PCR 扩增仪MyGeneTM Series Peltier Thermal Cycler MG96+对提取的总RNA进行逆转录。
1.4.2 RT-qPCR反应
使用TAKARA 公司SYBR Premix Ex Taq II 试剂盒,以及生工基因公司b661201-0001大鼠内部参照基因rps18及mRNA引物对BMP-4、PGC-1α、PPAR-γ和UCP-1 基因进行扩增,引物序列见表2。扩增体系为:10 μl 的SYBR Premix Ex Taq II(Tli RNase Plus)(2×),0.8 μl 的引物F(10 μM),0.8 μl 的引物R(10 μM),2 μl 的cDNA 模板,0.4 μl 的ROX Reference Dye II(50×),加Rnase-free ddH2O至20 μl。PCR反应条件为:95℃预变性30 s,循环扩增95℃5 s→60℃30 s-34 s(循环40 次),反应结束后确认Real Time PCR的扩增曲线和融解曲线,进行PCR 定量时制作标准曲线,利用CT值求得各样本基因表达量等。
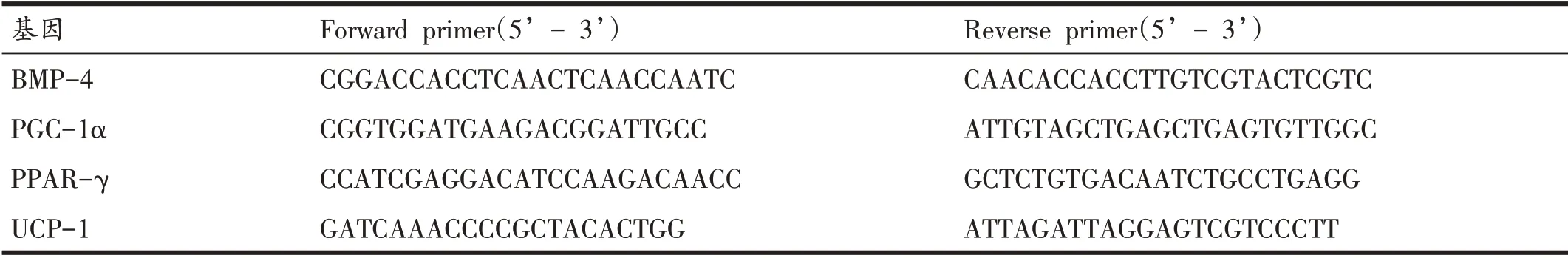
表2 各基因引物碱基序列
1.5 数理统计
用EXCEL 2010、SPSS 17.0 统计软件进行数据统计分析,所有数据表示为平均数± 标准差。数据采用三因素方差分析,周龄变化因素(3 wk,6 wk,8 wk),运动干预因素(对照组,运动组),饮食干预因素(标准饲料组,高脂饲料组)进行3(周龄)×2(运动)×2(饮食)三因素方差分析,若自变量之间存在三因素交互作用,继续进行简单两因素交互作用分析,如果存在简单两因素交互作用,则采用简单单独效应检验;如果自变量之间不存在三因素交互作用,则进行两因素交互作用分析,如果存在两因素交互作用,则进行单独效应检验,P<0.05为差异具有统计学意义。
2 结果
2.1 各组大鼠摄食量与摄食能量的变化
本实验饲养大鼠共5 周,各组日均摄食量随周龄变化而逐渐增多,前三周增长速度最快,高脂运动组每日摄食量最低。以生长发育、饮食方式和运动三个干预因素对大鼠摄食能量进行三因素交互作用分析,发现存在显著的三因素交互作用(P<0.001),生长发育×运动方式、生长方式×饮食方式、运动方式×饮食方式交互作用均显著(均P<0.001),以生长发育为主效应作用显著(P<0.001),以饮食方式为主效应作用显著(P<0.001),以运动方式为主效应作用显著(P<0.001)。第二周和第四周标准运动组每周日均摄食能量低于标准安静组(P<0.05),实验期间高脂安静组每周日均摄食能量均高于标准安静组(P<0.01),高脂运动组每周日均摄食能量均高于标准运动组(P<0.01),第二周到第五周,高脂运动组每周日均摄食能量均低于高脂安静组(P<0.01)。见图2、3。
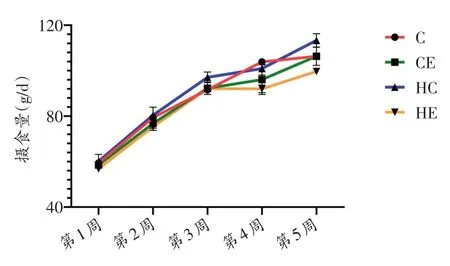
图2 各组大鼠每周日均摄食量(只/g/d)
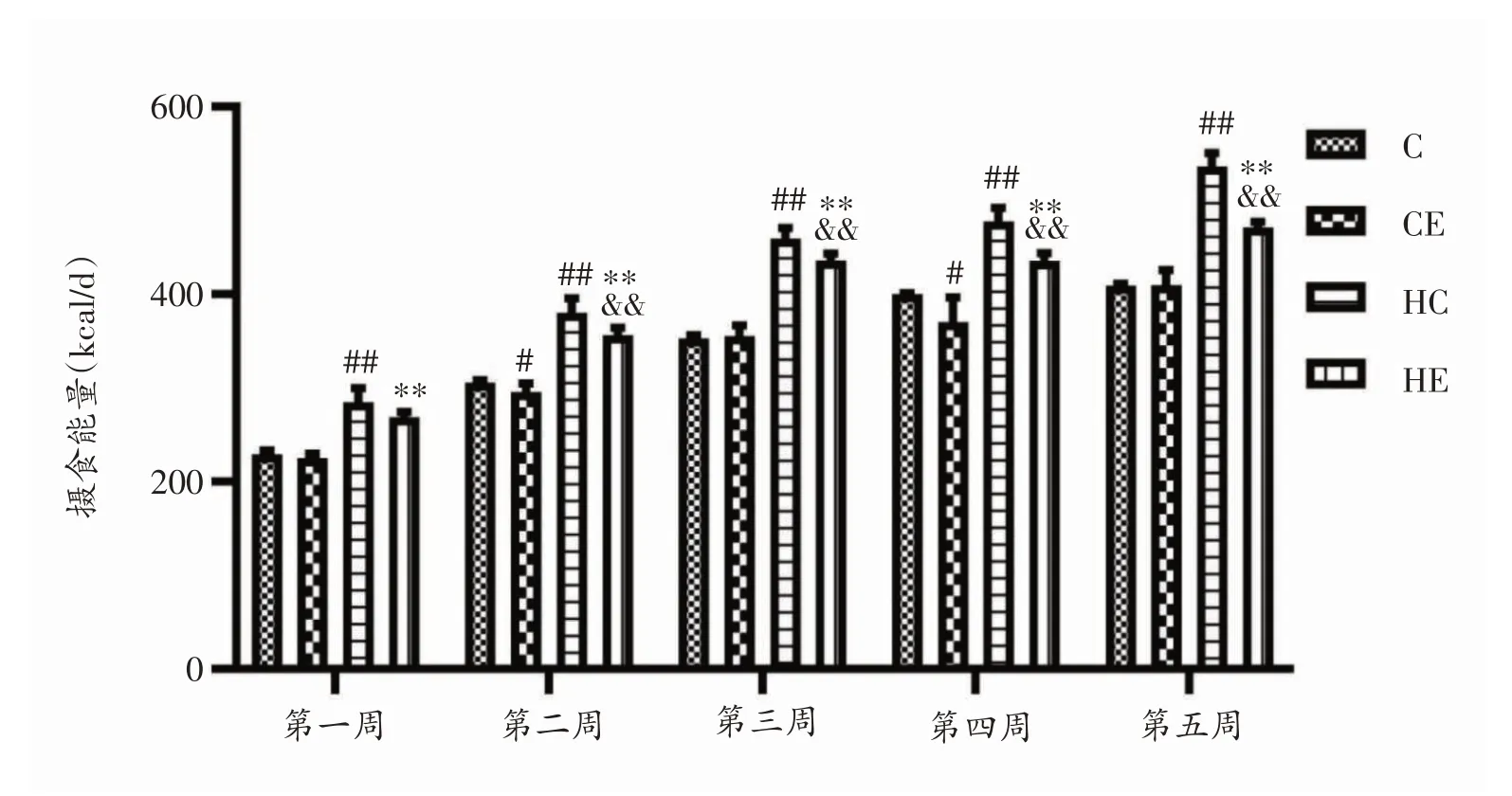
图3 各组大鼠每周日均摄食能量(只/天/kcal)
2.2 各组大鼠体重、体长的变化
以生长发育、饮食方式和运动三个干预因素对大鼠体长进行三因素交互作用分析,发现其三因素与两因素交互作用均不显著(P>0.05),大鼠体重存在显著的三因素交互作用(P=0.047),生长发育×运动方式交互作用显著(P=0.002),以生长发育为主效应作用显著(P<0.001),以饮食方式为主效应作用显著(P<0.001),以运动方式为主效应作用显著(P=0.004)。各组大鼠体重、体长均随生长发育逐渐增加,其中,6周龄大鼠高脂安静组体重和体长较标准安静组均显著增加(P<0.05),高脂运动组体重和体长较标准运动组均显著增加(P<0.01)。8 周龄大鼠标准运动组体重和体长较标准安静组显著减少(P<0.01),高脂运动组体重和体长较标准运动组均显著增加(P<0.01)。见图4。
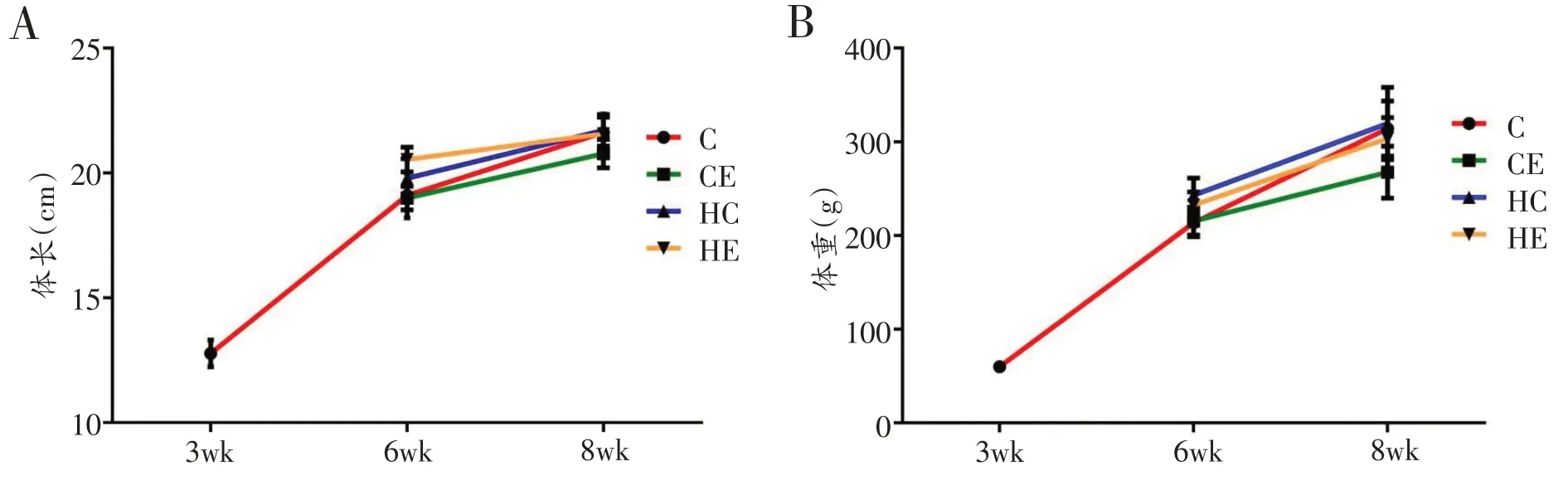
图4 大鼠体长与体重变化趋势
2.3 各组大鼠Lee’s指数的变化
以生长发育、饮食方式和运动三个干预因素对大鼠Lee’s指数进行三因素交互作用分析,发现其三因素与两因素交互作用均不显著(P>0.05)。在大鼠从3 周龄到8周龄的生长发育过程中,运动组大鼠Lee’s指数变化在标准饲养和高脂饲养组出现了相反的变化趋势,其中在标准运动组中,6周龄显著增加(P<0.05)。6周龄时,高脂运动组Lee’s指数较标准运动组和高脂安静组均显著下降(P<0.01)。8周龄高脂运动组Lee’s指数显著高于6周龄高脂运动组(P<0.05)。见表3。

表3 各组大鼠Lee’s指数(n=6)
2.4 各组大鼠棕色脂肪组织中各基因相对表达量的变化
以生长发育、饮食方式和运动三个干预因素对大鼠棕色脂肪组织各基因结果进行三因素交互作用分析,其中BMP-4 mRNA和PGC-1α mRNA表达量存在显著的三因素交互作用(P<0.001),且生长发育×饮食方式交互作用显著(P<0.001),生长发育×运动方式交互作用显著(P<0.001),以生长发育为主效应作用显著(P=0.005),以运动方式为主效应作用显著(P<0.001)。大鼠PPAR-γ mRNA三因素和两因素交互作用均不显著(P>0.05),以生长发育为主效应作用显著(P=0.039)。大鼠UCP-1 mRNA 三因素交互作用不显著(P>0.05),三因素两两配对进行双因素方法分析,生长发育×饮食方式交互作用显著(P=0.004),且以生长发育为主效应作用显著(P<0.001),以饮食方式为主效应作用显著(P<0.001),6 周龄时,饮食方式×运动方式交互作用显著(P=0.004),且以运动方式为主效应作用显著。
同时,在施工当中还可以采用防水防渗涂料,在墙体当中进行防水防渗层的涂抹,在实际的涂抹中需要根据相关要求实施。涂抹方式在选用中尽可能的采用从上往下的方式进行涂抹,涂抹高度不能大于相应的标准值;对于墙面连接的位置需要加强重视,墙面当中多余的水泥浆等都会对涂层防水防渗性能产生影响,因此就需要将墙体处理干净实施涂抹。
由图5A 可见,在大鼠从3 周龄到8 周龄的生长发育过程中,大鼠棕色脂肪组织BMP-4 mRNA表达量在标准安静组出现6周龄显著降低(P<0.01);高脂安静组的变化趋势与安静组相似,仅在8周龄时出现较6周龄显著增加(P<0.05);标准运动组出现先升高(P<0.01)后降低(P>0.05)的变化趋势,且始终高于同龄标准安静组;高脂运动组出现先降低后升高的变化趋势(P>0.05),且始终高于同龄高脂安静组(P<0.05)。
由图5B 可见,在大鼠从3 周龄到8 周龄的生长发育过程中,大鼠棕色脂肪组织PGC-1α mRNA 表达量在标准安静组有增加的趋势,并在8 周龄时差异具有统计学意义(P<0.05);在高脂安静组出现先升高后降低的变化趋势(P<0.01);标准运动组有增加的趋势(P>0.05);高脂运动组出现先降低后升高的变化趋势(P<0.01)。
由图5C 可见,在大鼠从3 周龄到8 周龄的生长发育过程中,各组大鼠棕色脂肪组织PPAR-γ mRNA 表达量无显著差异(P>0.05),但在标准安静组、标准运动组和高脂组均出现先降后升的变化趋势。
由图5D 可见,在大鼠从3 周龄到8 周龄的生长发育过程中,大鼠棕色脂肪组织UCP-1 mRNA表达量在标准安静组由先降后升的变化趋势,但始终显著低于3周龄基础对照组(P<0.01);在高脂安静组出现持续降低的变化趋势(P<0.05),但始终高于同龄标准安静组(P<0.01);标准运动组的变化趋势与标准安静组一致(P>0.05);高脂运动组的变化趋势与高脂安静组相似,但均低于高脂安静组,并在6周龄时出现显著差异(P<0.05)。同周龄,高脂安静组显著高于标准安静组(P<0.01)。
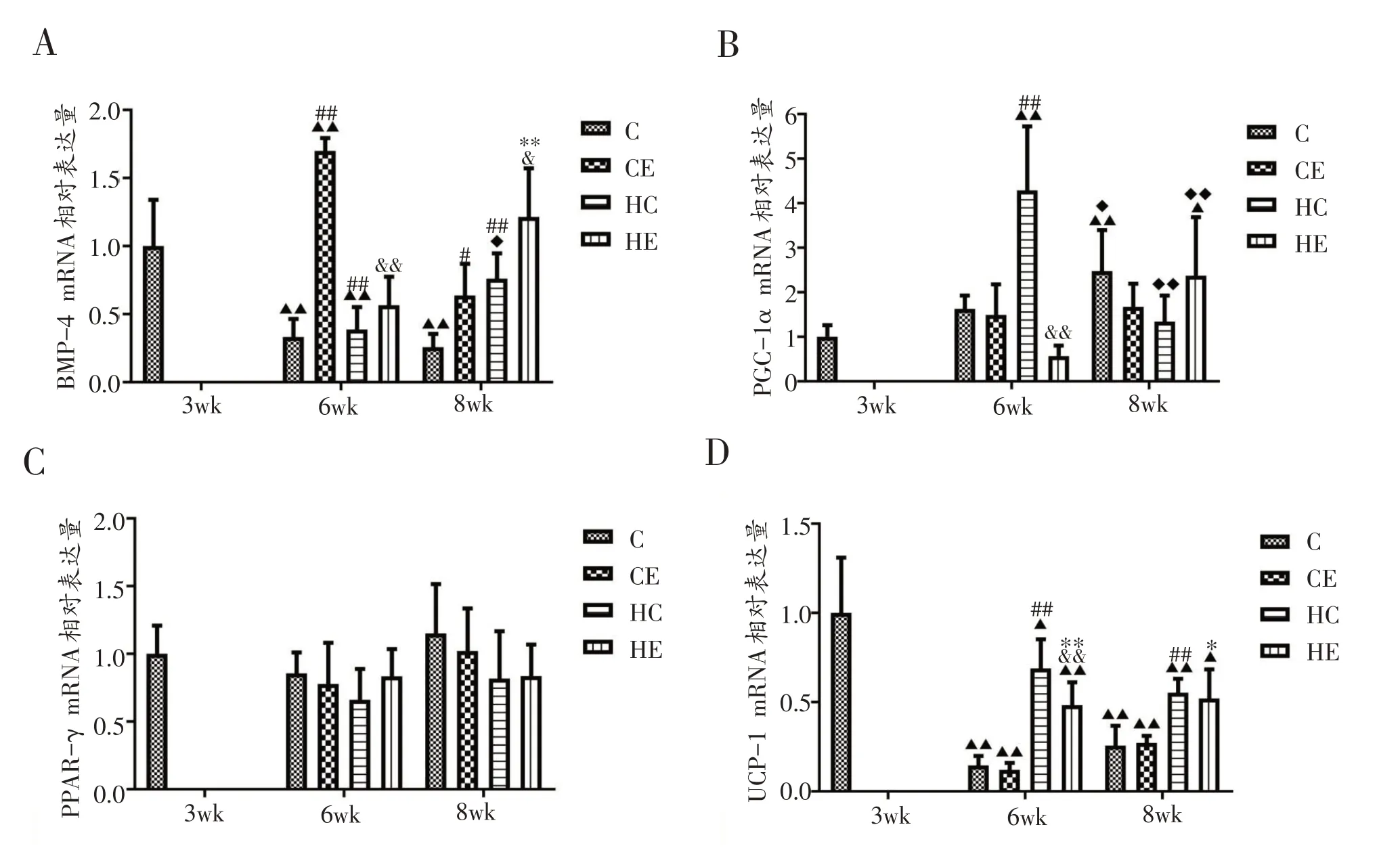
图5 各组大鼠棕色脂肪组织中各基因的相对表达量的变化
3 讨论
3.1 运动对生长发育期高脂饲养大鼠体重、Lee’s 指数、摄食能量的影响
肥胖的发生是由于能量摄入与消耗不均造成的。本研究结果显示,自由饮食状态下,高脂饮食容易摄入更高的热量,从而造成体重的显著增加。此外,即使同时进行运动干预,也比普通饮食更易增重。但运动有助于抑制机体能量的摄入,尤其在高脂状态下,大鼠食欲明显下降,因此高脂运动组Lee’s指数的下降可能与运动和食欲被控制有关,该结果与范锦勤等[17]的研究相似,且该现象在青春期前期效果最明显。
3.2 运动对生长发育期高脂饲养大鼠棕色脂肪组织功能调控相关基因表达的影响
mRNA 的表达对生命体功能的预测有重要作用,在机体稳定状态下,蛋白质表达差异直接取决于其mRNA表达水平,除了转录翻译的延迟外,蛋白质丰度变化中近80%的差异是由mRNA 的增加所引起的[18],因此,mRNA 的表达对功能表达有着重要意义。本研究从mRNA表达层面对运动和高脂饲养的生长发育期大鼠棕色脂肪组织进行相关功能调控的探究,后续将跟进mRNA与蛋白质的共同功能研究。
3.2.1 生长发育对大鼠棕色脂肪组织功能调控相关基因表达的影响
棕色脂肪组织是富含毛细血管和线粒体的脂肪组织,因其具有的产热作用、内分泌功能而有助于体内多余能量的消耗,已成为肥胖治疗的新靶点。有研究发现不同发育阶段儿童棕色脂肪组织的含量及活跃程度均与年龄和性成熟水平高度相关,且在青春后期发育阶段更为明显。但其机制尚不明确[19]。本研究观察到生长发育是影响棕色脂肪组织功能调控相关基因表达的一个重要因素。生长发育期的大鼠棕色脂肪组织功能调控相关基因BMP4、UCP-1mRNA 表达量降低,而PGC-1αmRNA表达量呈增加的趋势。
研究证实,棕色脂肪组织活性在胎儿和婴儿期最强,此时机体主要依赖棕色脂肪组织非颤抖性产热维持体温[13,20]。随着年龄的增长,大鼠肩胛上的BAT含量减少[21]。但也有以PET/CT(正电子发射计算机断层显像)检查为主的人体研究发现,婴儿期之后机体仍存在棕色脂肪。Pyrzak等[22]认为,功能性BAT与肌肉体积在儿童和青少年中出现一个交叉相关。Rogers 等[13]观察到青春期棕色脂肪组织含量与肌肉体积平行增长,从而认为棕色脂肪在青春期出现峰值,而在成年期随年龄增长而下降。Gilsanz等认为棕色脂肪组织体积在青春期增加与青春期脂肪组织体积增加、性成熟相关激素分泌增加有关[19]。本研究未检测生长发育期大鼠棕色脂肪组织含量的变化,但观察到随着大鼠体重的显著增加,UCP-1 mRNA 表达在6 周龄(青春前期)出现显著降低,并在青春期保持较低水平。UCP-1 是BAT功能的标志因子,主要存在于BAT的线粒体内膜表面,介导棕色脂肪组织的产热作用[23]。因此,本实验结果提示在青春期大鼠棕色脂肪组织的产热作用可能被抑制,且抑制作用发生在青春前期。
BMP-4属于转化生长因子β(transform growth fac⁃tor β,TGF-β)超家族。前期研究发现BMP-4 对干细胞向白色脂肪细胞系分化同时诱导白色脂肪前体细胞向米色脂肪细胞分化发育具有重要的调控作用[24,25]。但近些年来有研究发现BMP-4 可以促进棕色前脂肪细胞脂质积累过程[26],并诱导多潜能干细胞定向分化为棕色脂肪细胞[27]。本实验观察到BMP-4 mRMA 表达量在大鼠青春期持续降低。提示大鼠棕色脂肪细胞分化可能在生长发育过程中受到抑制。
在新生儿及哺乳动物中,PGC-1α主要在棕色脂肪细胞表达,PGC-1α可以辅助激活PPAR-γ等核受体从而启动UCP-1 的基因转录和转录后加工过程,是诱导棕色脂肪细胞UCP-1高表达的重要激活因子[28]。在寒冷、禁食等条件下,BAT内PGC-1α表达量增加,可提高UCP-1 水平,从而增加机体的产热作用。但生长发育对BAT 中PGC-1α、PPAR-γ调控因子的影响尚未见研究报道。本研究观察到大鼠从幼儿期到青春期的生长过程中,PGC-1α mRNA表达量在8周龄(青春期)有显著增加,而PPAR-γ mRNA表达量无显著变化,即大鼠生长发育过程中棕色脂肪组织产热功能调控因子PGC-1α、PPAR-γ表达量的变化与UCP-1 表达量的变化不同步,提示生长发育期大鼠棕色脂肪组织产热作用未被激活。
综上所述,大鼠生长发育过程(幼儿期到青春期)中的棕色脂肪组织产热作用受抑制可能与棕色脂肪细胞分化被抑制、产热调控信号通路未激活有关,其作用机制有待进一步研究。
3.2.2 高脂饲养对大鼠棕色脂肪组织功能调控相关基因表达的影响
高脂饮食引起的能量过剩可导致白色脂肪大量积累进而导致肥胖。高脂饮食大鼠从幼儿期到青春期期间,UCP-1 mRNA表达量虽高于同龄对照组,但仍呈持续降低的趋势;BMP-4 mRNA 表达量的变化趋势与PGC-1α相反,呈现先降低后升高的趋势。
苗振春等[29]用熟猪油喂养大鼠4周,发现棕色脂肪组织线粒体上解偶联蛋白(UCP)与鸟嘌呤核苷三磷酸(guanosine triphosphate,GTP)结合的解离常数(Kd)及最大结合容量(Bmax)均无明显影响,因此认为高脂饮食不影响大鼠棕色脂肪组织UCP-1的表达。但也有研究认为,高脂饮食可诱导棕色脂肪白色化,使得白色脂肪增多,棕色脂肪组织活性降低[30]。Cao 等[31]对高脂饮食诱导的肥胖小鼠棕色脂肪组织进行整体转录组分析发现,高脂饮食对棕色脂肪组织的影响在肌肉发育、离子转运和神经递质等基因有抑制作用,而对产热基因无明显影响。另一些研究则发现高脂饮食可增加啮齿类动物的BAT 产热能力,进而维持体重。Xu 等[32]的研究显示高脂饮食促进小鼠棕色脂肪组织中UCP-1 和PGC-1α mRNA 的表达,而抑制白色脂肪组织中这两种基因的表达。本课题组前期研究结果也显示高脂饮食诱导的肥胖大鼠棕色脂肪组织UCP-1蛋白含量显著增加[33]。由此可见,高脂饮食对棕色脂肪组织产热能力的影响尚无定论。本研究观察到,从幼儿期到青春期期间,高脂饲养大鼠的UCP-1 mRNA表达量显著高于同龄对照组,提示高脂饲养可在一定程度上激活棕色脂肪组织的产热作用,使线粒体的氧化呼吸链解偶联,导致能量以热能的形式耗散,促进大鼠棕色脂肪组织动员产热过程,从而抵抗因高脂膳食诱导的肥胖发生[34]。高脂饮食引起的UCP-1 mRNA表达的增高可能是机体的一种保护机制。但从幼儿期到青春期期间持续高脂饲养大鼠的UCP-1 mRNA 表达量仍呈持续降低的趋势,说明生长发育仍然是影响棕色脂肪组织产热的主效应作用因素。
有研究发现,肥胖大鼠的棕色脂肪细胞的PGC-1α及UCP-1 mRNA 含量明显减少,脂肪酸β氧化的酶活性降低,能量代谢率下降。由此提出,棕色脂肪细胞PGC-1α及UCP-1 mRNA 表达异常参与了肥胖症的产生[35]。本研究虽观察到高脂饲养大鼠体重出现显著增加,但Lee’s 指数未出现显著变化,提示高脂饮食未诱发大鼠的肥胖。而BMP-4、PGC-1α mRNA 表达量的变化受生长发育及高脂饮食的共同影响,其中BMP-4 mRNA 表达量出现先降低后升高的趋势,而PGC-1α mRNA 表达量出现先升高后降低的变化趋势,提示青春前期是高脂饮食影响棕色脂肪组织功能调控相关基因表达量的关键时间点。在青春前期及青春期,高脂饮食激活棕色脂肪产热作用的机制可能存在差异,即棕色脂肪细胞分化机制及产热作用调控机制在发挥调控高脂饮食大鼠棕色脂肪组织产热作用时具有一定的时相性,其原因有待于进一步探究。
3.2.3 运动对大鼠棕色脂肪组织功能调控相关基因表达的影响
本研究观察到运动和生长发育均可以使棕色脂肪组织UCP-1 mRNA 表达量降低,尤其在青春期前期,运动可以使棕色脂肪组织UCP-1 mRNA 表达量降低。已有研究证实,运动可以影响棕色脂肪组织的产热作用,但结论并不一致。有学者发现中等强度跑台或游泳运动可以增加标准鼠和肥胖鼠BAT中UCP-1的蛋白表达量[31,36,37]。Lehnig 等[38]发现运动可以增加UCP-1 mRNA的表达,但对UCP-1蛋白的表达无明显影响,且运动会降低棕色脂肪组织葡萄糖代谢相关基因的表达,而增加脂肪酸代谢相关基因表达。Xu 等[32]发现,运动训练可以促进标准小鼠棕色脂肪组织UCP-1 mRNA的表达,但是对于高脂小鼠呈现抑制趋势,却可以改善高脂小鼠代谢能力,增加其棕色脂肪组织中脂肪祖细胞的数量。但也有研究指出,中等强度运动仅可以使棕色脂肪组织产热功能轻微增强,表现为交感神经活动增强,儿茶酚胺合成酶显著升高,但未影响UCP-1 mRNA 的表达[39];运动对BAT 中UCP-1 的影响不显著[40],甚至会抑制经典棕色脂肪组织的非颤抖性产热作用。其原因可能是运动产热使得棕色脂肪组织产热作用代偿性下调[41,42]。另有一些啮齿动物及人体实验研究结果显示,运动会减弱机体棕色脂肪组织活性,或者对棕色脂肪组织的代谢影响不大[41,43]。本课题组前期研究也发现运动可抑制肥胖大鼠棕色脂肪组织的UCP-1蛋白表达量[44]。本研究结果进一步证实中等强度运动可抑制棕色脂肪组织的产热作用,并且可以与生长发育协同作用。
本研究观察到运动组大鼠在生长发育期BMP-4、PGC-1α mRNA 表达量的变化与饲养方式有关,其中标准饲养大鼠BMP-4 mRNA 表达量出现先升高后降低的变化趋势,PGC-1α mRNA表达量变化不明显;高脂饲养大鼠BMP-4、PGC-1α mRNA 表达量均出现先降低后升高的趋势。与同龄大鼠相比,运动可使标准及高脂饲养大鼠棕色脂肪组织中BMP-4 mRNA 的表达量增加;而使6周龄高脂饲养大鼠PGC-1α mRNA表达量显著降低。该结果提示,运动协同生长发育抑制棕色脂肪组织产热作用的作用机制可能与机体的能量状态有关,其中PGC-1α参与的棕色脂肪组织产热调控机制可能在青春前期发挥一定的作用。
4 结论
青春期前的高脂饮食可上调大鼠棕色脂肪组织的功能调控相关基因的表达。青春期是运动调控棕色脂肪组织功能的关键时期。中等强度有氧运动对生长发育期大鼠棕色脂肪组织功能调控相关基因的调节受机体能量状态的影响。
