HCY、MMA及MCV对脊髓亚急性联合变性的早期诊断价值
2021-03-18莫金凤吴祥雄胡攀勇刘开祥
莫金凤,吴祥雄,胡攀勇,刘开祥
(桂林医学院附属医院 神经内科,广西壮族自治区 桂林 541000)
0 引言
脊髓亚急性联合变性是由于VB12的摄入、吸收、结合、转运或代谢障碍,导致体内含量不足而引起的中枢、周围神经系统变性疾病,病变主要累及颈胸髓的后索、侧索及周围神经,临床表现主要为双下肢深感觉异常、共济运动失调、痉挛性瘫痪等,严重者大脑白质及视神经也可受累[1]。SCD起病隐匿,早期可无症状或缺乏特异性,容易漏诊甚至误诊,如不能及时诊治时,将导致神经不可逆损伤,因此早期诊断和治疗对SCD患者神经功能恢复具有重要意义。血清VB12水平降低是诊断SCD的有力依据,但临床上有不少诊断为SCD的患者血清VB12水平并不低,血清同型半胱氨酸(Homocysteune,HCY)、甲基丙二酸( Methylmalonic acid,MMA)、平均红细胞体积(Mean corpuscular volume,MCV)增加是VB12缺乏的早期标志,因此我们推测血清HCY、MMA、MCV可作为诊断SCD更敏感的实验室指标,对SCD早期诊断具有重要价值。
1 VB12在SCD的诊断价值
VB12是正常血细胞生成、核酸及核蛋白合成与髓鞘形成等生化代谢中必需的辅酶。VB12是催化体内的同型半胱氨酸甲基化生成蛋氨酸这一反应的蛋氨酸合成酶(又称甲基转移酶)的辅基,参与甲基的转移。血清VB12水平是诊断SCD的重要生物标记,目前导致SCD的具体机制尚未明确,总结可能的机制如下:(1)5,脱氧腺苷钴胺素是L-甲基丙二酰-CoA变位酶的辅酶,催化琥珀酰CoA的生成。VB12缺乏时, L-甲基丙二酰-CoA大量堆积,抑制了甲基丙二酰-CoA变位酶,使L-甲基丙二酰-CoA转化发生障碍,因L-甲基丙二酰-CoA的结构与脂肪酸合成的中间产物丙二酰-CoA相似,所以影响脂肪酸的正常合成,故VB12缺乏造成脂肪酸的合成异常而影响髓鞘的转换,导致髓鞘变性退化,造成进行性脱髓鞘(见图1)。(2)甲基转移途径的机能障碍同时导致髓鞘形成障碍和髓鞘脱失。N5-甲基四氢叶酸(N5-CH3FH4)上的甲基不能转移,导致核糖核酸合成及鞘磷酯碱性蛋白形成髓鞘障碍,因脱氧核糖核酸(DNA)是神经胞浆中重要核蛋白,不断供应轴突,DNA不足可导致轴突变性,尤其易累及脊髓后索及侧索轴突,神经轴突代谢障碍可导致神经变性,产生的中间代谢产物毒性作用也可造成神经纤维脱髓鞘[2]。(3)影响四氢叶酸的再生,使组织中游离的四氢叶酸含量减少,不能重新利用它来转运其他的一碳单位,影响嘌呤、嘧啶的合成,最终核糖核酸合成障碍,影响造血功能(见图2)。
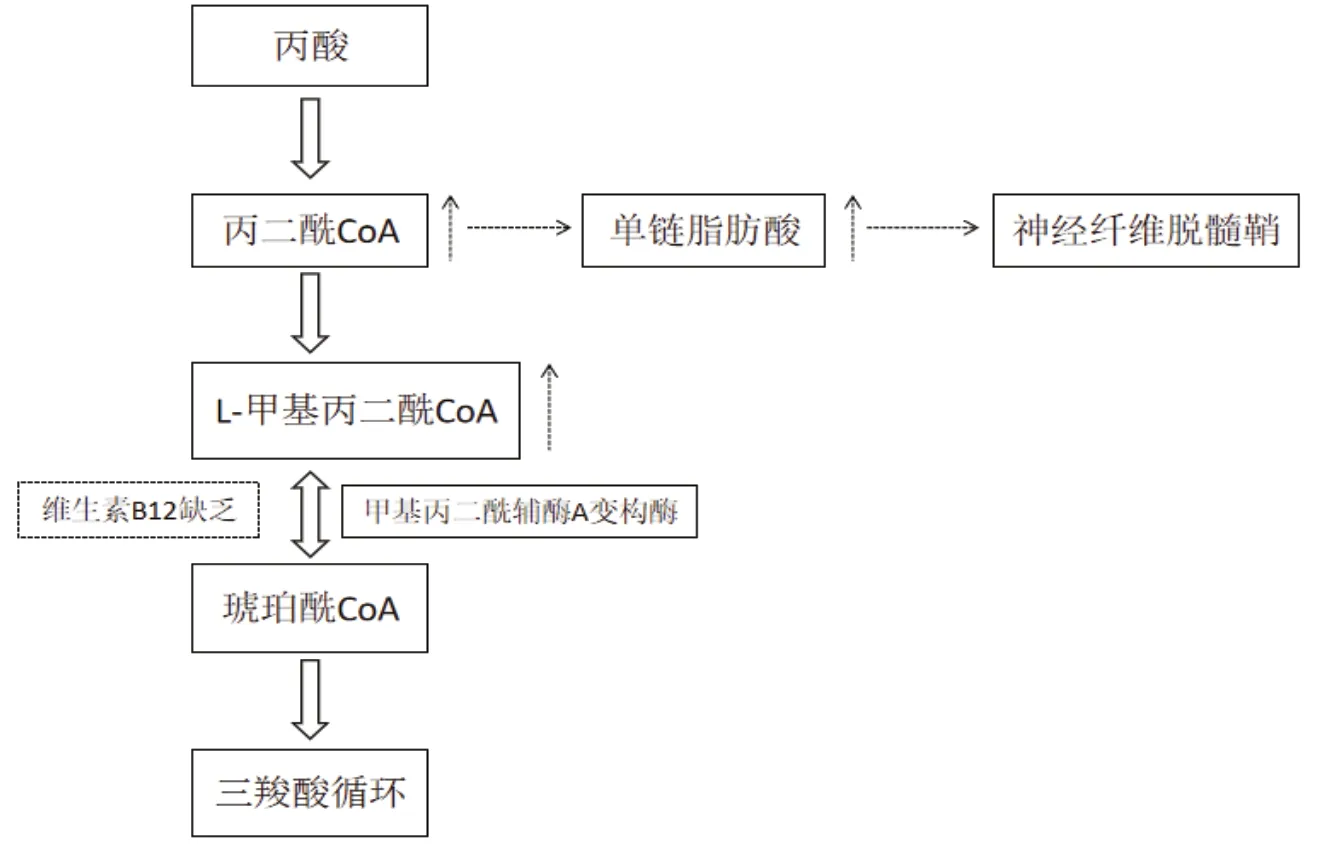
图1 VB12缺乏引起脱髓鞘机制
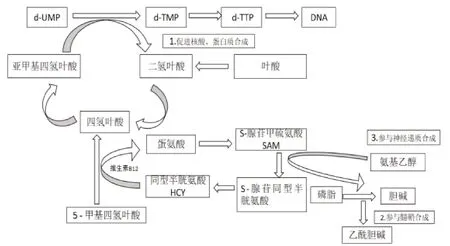
图2 VB12代谢
VB12缺乏发生时,总血清VB12水平仍可在正常范围内[3]。Reynolds等[4]描述一男性SCD患者,其血清VB12含量明显增高,红细胞VB12含量降低,并发现其血中有一种异常的VB12结合蛋白,在试管内能抑制自身白细胞对钴胺素的提取。毕鸿雁等[5]报道,24例SCD患者,仅8例VB12水平降低,李楠等[6]报道了11例VB12水平正常的SCD。目前我国还不能常规检测细胞内VB12水平,因此不能确定血清VB12水平升高或正常者是否存在细胞内VB12缺乏。
此外,血清VB12水平还可能因一些疾病( 如急慢性肝病、各种肿瘤、恶性血液病和肾功能衰竭等)及其他因素影响,仅表现为功能性VB12缺乏[7],分析SCD患者血清VB12正常或升高原因可能如下:(1)患者在检查前使用过VB12;(2)当存在VB12转运和代谢障碍时,血清VB12可以正常,而细胞内VB12降低;(3)部分SCD患者可能存在异常的VB12结合蛋白。所以,仅依据血清VB12含量测定来判定VB12是否缺乏进而作出SCD的诊断并不可靠。因此,不能单独检测血清VB12水平这一指标而诊断SCD。
2 血清HCY在SCD中的早期诊断意义
Huemer等[8]在关于钴胺素相关的再甲基化障碍疾病研究中提出,任何呈现神经、视觉、血液学异常症状等组合的拟诊SCD患者,建议测量血浆总HCY浓度。HCY是一种含硫氨基酸,为蛋氨酸和半胱氨酸代谢过程中产生的重要中间产物,然后通过再甲基化及转硫途径代谢,需要蛋氨酸合成酶、胱硫醚β合成酶以及VB12、叶酸、VB6的共同参与。正常情况下,血清HCY在体内被分解代谢,维持在较低水平浓度,当VB12缺乏及功能障碍时,血清HCY代谢障碍,导致其在体内蓄积,浓度增高,近年来许多研究者认为血清HCY水平增加是VB12缺乏的早期标志物,甚至在血液学征象出现前即有变化,杨芬等[9]报道,8例SCD患者中5例进行HCY检测,均存在HCY升高。余银等[10]发现VB12和血清HCY单独检测SCD的灵敏度分别为68.6%,72.4%,血清HCY的灵敏度高于血清VB12,提示血HCY检测在SCD的诊断中较VB12更为敏感。张艳旗等[11]报道2例SCD患者血清HCY明显升高,并与VB12治疗后临床症状的改善呈一致性动态变化,提示血清HCY改变与患者临床病情变化有一致性动态联系,且不随VB12的临床用药而迅速发生即时变化。
因此,早期SCD患者,尽管血清中VB12处于正常水平,但细胞内VB12已经开始缺乏,从而引起血清HCY代谢障碍,使其在体内蓄积,导致血清HCY浓度增高,故推测HCY在SCD的早期诊断中具有重要价值。
3 MMA在SCD中的早期诊断意义
VB12以辅酶的形式参与半胱氨酸转化为蛋氨酸、甲基丙二酰CoA转化为琥珀酰CoA的反应,当VB12缺乏,代谢底物甲基丙二酸( MMA)在身体组织内堆积释放入血液,从而引起血清MMA浓度增高。MMA作为辅助诊断VB12缺乏的最常用的代谢物之一,早期血清中MMA水平的测定可间接反映血清中VB12含量,对VB12缺乏症的早期诊断具有一定的参考意义[12,13]。Aparicio-Ugarriza等[14]回顾了一般人群中诊断VB12缺乏的临界值,发现MMA作为评估VB12缺乏的生物标志物使用的截止值为210-470nmol/L。Herrmann和Obeid[15]报道了一例肾疾病患者在VB12注射后,MMA降低200 nmol/L,证实了VB12缺乏的诊断。Hara D[16]等报道了一例患者,通过服用VB12后,神经精神症状明显改善,血清MMA降至240 nmol/L,使该患者由于VB12缺乏而导致SCD的诊断得到证实。钱宁等[17]发现,在VB12缺乏的早期,尿中MMA浓度明显升高,尿中MMA的测定可使VB12缺乏诊断率达到99.8%。孙爱丽等[18]发现,尿MMA对VB12早期缺乏的诊断价值较高,其敏感性为81.25%,特异性为83.75%。刘炜等[19]研究发现,早期VB12缺乏的患者中,尿MMA水平较正常水平明显升高,这和目前国外最新研究MMA是反映细胞内VB12缺乏最敏感的指标相一致,提示测定MMA水平对早期诊断VB12缺乏症有重要意义。
因此,在SCD患者中,测定尿和血清中MMA的水平,可以作为早期反应血清VB12缺乏的直接和敏感的指标之一,可判断体内VB12水平,从而间接辅助SCD的早期临床诊断。
4 MCV在SCD中的早期诊断意义
VB12作为早期红细胞核分裂的一种必须元素,当VB12缺乏时,DNA合成发生障碍,造成胞质比胞核发育成熟(核质发育不平衡),细胞体积增大。Kapadia[20]研究表明MCV升高可作为VB12缺乏的诊断标准之一,当VB12水平正常,而 MCV≥130 fl,可判断有VB12或叶酸缺乏。王丽娟等[21]研究发现,103例SCD患者中,MCV升高患者所占比例高于HGB降低患者,其可能机制为:VB12缺乏时,DNA合成发生障碍,造成胞质比胞核发育成熟(核质发育不平衡),核染色质呈分散的颗粒状浓缩,红系各阶段细胞均较正常大,从而导致MCV升高比HGB降低的阳性率更高。近年来越多越多MCV水平升高而血清VB12水平正常的报道[22-24],李楠等[6]报道了11例均有明显的神经系统表现的SCD患者,血清VB12水平均正常,其中8例合并MCV升高。李莉等[25]研究发现,50例SCD患者中,血清VB12水平正常或升高的患者39例(78%),其中20例(40%) MCV升高。郭晓玲等[26]研究结果显示MCV与神经功能障碍的严重程度及病程关系密切,病程越长时神经受损越重,外周血MCV越高时相应的神经病变越严重。
因此,MCV升高可作为VB12缺乏的诊断标准之一,MCV水平升高比VB12水平降低能更好反映体内功能VB12缺乏及神经病变损害严重程度,在SCD的早期诊断中具有重要意义。
5 小结
综上所述,脊髓亚急性联合变性临床表现复杂,缺乏特征性症状和体征,容易误诊或漏诊,尤其是对于那些曾经应用过VB12和血清VB12水平正常患者,通过检测同型半胱氨酸、甲基丙二酸及平均红细胞体积可更好地反映血中VB12的真实水平,可能是脊髓亚急性联合变性的早期诊断指标,但脊髓亚急性联合变性的确诊,仍应综合分析患者的症状体征、实验室指标、神经电生理及脊髓MRI检查,早期诊断及治疗对患者神经功能恢复具有重要意义。
