电解水替代强碱提取大豆渣可溶性 多糖工艺优化研究
2021-03-18杜明星李博生
袁 森,杜明星,李博生
(北京林业大学 生物科学与技术学院,北京 100083)
我国是大豆种植和加工的主要国家之一,近年来,我国自产和进口大豆总量约为9 000 余万t,在大豆工业生产过程中会产生30%左右的豆渣,因此,豆渣的综合利用显得尤为重要[1-3]。当今豆渣的蛋白利用较多,但是多糖利用并不多见,在豆渣中约含有30% 水溶性大豆多糖(Soluble Soybean Polysaccharides, SSPS)[4]。水溶性大豆多糖具有很多种生物活性,如抗氧化、抗菌等功效,水溶性大豆多糖还具有乳化性、稳定性和分散性等性质,也是1 种良好的食品添加剂,不仅可以作为食品中的乳化成分,还可以抑制脂类氧化,水溶性大豆多糖在食品行业中的应用也在日益增加[5]。大豆可溶性多糖的提取方法较多[6-8],最传统的提取方法是热水浸提法,具有操作简便,成本低的优点,但也存在得率低、能耗大、费时长等不足[9-14];生物酶法提取大豆可溶性多糖是1 种高效绿色的提取方法,具有快速、高效、反应温和、专一性强等诸多优点[15-16],但也有容易受酶的活力、pH 值及其来源等因素的影响[18],因此,生物酶法在实际应用中所占比例并不大。化学试剂提取法主要是酸法和碱法,与热水浸提法相比有着更好的提取率,但是在生产过程中会产生大量的废水对环境造成污染,不符合环境友好型产业要求,而处理废水的费用也相当昂贵[17];施翠娥、刘益东、陈红等分别用热水浸提法、碱法和酶法对大豆可溶性多糖进行了提取实验,并得到了最优的提取工艺,其提取率对比可得:碱法>酶法>热水浸提法[19-21]。碱法虽有较高的提取率,但会产生大量污水造成污染,如果有办法在保持提取率的基础上将强碱完全代替或者部分代替,从而使强碱使用量降低,减少废液处理成本,并减少环境压力,不失为1 种更好的提取方法。
电解水分为酸性电解水和碱性电解水2 种,作为1 种溶剂比强酸强碱有更好的穿透能力,且由于其化学性质的缓和性,与具有腐蚀性的强酸强碱溶剂相比,电解水酸碱温和,对人体也无毒害,且具有制备工艺简单、成本低、无污染等优点。电解水近年来逐渐被运用于天然活性成分的提取,黄永红等[22]利用电解水提取冷榨文冠果饼中的残油,确定了电解水最佳提油方法,即电解水辅助超声波法;韩晓梅等[23]利用电解水提取虾壳中的甲壳素,与传统提取方法得到的甲壳素理化性质基本一致;李楚楚等[24]探究了酸性电解水对柿子渣果胶的提取,得到了电解水提取柿子渣果胶的最佳工艺条件。为了实现研究目标,此项研究使用电解水(EW)替代强碱作为溶剂对大豆渣可溶性多糖提取进行工艺优化。以豆渣为原料,用电解水不同程度替代强碱提取大豆可溶性多糖,在单因素的基础上设计正交实验、优化实验来确定最佳提取工艺,旨在解决产业化生产中传统提取方法面临的瓶颈问题,探索一条经济、绿色,环保的大豆可溶性多糖提取工艺,从而推动豆渣综合利用的向前发展[25-26]。
1 材料与方法
1.1 原料及主要仪器
新鲜豆渣,购于北京林业大学北路农贸市场,新鲜无霉变;浓硫酸、葡萄糖、无水乙醇、苯酚均为分析纯,北京化工厂。
高速万能粉碎机,中国天津市泰斯特仪器有限公司;CE-7001 型携带式电解水生成器,中国广州赛爱环境保护技术开发有限公司;离心机,中国江苏省金坛市荣华仪器制造有限公司;恒温水浴锅,中国上海亚荣生化仪器厂;752 型紫外分光光度计,中国上海梅普达仪器有限公司。
1.2 方法
1.2.1 豆渣预处理 先将烘箱预热,待称量瓶恒重,准确称豆渣样品和称量瓶重,在105 ℃条件下干燥2 ~4 h,然后冷却30 min,称量,干燥1 h,冷却30 min,再称量,反复至恒重。
1.2.2 电解水制备 电解水的制备在1 个小的电解池里,这个电解槽分阴阳两极,中间由阳离子交换膜隔开,电解氯化钠溶液,在阴极收集到的是碱性电解水,在阳极收集到的是酸性电解水[27]。
1.2.3 大豆渣多糖提取工艺 准确称取新鲜干豆渣20 g,将豆渣磨细,以一定料液比放入固定pH 碱性电解水中处理,在恒温水浴锅中加热,保持恒温进行浸提,对提取液进行抽滤,去除滤渣,用活性炭进行脱色,再进行离心,得上清液即为多糖提取液,定容备用。1.2.4 多糖提取率的测定
(1)标准曲线的绘制。大豆渣可溶性多糖的定量检测方法采用苯酚-硫酸法[28],将标品葡萄糖干燥至恒重,准确称量25 mg 标品,用蒸馏水溶解,然后定容为浓度为0.1 mg/mL 的标准葡萄糖溶液。用移液枪吸取0、0.1、0.2、0.3、0.4、0.6、0.8、0.9 mL标品葡萄糖溶液,用蒸馏水补至1.0 mL。再分别加入0.5 mL 5%的苯酚溶液,再加入2.5 mL 浓硫酸,摇匀后静置0.5 h。以一号试管(标品葡萄糖浓度为零)做空白对照,在490 nm 处测定OD 值,绘制标准曲线,如图1,得线性回归方程为:
A=15.949C-0.015 6 (R2=0.998 2)
式中:A 为吸光度;C 为测定液质量浓度(mg/mL)。
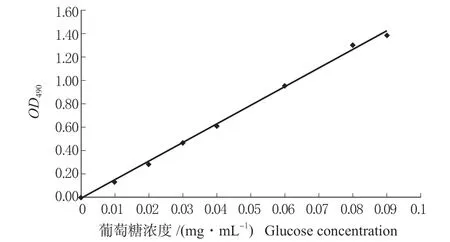
图1 葡萄糖标准曲线Fig.1 Standard curve of glucose standard solution
(2)提取率的计算。吸取多糖提取液1.0 mL按标准曲线测定步骤操作,在波长490 nm 处测定大豆渣多糖A 值,根据葡萄糖标准曲线方程计算出大豆渣多糖含量,根据下式计算大豆渣多糖提取率:
式中:C 为大豆渣多糖含量(mg/mL)。
V 为大豆渣多糖提取液定容体积(mL)。
M 为豆渣样品质量(g)。
1.3 试验设计
1.3.1 单因素试验 本试验分别探究了提取温度(50、55、60、65、70℃)、提取时间(40、50、60、70、80 min)、 提 取 液pH 值(8、9、10、11、12)、料液比(g∶mL=1∶6、1∶8、1∶10、1∶12、1∶14)4 个变量对大豆渣可溶性多糖提取率的影响,进行单因素试验,每组试验设置3 个平行。
1.3.2 正交试验 在单因素试验的基础上,选择提取温度、提取时间、电解水pH、料液比4 个因素,进行L9(34)正交试验设计。按照正交表中的各个因素组合,进行大豆渣可溶性多糖的提取试验。正交试验设计表如表1。
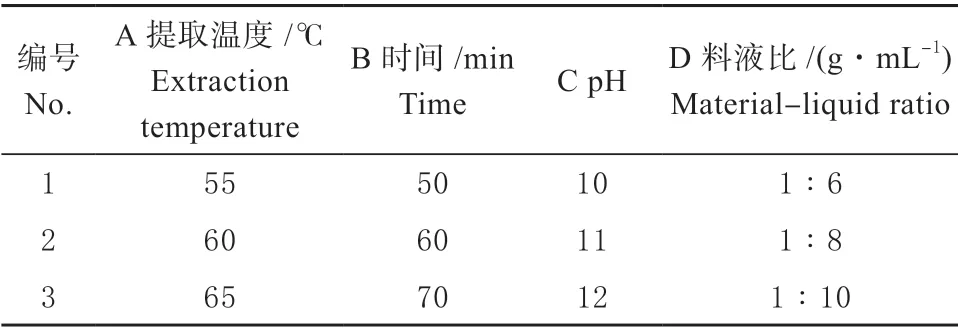
表1 试验因素水平表L9(34)Table 1 Orthogonal experimental factors and levels L9(34)
1.3.3 电解水替代强碱优化试验 在电解水全部替代强碱对大豆渣多糖提取的单因素和正交试验基础上,探究电解水不同程度替代强碱对大豆渣多糖提取率的影响。称取20 g 干豆渣6 份,分别加入总体积为200 mL 的电解水与NaOH 溶液混合液,二者体积比分别设为 EW∶NaOH =2∶8、3∶7、4∶6、5∶5、0∶10、10∶0,对大豆渣多糖进行提取试验。
2 结果与分析
2.1 单因素实验结果与分析
2.1.1 提取温度对大豆渣多糖得率的影响 如图2所示,随着提取温度的不断升高,大豆渣多糖得率先逐渐上升后慢慢下降,在提取温度为60 ℃时达到峰值为8.35%,随后趋于平稳,此时大豆多糖的提取率比55 ℃时高13.3%,比65 ℃时高6.1%。因为温度的升高,会使溶剂分子和多糖分子的动能增加,扩散作用增强,多糖分子和碱性电解水的接触面积增大,多糖的提取率增加,当温度过高时,由于电解水自身化学性质的不稳定性,使得提取溶剂pH下降过快导致多糖提取率降低。
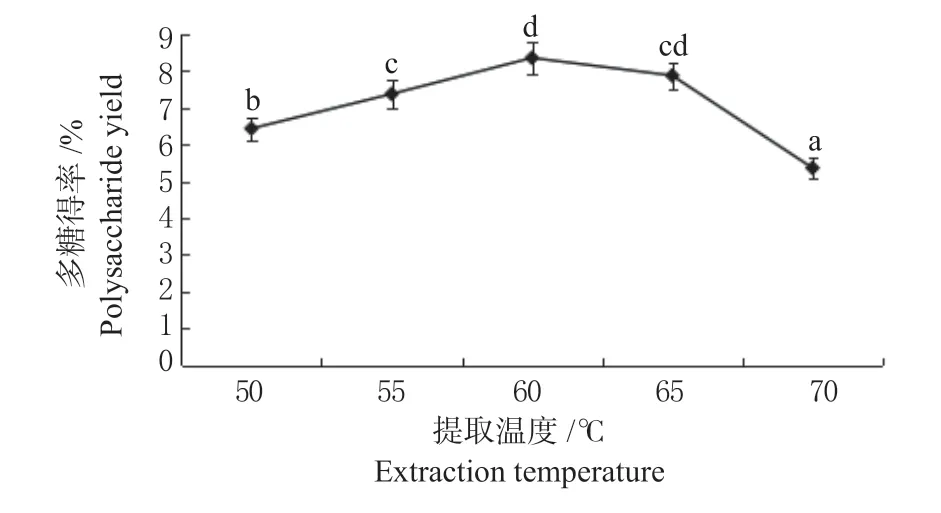
图2 不同提取温度对大豆渣多糖得率的影响Fig.2 Effect of temperature on the extraction rate of SSPS
2.1.2 提取时间对大豆渣多糖得率的影响 如图3所示,以碱性EW 为提取液,随着提取时间的增长,大豆渣多糖得率先逐渐上升,在提取时间为60 min时达到峰值为8.28%,随后逐渐下降,此时提取率比50 min 时高14.05%,比70 min 时高11.44%。这是因为提取时间增加,碱性电解水和多糖分子的接触时间增加,多糖的提取率增加,但当提取时间过长时,由于电解水自身化学性质的不稳定性以及过长时间加热导致多糖发生部分水解,使得多糖提取率降低。

图3 不同提取时间对大豆渣多糖得率的影响Fig.3 Effect of time on the extraction rate of SSPS
2.1.3 提取液pH 对大豆渣多糖得率的影响 如图4 所示,以碱性电解水为提取液,随着碱性电解水pH 的不断升高,多糖得率逐渐上升,在提取液pH 为12 时达到最大值为8.56%,比pH 为11 时高15.83%。这是因为碱性电解水在高pH 条件下,其溶解性,渗透性尤其是其穿透力也会显著提升,碱性提取剂穿透大豆细胞壁,加速了可溶性多糖的溶出。但提取率也因为实验室能制取的电解水最大pH值为12 受到限制。

图4 不同提取pH 对大豆渣多糖得率的影响Fig.4 Effect of pH of EW on the extraction rate of SSPS
2.1.4 料液比对大豆渣多糖得率的影响 如图5 所示。以碱性EW 为提取液,随着碱性电解水量的增加,多糖得率显著增加,在料液比1∶8 时达到最大提取率为8.25%,比1∶6 时多糖提取率增加28.3%,比1∶10 时多糖提取率高11.79%。这是由于料液比增加,溶剂增多,接触面增大,更有利于多糖分子的溶出,因此提取率增加;但是当料液比超过1∶8 时,提取率有所降低,说明料液比过大反而不利于多糖的溶出,导致提取率下降;同时过高的料液比,不但增加了后处理的工作,也产生了大量溶剂的浪费。

图5 不同料液比对大豆渣可溶性多糖提取率的影响Fig.5 Effect of material-to-solvent ratio on the extraction rate of SSPS
2.2 正交实验实验结果与分析
在上述单因素试验的基础上确定浸提温度、提取时间、pH 以及料液比为影响因素,选用L9(34)正交设计,每组以20 g 干豆渣作为原料,按照正交表2 中的各个因素组合,进行了提取率正交优化试验,结果如表2 所示。
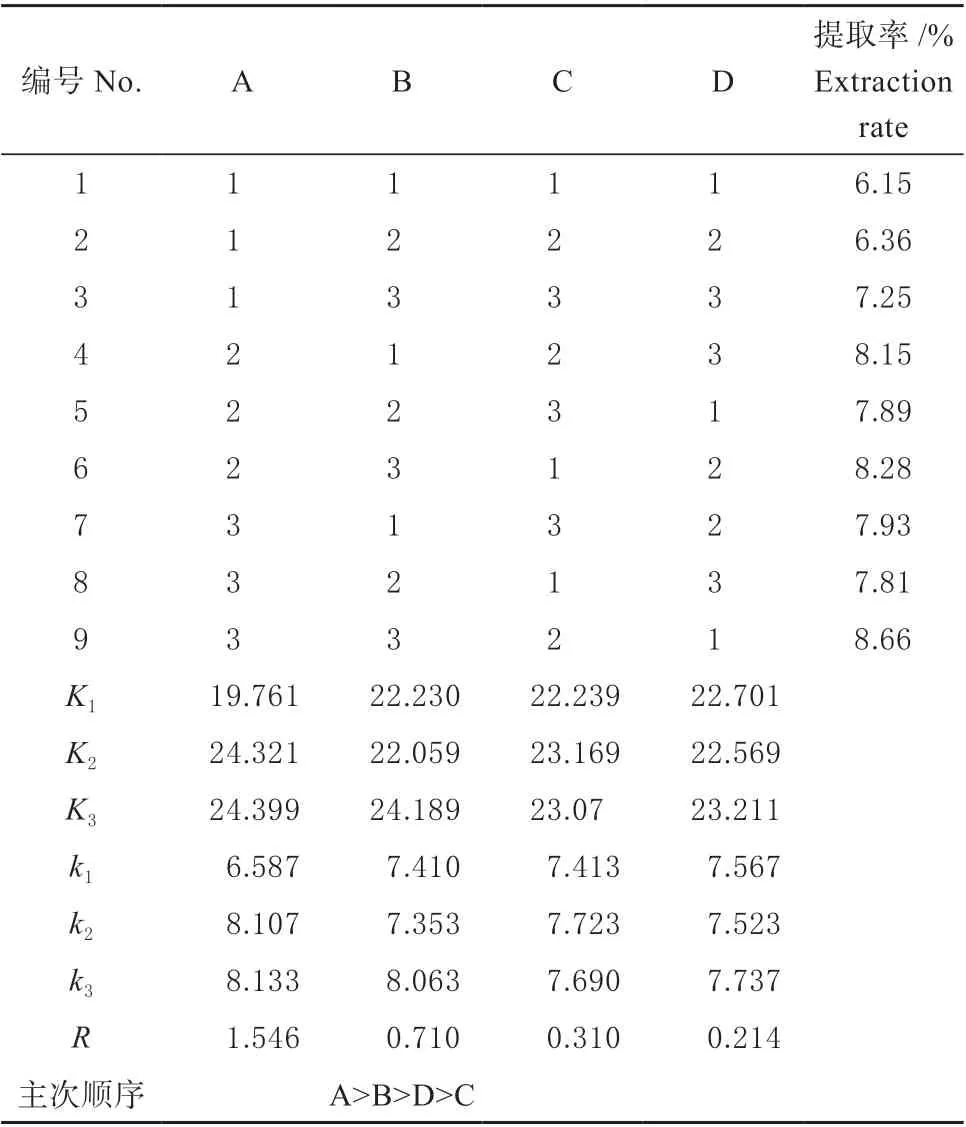
表2 正交实验结果与极差分析Table 2 Results of orthogonal experiments
由表2 得各因素产生的影响作用主次顺序是:A >B>D>C。根据极差分析结果可知,各影响因素的最优水平分别为A3、B3、C2、D3,因此本试验的最优水平组合为 A3B3C2D3,即提取温度65 ℃、提取时间70 min、电解水pH 11、料液比1∶10。因为该组合不在正交表内,需进行验证实验,按照该组合进行3 次重复实验,大豆可溶性多糖提取率分别为8.69%、8.71%、8.73%,平均值为8.71%,高于表中所有组合的提取率。
2.3 电解水替代强碱优化试验结果与分析
由图6 得电解水部分替代强碱溶液时的大豆渣多糖提取率均高于电解水全部替代强碱时,这说明电解水部分替代强碱有着更好的提取效果。电解水与NaOH 溶液体积比为2∶8、3∶7、4∶6、0∶10 时,混合提取液提取大豆渣多糖得率分别为12.12%、12.11%、12.08%、13.64%。体积比4:6 时相对于0:10时大豆渣多糖提取率低了1.56%,但是节省了40%的强碱使用量,而且提取结束后废液碱度相对较低,易处理。综合NaOH 成本以及废水处理费用,从工业生产实践来考虑,电解水与NaOH 溶液体积比为4∶6 时大豆渣多糖综合提取效果最优。

图6 不同体积比对大豆渣可溶性多糖提取率的影响Fig.6 Effect of different volume ratios on extraction rate of soluble polysaccharides from soybean residue
3 讨论
本研究以碱性电解水不同程度替代强碱对大豆渣多糖进行提取,以电解水为溶剂对大豆渣多糖的提取还未见报道。通过单因素和正交试验得到电解水全部替代强碱时大豆渣多糖得率最高可达到8.17%, 高于陈姿含[14]微波浸提法、郝继伟[29]超声波辅助法和李庄[30]酸性、碱性提取法中大豆多糖的提取率,与陈红[3]超声波辅助法和钟艳萍[31]酶解法中多糖提取率基本持平,这表明以电解水为溶剂对大豆渣多糖提取是可行的,这也为继续探索电解水替代部分强碱对大豆渣多糖提取的影响奠定了基础。
本研究优化实验得电解水替代40%强碱时大豆渣多糖提取综合效果最好,提取率可达12.08%,略高于田瑞红[5]水酶法中大豆多糖的提取率。电解水替代强碱法弥补了传统水提法的提取率不足,与传统碱提法相比节省了40%强碱,在工业生产中,可以减少废水处理的成本和降低环境压力,同时电解水具有制取方便、成本低廉、使用安全可靠、无残留、对环境友好等优势,更符合我国对产业发展向高质量,绿色转型的要求。
本研究只探究了电解水与强碱不同体积比对大豆渣多糖提取率的影响,若再补充提取温度、时间等条件,所得结果将会更加全面,也为电解水替代强碱法大豆渣多糖提取工业化生产提供更加全面的理论参考。
4 结论
电解水全部替代强碱提取大豆渣多糖的最优工艺条件为:提取温度65 ℃、提取时间70 min、pH=11、料液比1∶10,此条件下大豆渣多糖得率为8.71%;电解水部分替代强碱多糖提取效果比全部替代更好,电解水∶NaOH 溶液体积比为4∶6 时综合效果最优,多糖得率为12.08%,可见,以电解水替代40%强碱是可行的,大豆多糖提取率不会损失太多,却少用了40%的强碱,对于大豆渣多糖提取产业有着重大的意义。
