血站酶免检测实验室质量监控指标分析方法探讨
2021-03-18刁丽波梁艳娇
刁丽波,梁艳娇
(大理白族自治州中心血站,云南大理 671000)
酶免检测是许多采供血机构在血液检测策略中最常选择的血清学检测方法,《血站技术操作规程(2019 版)》〔1〕中明确规定:选择能够反映试验系统变化的参数进行试验系统监控,包括但不限于血清学检测系统初复试反应率及两者的比例(复试有反应性标本数∕初次试验有反应性标本数)。但由于酶联免疫吸附试验(ELISA)的方法学特点,血站血液检测的特殊性,实验室检测能力差异等原因,往往导致检测质量参差不齐。本文拟通过对酶免检测实验室检测数据的分析,探讨通过观察分析质量监控指标,做好过程控制的方法。
1 材料与方法
1.1 标本来源2018 年1 月—2019 年8 月大理白族自治州中心血站无偿献血者标本,献血前征询及体格检查均符合《献血者健康检查要求》。标本于献血时同步留取,其中,酶免检测标本在采集当日经3 000 r∕min 离心10 min,于2~8 ℃保存,1 周内检测完毕。
1.2 检测试剂HBsAg 检测试剂盒(北京万泰生物药业股份有限公司,批号:B20170628、B20170839、B20180102 等8 批次;法 国BIO-RAD 公 司,批号:7A0226、7G0232、7M0239 等6 批次);抗-HCV 检测试剂盒(北京万泰生物药业有限公司,批号:CS20170605、CS20180101、CS20180304 等8 批 次;英科新创(厦门)科技股份有限公司,批号:2017065815、2017105824、2017125829 等9 批次);抗-HIV-Ag∕Ab-1+2 检测试剂盒(北京万泰生物药业股份有限公司,批号:H20170707、H20170910、H20171213 等8 批次;法国BIO-RAD 公司,批 号:7C0393、7H0405、8C0424 等6 批次);抗-TP 检测试剂盒(北京万泰生物药业有限公司,批号:N20170725、N20171033、N20180102 等8 批次;英科新创(厦门)科技股份有限公司,批号:2017067514、2017127523、2017127529等9批次)。
1.3 主要检测设备Hamilton STAR-Let 液体工作站(瑞士HAMILTON 公司);FAME 全自动酶免分析仪(瑞士HAMILTON公司)。
1.4 检测策略及判定规则每份标本均使用2 个不同厂家的ELISA 试剂进行酶免检测,严格按照试剂说明书进行操作并判定结果。2 种试剂检测结果均为有反应性和均为灰区的判为酶免检测不合格;1 种试剂检测结果为有反应性或灰区的,使用该试剂对原血样标本进行双孔复试,结果均为无反应性的判为酶免检测合格,结果任意1孔为反应性或灰区的判为酶免检测不合格。灰区设置:HBsAg为0.6 ≤s∕co<1,抗-HCV、抗-HIV 和 抗-TP 均 为0.8 ≤s∕co<1。
1.5 质量控制使用试剂盒提供的阴阳性对照和康彻斯坦公司的室内质控品进行有效性控制;实验室每年参加国家卫生健康委员会临床检验中心开展的室间质评活动对检测质量进行评价,成绩合格。
2 结果
2.1 酶免检测2018 年1 月— 2019 年8 月共检测54 622 份标本,由反应性数分别计算出试剂1 及试剂2的反应性率。见表1。
2.2 单试剂初次检测反应性标本双孔复试反应性率检测使用χ2检验比较同一项目2 种试剂的复试反应性率,HBsAg 复试反应性率差异有统计学意义(P<0.05),抗-HCV、抗-HIV 和抗-TP 复试反应性率差异均无统计学意义(P>0.05)。见表2。
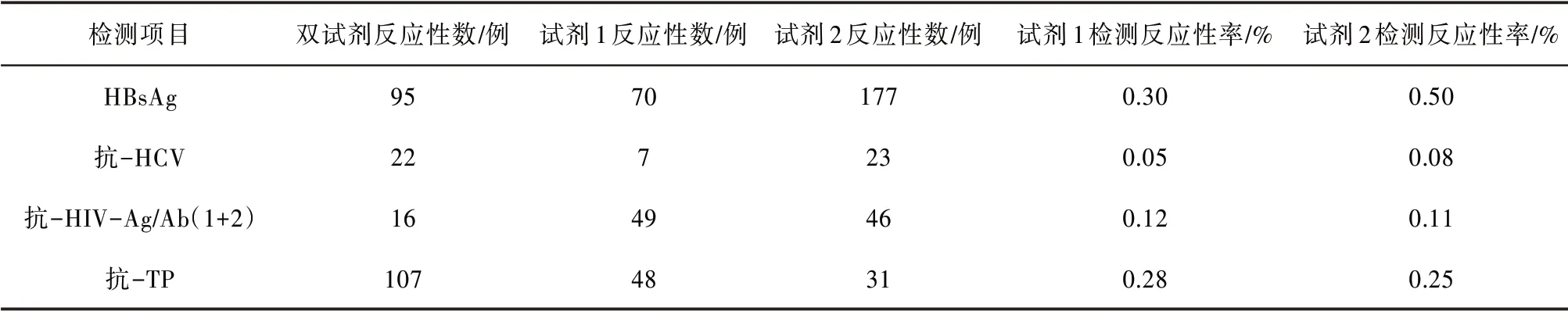
表1 酶免四项检测结果统计(n=54 622)
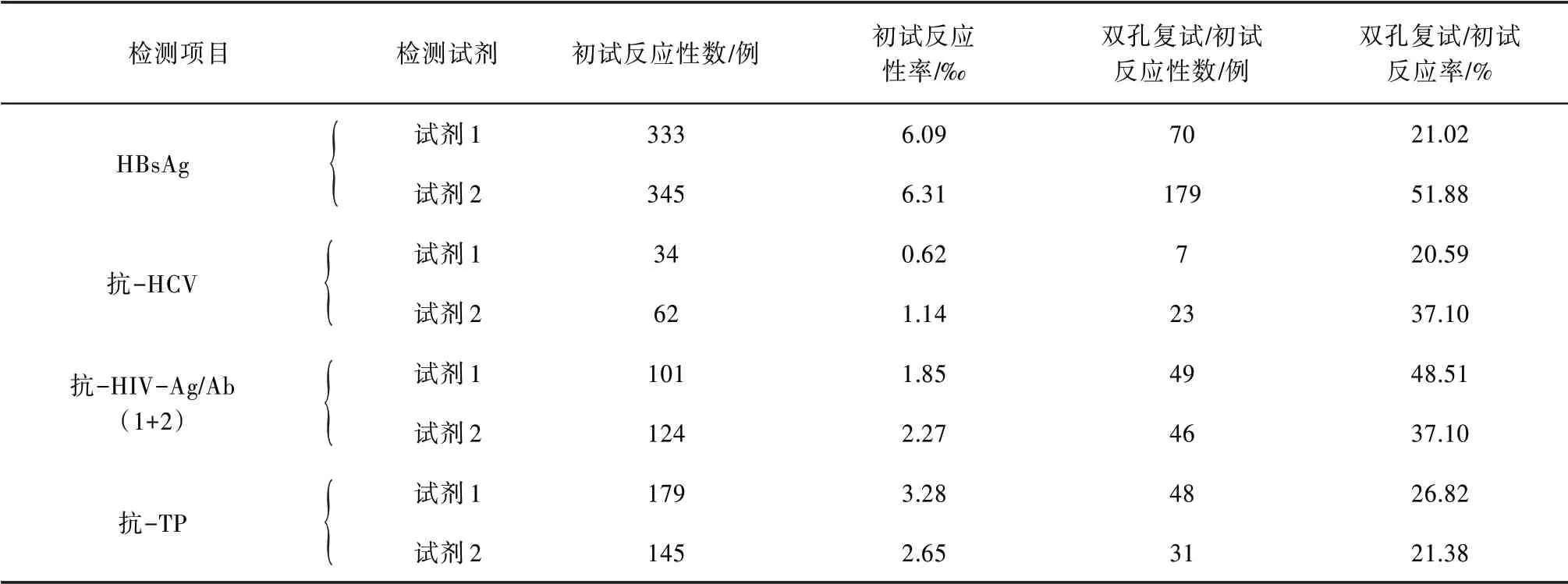
表2 单试剂初次检测反应性标本双孔复试反应性率检测情况统计(n=54 622)
2.3 同一试剂所有批次的单试剂初次检测反应性标本复试平均反应性率用各批次复试反应性率计算SD、CV(%),分析反应性率的离散程度。见表3。
2.4 试剂检测反应性率分布根据检测结果,按月统计2 个不同厂家的ELISA 试剂检测反应性率分布。见图1~4。
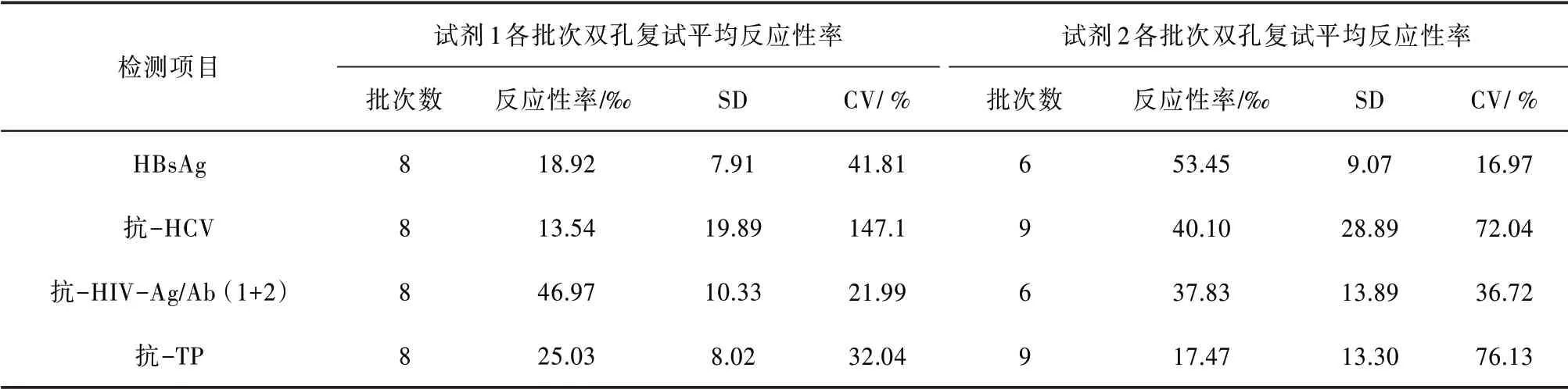
表3 2种试剂各批次单试剂初次检测反应性标本双孔复试平均反应性率统计
3 讨论
血站酶免检测中,由于实验室检测体系和检测能力存在差别,检测过程质量控制问题在小型血站实验室中尤为突出。本文拟通过对大理白族自治州中心血站酶免检测质量监控指标的回顾性分析,提供一些小型血站酶免检测中的关注视角。
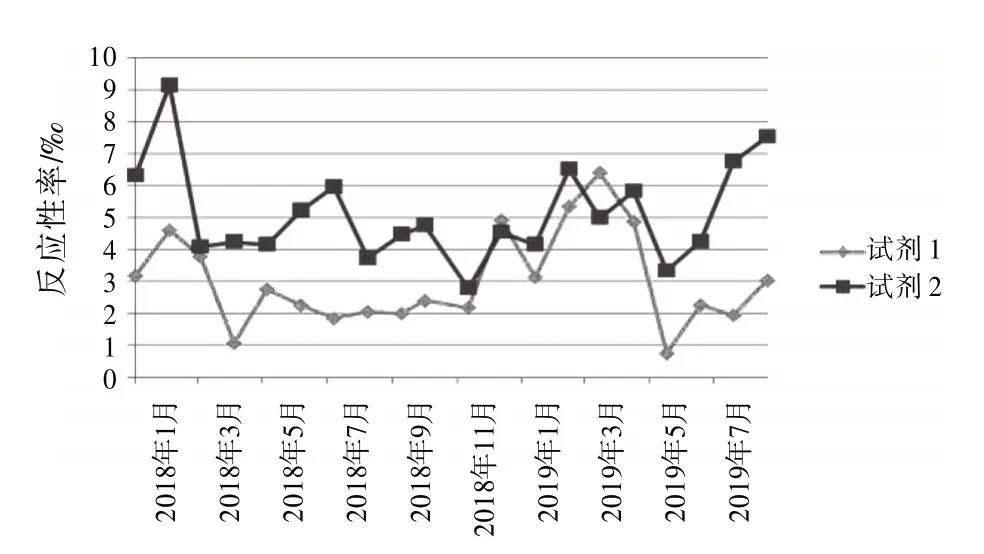
图1 HBsAg 2种试剂检测反应性率分布图
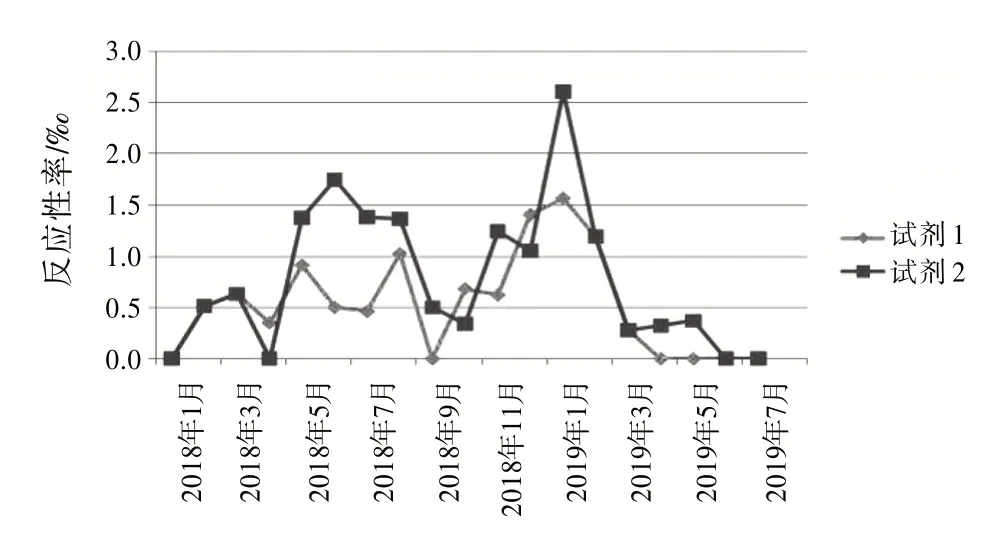
图2 抗-HCV 2种试剂检测反应性率分布图
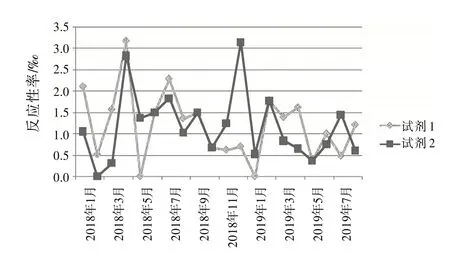
图3 抗-HIV Ag∕Ab(1+2)2种试剂检测反应性率分布图

图4 抗-TP 2种试剂检测反应性率分布图
同一ELISA 项目,反应原理不同,检测性能并非一致〔2〕。从表2可以看出,2种抗-HCV试剂,一为夹心法,一为间接法,双孔复试反应性率相差较大;2 种抗-HIV 试剂,均为第四代试剂(Ag-Ab 联合检测),双孔复试反应性率接近;2种HBsAg试剂,同为夹心法,理论上复试反应性率应接近,但实际上在检测中差异较大。由此提示,应进一步关注HBsAg检测的过程控制,如试剂配制、液体分配、孵育温度、洗板参数等。
由于ELISA 方法的局限性,假阳性较多〔3〕,加之为了进一步降低经血传播相关传染病的风险,血站普遍建立了“灰区”缓冲带〔4-6〕。有报道〔7〕认为献血者筛查的ELISA 检测,HBsAg 的假阳性率甚至达到了6成。从表3可以看出,HBsAg试剂2各批号双孔复试平均反应性率最高,CV最小,抗-HCV试剂1 各批号双孔复试平均反应性率最低,CV 最大。HBsAg(试剂2)、抗-HIV(试剂1∕试剂2)、抗-TP(试剂1)同一厂家多个批号间差异较小,CV 均在40%以下;2 种抗-HCV 试剂多个批号间差异均较大,其中试剂1 的CV 最高,为147.10%。当然,抗-HCV(试剂1)反应性标本数最少,检测下限也较低,双孔复试反应性率的这种差异可能跟样本总数少及检测下限低有关。但也提示我们,选择酶免试剂,不能仅仅追求较低的检测下限,也应把重复性作为酶免检测质量保证的关键控制点之一。
复试∕初试反应性率的变化体现了试验过程状态、实验室检测能力和质量管理体系运行状态,反映了实验室检测的整体情况〔8〕。结合表1和图1~4,月检测反应性率明显高于总反应性率时,应考虑是否因检测过程,包括献血者筛选、实验人员操作方法、设备故障频率、试剂物料储存、使用条件和批号更换、试验环境温湿度改变等导致假反应性增多;月检测反应性率明显低于总反应性率时,应分析是否有漏检的风险。2 种试剂的反应性率趋势不一致时,如图3 中抗-HIV 2018 年11 月与12 月2 种试剂的反应性率相比,试剂1 的11∕12 月反应性率接近,而试剂2的12月反应性率明显升高,应考虑12月跟试剂2 有关的检测过程是否存在问题,有无改进的方法;2 种试剂反应性率的总趋势突然改变时,如图1 中,HBsAg 检测的反应性率一直是试剂2 高于试剂1,但在2019 年3 月,试剂1 的反应性率突然高于试剂2,应及时回顾分析发生趋势改变的原因并找出改进措施。
自动化检测过程应实时监控,尽量减少人工干预。文中所述的单试剂初试反应性标本,双孔复试时均为手工加样,虽然手工移液器和自动化加样设备均经过检定或校验,但二者仍然存在差异,并在多次分配液体等过程中放大了这种差异。全自动检测的精准、低错是必然的〔9〕,因此,从2019 年9 月1日起,对所有双孔复试的标本,全部采用自动化加样,以保证检测体系的稳定性,效果如何,我们将持续关注。
综上所述,酶免检测实验室应重视对质量控制指标的分析,不能把某次试验及结果当做一个独立的事件,建立检测结果是检测体系整体过程综合能力体现的观念,通过对质量控制指标的分析与回顾,进一步提高检测质量。
