基于HPLC指纹图谱结合化学计量学的旋覆花药材质量评价研究
2021-03-17李欢欢严国俊胡玉涛陆兔林毛春芹
林 丽,李欢欢,谢 辉,严国俊,胡玉涛,陆兔林*,毛春芹*
基于HPLC指纹图谱结合化学计量学的旋覆花药材质量评价研究
林 丽1,李欢欢1,谢 辉1,严国俊1,胡玉涛2*,陆兔林1*,毛春芹1*
1. 南京中医药大学药学院,江苏 南京 210023 2. 江苏联合职业技术学院连云港中医药分院,江苏 连云港 222000
建立旋覆花药材的HPLC指纹图谱及同时测定绿原酸、咖啡酸、芦丁、花旗松素、1,5--二咖啡先奎宁酸、1--乙酰旋覆花内酯、槲皮素、狭叶依瓦菊素8个成分含量的方法,运用化学计量学对不同产地旋覆花药材进行质量评价。采用Dubhe C18色谱柱(250 mm×4.6 mm,5 μm);以乙腈-0.05%磷酸水溶液为流动相进行梯度洗脱;体积流量1.0 mL/min;检测波长205 nm;进样量10 μL;柱温30 ℃。采用中药指纹图谱相似度评价软件进行相似度分析,结合主成分分析和偏最小二乘法判别分析寻找并分析7个产地旋覆花药材间的差异成分及其分布特点。建立了旋覆花药材的HPLC指纹图谱,相似度为0.88~0.98,标定共有峰20个,通过对照品比对指认出绿原酸、咖啡酸、芦丁、花旗松素、1,5--二咖啡先奎宁酸、1--乙酰旋覆花内酯、槲皮素、狭叶依瓦菊素8个共有峰,样品一致性良好。通过主成分分析将样品聚为4类,结合偏最小二乘法判别分析发现咖啡酸、绿原酸、1--乙酰旋覆花内酯等7个成分是造成样品差异性的主要标记性成分。含量测定结果表明:各产地8种成分总量江苏>甘肃>河南>浙江>河北>安徽>山东。首次建立了旋覆花药材HPLC指纹图谱及倍半萜类、黄酮类、酚酸类多成分含量测定的质量评价方法,操作简便、结果可靠,明确了不同产地旋覆花药材间成分的差异,为旋覆花药材的资源开发及利用提供依据。
旋覆花;指纹图谱;化学计量学;多成分定量;绿原酸;咖啡酸;芦丁;花旗松素;1,5--二咖啡先奎宁酸;1--乙酰旋覆花内酯;槲皮素;狭叶依瓦菊素
旋覆花为菊科植物旋覆花Thunb.或欧亚旋覆花L.的干燥头状花序,具有降气、消痰、行水、止呕的功效,主治风寒咳嗽、喘咳痰多、呕吐噫气、心下痞硬等症[1],主产于河南、江苏、浙江等地。旋覆花成分复杂,主要含有倍半萜内酯类、黄酮类、酚酸类、萜类等化学成分[2-5],具有抗肿瘤、抗菌、抗炎、抗氧化等药理作用[5-9],文献研究表明倍半萜内酯类成分为旋覆花特征性成分[5],黄酮类、酚酸类成分也是其抗菌、消炎的主要活性成分[10]。《中国药典》2015年版一部旋覆花药材项下仅有薄层鉴别,旋覆花药材的质量研究多集中于倍半萜类、总黄酮类等同类成分的含量测定研究[11-12]以及指纹图谱研究[13-14]。现有文献对旋覆花药材的质量研究尚不全面,数据分析方法较为单一,指纹图谱结合模式识别方法能真实、形象地反映中药质量差异,揭示复杂化合物之间的规律,已被应用于药物的质量控制、差异标志物的筛选等方面[15-16]。因此,本实验收集同一基原多产地的旋覆花药材,建立HPLC指纹图谱,有效分离色谱峰,实现了倍半萜类、黄酮类、酚酸类的多成分同时测定,指认出绿原酸、咖啡酸、芦丁、花旗松素、1,5--二咖啡先奎宁酸、1--乙酰旋覆花内酯、槲皮素、狭叶依瓦菊素8个化学成分。结合化学计量学对数据进行深入分析,筛选出造成产地差异的标记性成分,寻求产地间的差异,有利于旋覆花药材资源的开发利用,以期为旋覆花药材质量控制标准的制定提供科学依据。
1 仪器与材料
1.1 仪器
Agilent 1100型高效液相色谱仪[安捷伦科技(中国)有限公司];MS-105D型电子分析天平(瑞士梅特勒-托利多公司);KQ-500E型数控超声波清洗器(昆山市超声仪器有限公司)。
1.2 材料
1--乙酰旋覆花内酯(批号CFS201802)、狭叶依瓦菊素(批号CFS201801)均购自武汉天植生物技术有限公司;1,5--二咖啡酰奎宁酸(批号P26F9F54633)、花旗松素(批号Z07M6B1)、绿原酸(批号Y24J7K16726)、芦丁(批号Y22S653719)均购自上海源叶生物科技有限公司;咖啡酸(批号110885-200102)、槲皮素(批号10081-9905)均购自中国食品药品检定研究院;乙腈(HPLC级,德国Merck公司);色谱纯磷酸(上海化学试剂有限公司);水为娃哈哈纯净水;其他试剂均为分析纯(山东禹王实业有限公司化工分公司);Dubhe C18色谱柱(150 mm×4.6 mm,5 μm,汉邦科技)。35批旋覆花药材的产地见表1,经南京中医药大学药学院陈建伟教授鉴定均为菊科植物旋覆花Thunb.的干燥头状花序。
2 方法与结果
2.1 HPLC色谱条件
Dubhe C18色谱柱(150 mm×4.6 mm,5 μm);流动相为乙腈(B)-0.05%磷酸水溶液(A),梯度洗脱,0~45 min,90%~75% A;45~50 min,75%~70% A;50~85 min,70%~60% A;85~90 min,60%~90% A;检测波长为205 nm;体积流量1.0 mL/min;柱温30 ℃;进样量10 μL。

表1 旋覆花样品的来源
2.2 混合对照品溶液的制备
分别精密称取绿原酸、咖啡酸、1--乙酰旋覆花内酯、1,5--二咖啡酰奎宁酸、花旗松素、芦丁、槲皮素、狭叶依瓦菊素对照品适量,加70%甲醇配制成质量浓度分别为1.11、0.078、1.58、99.3、0.354、4.19、0.776、1.43 mg/mL的混合对照品溶液。
2.3 供试品溶液的制备
取样品粉末(过4号筛)约1.0 g,精密称定,置50 mL具塞锥形瓶中,精密加入70%甲醇30 mL,称定质量,超声处理(功率500 W,频率40 kHz)60 min,放冷,再称定质量,用70%甲醇补足减失质量,摇匀,滤过,续滤液用0.45 μm微孔滤膜滤过,即得。
2.4 方法学考察
2.4.1 线性关系考察 精密称取绿原酸、咖啡酸、1--乙酰旋覆花内酯、1, 5--二咖啡酰奎宁酸、花旗松素、芦丁、槲皮素、狭叶依瓦菊素对照品适量,加70%甲醇配制成质量浓度分别为1.67、0.117、2.36、148.9、0.531、6.29、1.16、2.15 mg/mL的混合对照品储备液。精密量取混合对照品储备液,用倍比稀释的方法以70%甲醇制成系列对照品溶液,在“2.1”项色谱条件下,分别进样10 μL,每个质量浓度2针,记录各峰面积的值,以峰面积平均值()对质量浓度()进行线性回归,结果见表2。

表2 有效成分的回归方程、线性范围及相关系数
2.4.2 精密度试验 取旋覆花样品(S6)1.0 g,精密称定,按“2.3”项下方法制备供试品溶液,“2.1”项下色谱条件测定,连续进样6次,记录指纹图谱,以1,5--二咖啡酰奎宁酸为参照峰,计算各共有峰相对峰面积的RSD为0.54%~3.08%,相对保留时间的RSD为0.04%~0.67%,表明仪器精密度良好。
2.4.3 重复性试验 精密称取旋覆花样品(S6)1.0 g,平行6份,按“2.3”项下的方法制备供试品溶液,“2.1”项下色谱条件测定,记录指纹图谱,以1, 5--二咖啡酰奎宁酸为参照峰,计算各共有峰相对峰面积的RSD为0.54%~3.37%,相对保留时间的RSD为0.02%~1.57%,表明方法重复性良好。
2.4.4 稳定性试验 取旋覆花样品(S6)1.0 g,精密称定,按“2.3”项下的方法制备供试品溶液,分别在0、2、4、8、12、24 h,按“2.1”项下色谱条件测定,记录指纹图谱,以1,5--二咖啡酰奎宁酸为参照峰,计算各共有峰相对峰面积的RSD为0.47%~3.33%,相对保留时间的RSD为0.02%~0.43%,表明在该条件下供试品溶液在24 h内稳定。
2.4.5 加样回收率试验 精密称取已测定的8种成分含量的旋覆花药材粉末(S6)9份,每份0.5 g,分成3组,每组3份,分别精密加入含绿原酸1.11 mg/mL、咖啡酸0.078 mg/mL、1--乙酰旋覆花内酯1.58 mg/mL、1,5--二咖啡酰奎宁酸99.3 mg/mL、花旗松素0.354 mg/mL、芦丁4.19 mg/mL、槲皮素0.776 mg/mL、狭叶依瓦菊素1.43 mg/mL的混合对照品溶液0.5、1.0、1.5 mL,按“2.3”项下方法制备成供试品溶液,按“2.1”项色谱条件进样测定,计算平均加样回收率。结果表明,绿原酸、咖啡酸、1--乙酰旋覆花内酯、1,5--二咖啡酰奎宁酸、花旗松素、芦丁、槲皮素、狭叶依瓦菊素的平均回收率分别为99.97%、98.87%、101.84%、100.94%、100.13%、101.04%、99.05%、101.45%,RSD分别为0.74%、1.44%、2.75%、1.66%、1.33%、1.60%、1.49%、2.77%。
2.5 旋覆花药材指纹图谱的建立及共有峰的标定
2.5.1 旋覆花药材指纹图谱的建立 分别取35批不同产地的旋覆花药材1.0 g,按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件进样测定,记录色谱图,将35批旋覆花药材指纹图谱依次导入《中药色谱指纹图谱相似度评价系统》(2012版)软件,设定S6为参照图谱,采用平均数法,时间窗宽度为0.5,进行多点校正和色谱峰匹配,并进行了相似度计算,结果见表3;确定了20个共有峰,得到旋覆花药材指纹图谱叠加图,见图1;生成旋覆花药材的共有模式特征图谱,见图2。
2.5.2 旋覆花药材指纹图谱共有峰的标定 通过与对照品对照,指认出其中8个色谱峰,分别为绿原酸(6号峰)、咖啡酸(8号峰)、芦丁(9号峰)、花旗松素(10号峰)、1,5--二咖啡酰奎宁酸(12号峰)、1--乙酰旋覆花内酯(16号峰)、槲皮素(17号峰)、狭叶依瓦菊素(20号峰)。在35批旋覆花药材指纹图谱中,以12号1,5--二咖啡酰奎宁酸色谱峰分离良好,峰面积适中,所以确定12号色谱峰为参照峰,计算各共有峰的相对峰面积。

表3 旋覆花样品的相似度

图1 35批旋覆花药材指纹图谱

6-绿原酸 8-咖啡酸 9-芦丁 10-花旗松素 12-1,5-O-二咖啡酰奎宁酸 16-1-O-乙酰旋覆花内酯 17-槲皮素 20-狭叶依瓦菊素
2.5.3 旋覆花药材指纹图谱的相似度评价 采用《中药色谱指纹图谱相似度评价系统》(2012版)软件计算指纹图谱相似度(表3),结果显示,35批旋覆花药材指纹图谱的相似度在0.88~0.98,相似度在0.9以上的药材占85.71%;35批旋覆花药材的20个共有峰相对保留时间的RSD均小于2.06%,相对峰面积的RSD为8.91%~79.71%。说明不同产地间旋覆花药材整体化学组分类似,药材质量稳定,但可能由于受到气候、土壤、地势地貌等环境因素以及采收加工过程中人为因素的影响,导致药材内在化学成分的含量存在一定差异。
2.6 主成分分析(PCA)
PCA其本质是以最大方差为原则进行分析,将数据的多元变量抽取出少量主成分,前几个主成分对于复杂的中药体系而言,往往能够表征化学量测数据的整体情况[17-19]。为了进一步分析35批样品间的差异,以主成分的特征值和累积贡献率作为选择主成分的依据,采用SPSS 22.0软件对35批旋覆花药材数据进行PCA分析,相关系数的特征值和方差贡献率见表4。以特征值>1为提取标准,可提取4个主成分,其累积方差贡献率达95.56%,可代表旋覆花药材指纹图谱共有峰的大部分信息。
将矩阵数据导入SIMCA-P+13.0软件,采用非监督识别方法进行主成分分析观察旋覆花药材的自然聚集,35批旋覆花药材的PCA得分矩阵图见图3,7个产地的旋覆花药材可以完全区分为4类,可直观显示样品间的差异。由图3可知,聚为一组的样品存在产地间的差异性,同产地内也存在差异性。江苏产地样品间离散度较大;山东、河北聚为一类但内部差异性显著,可能是因为这2个产地均为沿海城市且相邻,但气候、地理环境仍存在差异,导致样品化学成分存在差别。
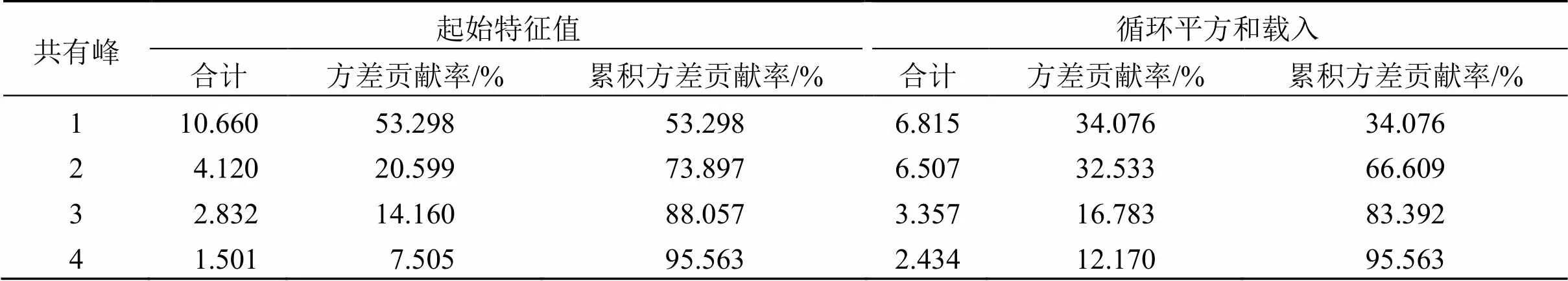
表4 特征值和方差贡献率

1-甘肃 2-江苏 3-山东、河北 4-河南、浙江、安徽,下同图
2.7 偏最小二乘法-判别分析(PLS-DA)
为更好地观察组间差异,在PCA的基础上选择有监督模式的PLS-DA进行了各组间的判别分析。结合评价PLS-DA模型的3个指标:模型拟合参数2=0.876,2=0.976,模型预测参数2=0.971,均大于0.5,表明建立的数学模型稳定且预测能力较强。PLS-DA得分矩阵图见图4,可看出不同产地的样品集中在不同区域,与PCA结果一致。
结合变量重要性投影值(variable importance in the projection,VIP)筛选出引起组间差异的主要标记性成分,VIP得分图见图5,拥有较大VIP值的变量(VIP>1),对分类的贡献越大[17],筛选出贡献率较大的7个变量,按VIP大小排序依次为咖啡酸(8号峰)、5号峰、绿原酸(6号峰)、1--乙酰旋覆花内酯(16号峰)及3、15、2号峰,这些成分在区分不同产地旋覆花药材间起到重要作用,是其主要标志性成分。

图4 35批旋覆花药材的PLS-DA得分图
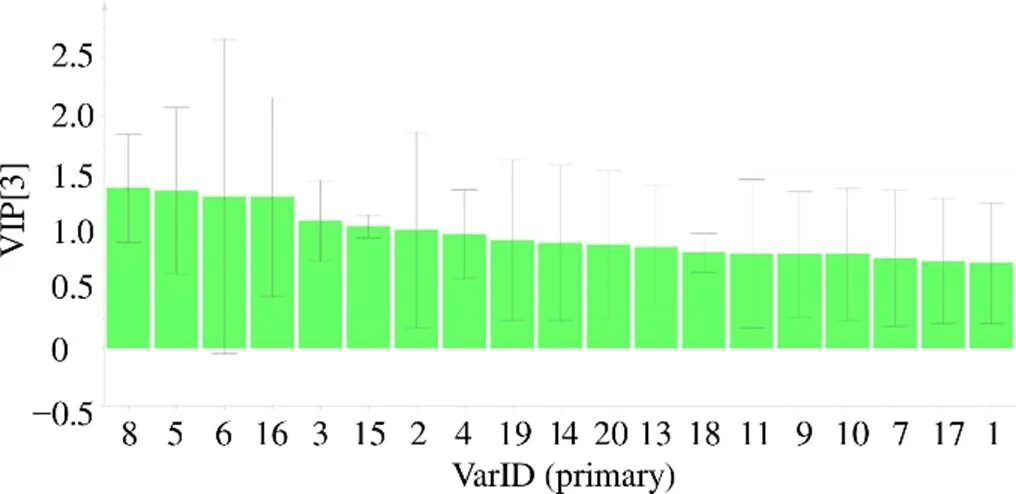
图5 旋覆花药材20个色谱峰的VIP值
2.8 旋覆花样品含量测定及结果分析
取35批旋覆花药材样品,平行3份,按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件进行测定,记录峰面积,计算8种化学成分含量见表5。
按照产地进行区分,不同产地样品所测的8种成分含量差异明显。结果表明,1,5--二咖啡酰奎宁酸是各产地旋覆花样品中含量最高的化学成分,在107.501~212.425 mg/g,以甘肃产地含量最高,山东产地最低;7个产地中1--乙酰旋覆花内酯质量分数达到0.120~3.935 mg/g,以河北产地最高,安徽产地最低;倍半萜类成分总量以江苏产地最高,含量达到5.953~6.643 mg/g,甘肃产地最低;3个主要标记性成分(咖啡酸、绿原酸、1--乙酰旋覆花内酯)总量范围在3.871~10.448 mg/g,河北>江苏>山东>河南>浙江>安徽>甘肃。
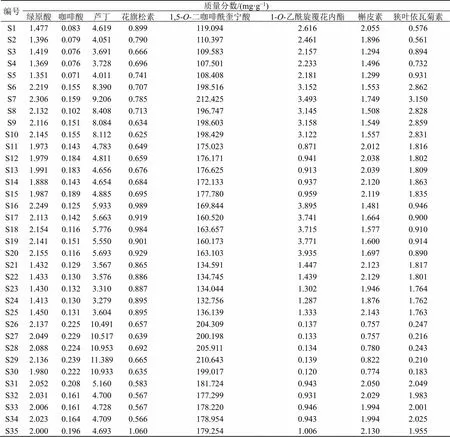
表5 35批旋覆花样品中8种成分含量测定结果(n=3)
综上所述,甘肃产地咖啡酸、芦丁、1,5--二咖啡酰奎宁酸含量最高,花旗松素、1--乙酰旋覆花内酯、槲皮素、狭叶依瓦菊素含量最低,与其他产地成分差异显著,与指纹图谱相似度评价结果和PCA结果一致。各产地8种成分总量江苏>甘肃>河南>浙江>河北>安徽>山东,同一成分在各产地旋覆花药材中的含量差异显著,不同成分的含量波动范围不同。
3 讨论
本实验考察了回流法、超声提取法2种提取方法,结果表明超声处理与回流提取无显著差异,故选择超声处理制备样品。同时对提取溶剂(50%、60%、70%、80%)甲醇、(50%、60%、70%、80%)乙醇,料液比(1∶15、1∶30)进行综合考察,发现以70%甲醇为提取溶剂,液料比1∶30时,提取效果最佳,色谱峰基线较为平稳、杂质干扰较少,因此选择30 mL 70%甲醇为提取溶剂。
本实验通过DAD检测器进行全波长扫描,在205 nm检测条件下可以一次性完成检测,色谱峰信息全面,各峰吸收均匀,整体峰形良好;同时比较了甲醇-水、乙腈-水、乙腈-0.1%甲酸水溶液、乙腈-0.05%磷酸水溶液等流动相系统梯度洗脱情况,发现乙腈-0.05%磷酸水溶液为流动相进行梯度洗脱时色谱峰分离度较好、对称性最好,杂质干扰较小,确定流动相通过最终优化建立较全面的旋覆花药材HPLC指纹图谱。
对7个产地35批旋覆花药材建立指纹图谱,指认出绿原酸、咖啡酸、芦丁、花旗松素、1,5--二咖啡先奎宁酸、1--乙酰旋覆花内酯、槲皮素、狭叶依瓦菊素8个成分,同时采用不同分析方法[18-19]对旋覆花药材20个共有峰进行多元统计分析,考察样品整体性与差异性。结果表明,PCA和PLS-DA分析结果一致,样品聚为4类,山东与河北产地由于生态环境相似,相邻且均为沿海城市因而聚为一类,但内部能明显区分;甘肃产地聚为一类,与其他产地相距较远,与相似度结果一致;VIP筛选出7个主要标记性成分,通过对照品指认出咖啡酸、绿原酸、1--乙酰旋覆花内酯这3个成分。不同产地间的成分差异可能来源于地形地貌、气候、土壤等因素在其生长代谢过程中产生的影响,同一产地的生态环境相似,但药材质量也会受采收时间、种植方式等因素影响。《中国药典》2015年版一部旋覆花药材无含量测定项,实验筛选出的标记性成分可为旋覆花药材质量标准的建立提供科学依据,基于网路药理学研究可知1--乙酰旋覆花内酯、狭叶依瓦菊素、槲皮素为旋覆花活性成分,可为旋覆花降气止呕功效机制研究打下基础,本实验仅收集单一基原的旋覆花药材样品,对旋覆花药材多基原的分析尚未进行,有望后续采集欧亚旋覆花样品进行深入研究,比较两个基原样品间指纹图谱的差异和主要标记性成分的异同,为建立全面科学的旋覆花药材质量评价体系提供参考。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典[S]. 一部. 2015: 325.
[2] 覃江江四种旋覆花属药用植物中新型倍半萜的发现及生物活性研究[D]. 上海: 上海交通大学, 2011.
[3] 朱虹, 唐生安, 秦楠, 等. 旋覆花中化学成分及其活性研究 [J]. 中国中药杂志, 2014, 39(1): 83-88.
[4] 吴一兵, 王云志, 查建蓬, 等. 欧亚旋覆花中三萜和甾体化合物的分离和结构鉴定 [J]. 中草药, 2006, 37(5): 666-668.
[5] 张婷, 杜冠华, 陈若芸. 旋覆花属植物中倍半萜类成分及生物活性的研究进展 [J]. 中国药学杂志, 2010, 45(24): 1889-1894.
[6] Yu Z P, Zhang J S, Zhang Q Q,. Bioactive sesquiterpenoids and sesquiterpenoid glucosides from the flowers of[J]., 2019, 138: 104292.
[7] Mohti H, Taviano M F, Cacciola F,.(L.) Aiton leaves and flower buds: Effect of extraction solvent/technique on their antioxidant ability, antimicrobial properties and phenolic profile [J]., 2020, 34(1): 46-52.
[8] 于峰, 王思明, 董玫, 等. 三种倍半萜类化合物体外抗肿瘤细胞增殖活性研究 [J]. 天然产物研究与开发, 2010, 22(3): 506-509.
[9] 张馨予, 王喆星, 单俊杰. 旋覆花属植物化学成分及生物活性的研究进展 [J]. 国际药学研究杂志, 2008, 35(6): 433-440.
[10] Kim S R, Park M J, Lee M K,. Flavonoids ofprotect cultured cortical cells from necrotic cell death induced by glutamate [J]., 2002, 32(7): 596-604.
[11] 杨茜, 刘慧, 何雅君, 等. HPLC法同时测定旋覆花属植物中5种倍半萜内酯成分的含量 [J]. 沈阳药科大学学报, 2012, 29(2): 116-120.
[12] 耿红梅. RP-HPLC法同时测定欧亚旋覆花中4种黄酮的含量 [J]. 中国药房, 2009, 20(27): 2122-2123.
[13] 侯艳鹏, 王建华, 尚明英, 等. 旋覆花药材HPLC指纹图谱研究 [J]. 中国药学杂志, 2002, 37(12): 894-899.
[14] 施之琪, 付建武, 蔡春晖, 等. 旋覆花配方颗粒HPLC特征图谱研究 [J]. 中药新药与临床药理, 2017, 28(6): 765-770.
[15] Peng Q, Tian R, Chen F,. Discrimination of producing area of Chinese Tongshan Kaoliang Spirit using electronic nose sensing characteristics combined with the chemometrics methods [J]., 2015, 178: 301-305.
[16] 甄亚钦, 冯玉, 田伟, 等. 忍冬不同部位UPLC指纹图谱及化学模式识别研究 [J]. 中草药, 2019, 50(18): 4449-4454.
[17] Liang J, Wu W Y, Sun G X,. A dynamic multiple reaction monitoring method for the multiple components quantification of complex traditional Chinese medicine preparations: Niuhuang Shangqing Pill as an example [J]., 2013, 1294: 58-69.
[18] 王琪, 李晓琦, 黄萌萌, 等. 基于指纹图谱及多成分含量的化学模式识别法评价不同产地栀子药材的质量 [J]. 中草药, 2019, 50(11): 2690-2699.
[19] 秦建平, 李家春, 吴建雄, 等. 基于UPLC结合化学计量学方法的龙血竭指纹图谱研究 [J]. 中国中药杂志, 2015, 40(6): 1114-1118.
Quality study ofbased on HPLC and chemometrics
LIN Li1, LI Huan-huan1, XIE Hui1, YAN Guo-jun1, HU YU-tao2, LU Tu-lin1, MAO Chun-qin1
1. College of Pharmacy, Nanjing University of Chinese Medicine, Nanjing 210023, China 2. Lianyungang TCM Branch of Jiangsu Union Technical Institute, Lianyungang 222000, China
To establish HPLC fingerprints and simultaneous determination of chlorogenic acid, caffeic acid, rutin, taxifolin, 1,5--dicaffeoylqunic acid, 1--acetyl britannilactone, quercetin, ivangustin of, the chemometrics method was used to carry out the quality evaluation offrom different producing areas.Separation was performed on Hanbon Dubhe C18column (250 mm × 4.6 mm, 5 μm) and mobile phase was acetonitrile-0.05% phosphoric acid with gradient elution, the flow rate was 1.0 mL/min. The detection wavelength was 205 nm, the injection volume was 10 μL and the column temperature was 30 ℃. Similarity evaluation system for chromatographic fingerprint of traditional Chinese medicine (TCM) was adopted; Principal component analysis (PCA) and discriminant analysis by partial least square method (PLS-DA) were used to identify and analyze the differential components in 35 batches offrom seven habitats.The fingerprints ofwere established, the similarity was 0.88—0.98. There were 20 common peaks in the fingerprints and 8 common peaks of chlorogenic acid, caffeic acid, rutin, taxifolin, 1,5--dicaffeoylqunic acid, 1--acetyl britannilactone, quercetin, ivangustin were identified by reference substances, indicating good consistency of the samples. The samples were clustered into four categories by PCA. Combined with PLS-DA, seven components, such as caffeic acid, chlorogenic acid, and 1--acetyl britannilactone, were found to be the main markers for sample variability. Content determination results showed that eight components of each producing area is Jiangsu > Gansu > Henan > Zhejiang > Hebei > Anhui > Shandong.The establishment of HPLC fingerprint quality evaluation method and multi-component determination method of sesquiterpenes, flavonoids and phenolic acids ofwas easy to operate and reliable, clarified the difference of composition between different producing areas, which provided the basis for the exploitation and utilization of medicinal materials.
; fingerprint; chemometrics; assay of multi-component; chlorogenic acid; caffeic acid; rutin; taxifolin; 1,5--dicaffeoylqunic acid; 1--acetyl britannilactone; quercetin; ivangustin
R286.2
A
0253 - 2670(2021)06 - 1751 - 08
10.7501/j.issn.0253-2670.2021.06.025
2020-08-06
国家重点研发计划:中药饮片质量识别关键技术研究(2018YFC1707000)
林 丽,女,在读硕士,主要从事中药炮制及中药饮片质量标准研究。Tel: 15952788450 E-mail: 1306124026@qq.com
陆兔林,男,教授,博士生导师,主要从事中药炮制及中药饮片质量标准研究。Tel: 13951636763 E-mail: lutuling2005@ 126.com毛春芹,女,正高级实验师,主要从事新药研发及药物制剂研究。E-mail: mcq63@163.com
胡玉涛,男,讲师,主要从事药用植物教学研究。Tel: 15705142858 E-mail: 907773517@qq.com
[责任编辑 时圣明]
