基于2种色谱-质谱联用技术的参芪降糖颗粒化学成分分析
2021-03-17李冰冰黄文静程国良王乐琪严诗楷
王 倩,李冰冰,黄文静,程国良,王乐琪,肖 雪,严诗楷
基于2种色谱-质谱联用技术的参芪降糖颗粒化学成分分析
王 倩1, 4,李冰冰2*,黄文静1, 4,程国良2,王乐琪1, 4,肖 雪1, 4,严诗楷1, 3, 4*
1. 广东药科大学中医药研究院,广东 广州 510006 2. 中药制药共性技术国家重点实验室,山东 临沂 276000 3. 上海交通大学药学院,上海 200240 4. 广东省代谢病中西医结合研究中心,广东 广州 510006
基于UPLC-Q/TOF MS和GC-MS法分析参芪降糖颗粒的化学成分。参芪降糖颗粒甲醇提取液采用Zorbax RRHD SB C18(100 mm×2.1 mm,1.7 μm)色谱柱,以乙腈-水为流动相进行梯度洗脱,体积流量0.3 mL/min。电喷雾离子源正负离子模式下对色谱流出物进行质谱检测,利用Peakview软件,根据二级质谱信息及文献,对主要色谱峰进行鉴定分析。参芪降糖颗粒挥发性成分分析采用HP-5MS毛细管柱(60 m×250 μm×0.25 μm),程序升温,EI离子源,质量扫描范围/25~500。GC-MS分析通过NIST 2014标准谱库检索并结合文献对参芪降糖颗粒中挥发性成分进行快速鉴定。参芪降糖颗粒中共鉴定出132个非挥发性成分和86个挥发性成分。提供了一种快速、有效、全面系统地对参芪降糖颗粒的化学成分进行定性分析的方法,为参芪降糖颗粒药效物质基础研究、二次开发、质量控制、药理作用机制研究等奠定基础。
参芪降糖颗粒;化学成分;UPLC-Q/TOF MS;GC-MS;定性分析
参芪降糖颗粒是由人参茎叶总皂苷、黄芪、五味子、山药等11味中药,经一系列现代生产工艺制备的中药复方制剂,具有益气养阴、滋脾补肾的功效,临床上常用于治疗2型糖尿病[1]。目前,参芪降糖颗粒的研究多以统计和观察临床数据为主,关于参芪降糖颗粒的化学成分研究较少,张慧等[2]采用液质联用技术鉴定出98个化合物,主要包括皂苷、黄酮、木脂素等非挥发性化学成分,未对其挥发性成分开展研究。其余研究多局限于单一药材或个别成分的定性定量研究,缺乏整体认识。中药物质基础研究是阐明中药整体功效及其作用机制的核心环节,也是深层次开发中药方剂、改进工艺和剂型、制定质量标准、提高临床疗效的重要基础。因此,有必要更加全面系统地开展参芪降糖颗粒的物质基础分析研究。
中成药多为复方制剂,其化学成分繁多,需采用快速、分离度好、准确性高的分析仪器进行成分分析与鉴定。近年来,超高效液相色谱-四级杆飞行时间质谱(UPLC-Q/TOF MS)和气相色谱-质谱联用技术(GC-MS)等色谱-质谱联用技术凭借其具有的高分离性、高分辨率以及高灵敏度等优势,在不需要对照品的情况下能提供化合物的结构表征所需的精确质量数、元素组成、质谱碎片等信息,在中药非挥发性成分和挥发性成分的定性检测方面得到了广泛应用[3-4]。本研究拟采用UPLC-Q/TOF MS和GC-MS 2种仪器和技术对参芪降糖颗粒的化学成分进行全面定性分析,以期为参芪降糖颗粒的质量控制、二次开发、工艺改进及其药理作用机制等研究提供科学依据。
1 仪器与试药
1.1 仪器
AB Sciex Q/TOF MS质谱仪(Analyst1.6工作站,美国AB Sciex公司);Agilent 7890B-5977A气相色谱质谱联用仪(美国Agilent公司,配备7890B GC分离系统,5977A MSD检测器,Mass Hunter 工作站);ZDHW型电热套(北京中兴伟业仪器有限公司);PL2002电子天平(梅特勒-托利多仪器上海有限公司);ELGA超纯水机(法国威立雅集团)。
1.2 试剂及药物
甲醇和乙腈(质谱级,德国Merck公司);参芪降糖颗粒(生产批号01190551,鲁南厚普制药有限公司);正己烷(分析纯,天津科密欧化学试剂公司),无水硫酸钠(天津市致远化学试剂有限公司),超纯水(自制)。
2 方法
2.1 供试品溶液制备
2.1.1 UPLC-Q/TOF MS供试品溶液制备 精密称取参芪降糖颗粒3.000 g,加甲醇溶解并定容至50 mL量瓶中,超声提取1 h,得参芪降糖颗粒甲醇提取液,3000 r/min离心10 min后,过0.22 µm微孔滤膜,即得。
2.1.2 GC-MS供试品溶液制备 称取参芪降糖颗粒300 g,置于水蒸气蒸馏装置内,加热提取6 h后,收集馏出液,加入2 mL正己烷萃取油状物,加入适量的无水硫酸钠静置过夜,吸取上清液,即得。
2.2 色谱-质谱联用条件
2.2.1 UPLC-Q/TOF MS分析条件
液相色谱条件:Zorbax RRHD SB C18色谱柱(100 mm×2.1 mm,1.7 μm);流动相为水(A)-乙腈(B),梯度洗脱:0~3 min,5% B;3~18 min,5%~25% B;18~30 min,25%~42% B;30~40 min,42%~60% B;40~50 min,60%~85% B;50~55 min,85%~95% B;55~60 min,95% B;柱温30 ℃,体积流量0.3 mL/min,进样量5 μL。
质谱条件[5]:电喷雾离子源分别在正负模式下进行检测,扫描时间0.08 s;采集时间60 min;TOF/ MS扫描范围/100~2000;Product Ion扫描范围50~1500;雾化气体积流量50 mL/min;脱溶剂气流速50 mL/min;气帘气体积流量35 mL/min;脱溶剂气温度500 ℃;离子喷雾电压5500 V;去簇电压80 V/−80 V;碰撞能10 V/−10 V;动态背景扣除模式;质谱漂移范围5×104。
2.2.2 GC-MS分析条件
气相色谱条件:HP-5MS毛细管柱(60 m×250 μm×0.25 μm);载气为氦气,体积流量1.0 mL/min,分流进样,分流比为5∶1;进样口温度为260 ℃;程序升温:起始温度为50 ℃,以4 ℃/ min升温至130 ℃,保持5 min;以3℃/min升温至175 ℃,保持15 min;以7 ℃/min升温至210 ℃,保持5 min;以10 ℃/min升温至280 ℃,保持3 min;进样量1 µL。
质谱条件:电子轰击电离(EI)源,电子能量70 eV,离子源温度230 ℃,四极杆温度150 ℃,溶剂延迟时间5 min,全扫描采集模式,扫描范围/25~550。
3 结果
3.1 非挥发性成分
按照“2.1.1”项的方法制备供试品溶液,在“2.2.1”的分析条件下进样,参芪降糖颗粒中非挥发性成分在正离子和负离子模式采集的基峰图(base peak chromatogram,BPC)见图1。将采集的数据导入Peakview 1.2(Analyst1.6工作站,AB Sciex公司,美国),选择BPC,Mass tolerance 0.4,根据各保留时间下化合物的/值,利用软件中Formula Finder功能计算化合物的分子离子类型,将可能的化合物结构信息的mol文件导入Peakview 1.2并与化合物的Product Ion进行比对鉴定,同时结合化学键断裂规律及文献数据确定化合物结构。参芪降糖颗粒非挥发性成分中共鉴定出132种化合物,结果见表1。复方参芪降糖颗粒的成分归属可知,来源于人参(23个)、黄芪(17个)、茯苓(27个)、泽泻(19个)、五味子(15个)的成分相对较多,来源于地黄(10个)、麦冬(9个)、天花粉(3个)、枸杞子(7个)、覆盆子(9个)、山药(8个)等药材的成分较分散,其中包括某些成分存在于多种药材中,例如甜菜碱等成分来源于黄芪、枸杞子,鸟苷、尿苷等成分在人参、黄芪、麦冬、地黄等药材中均含有。进一步对主要成分质谱裂解规律与结构解析进行总结。

图1 参芪降糖颗粒BPC图谱
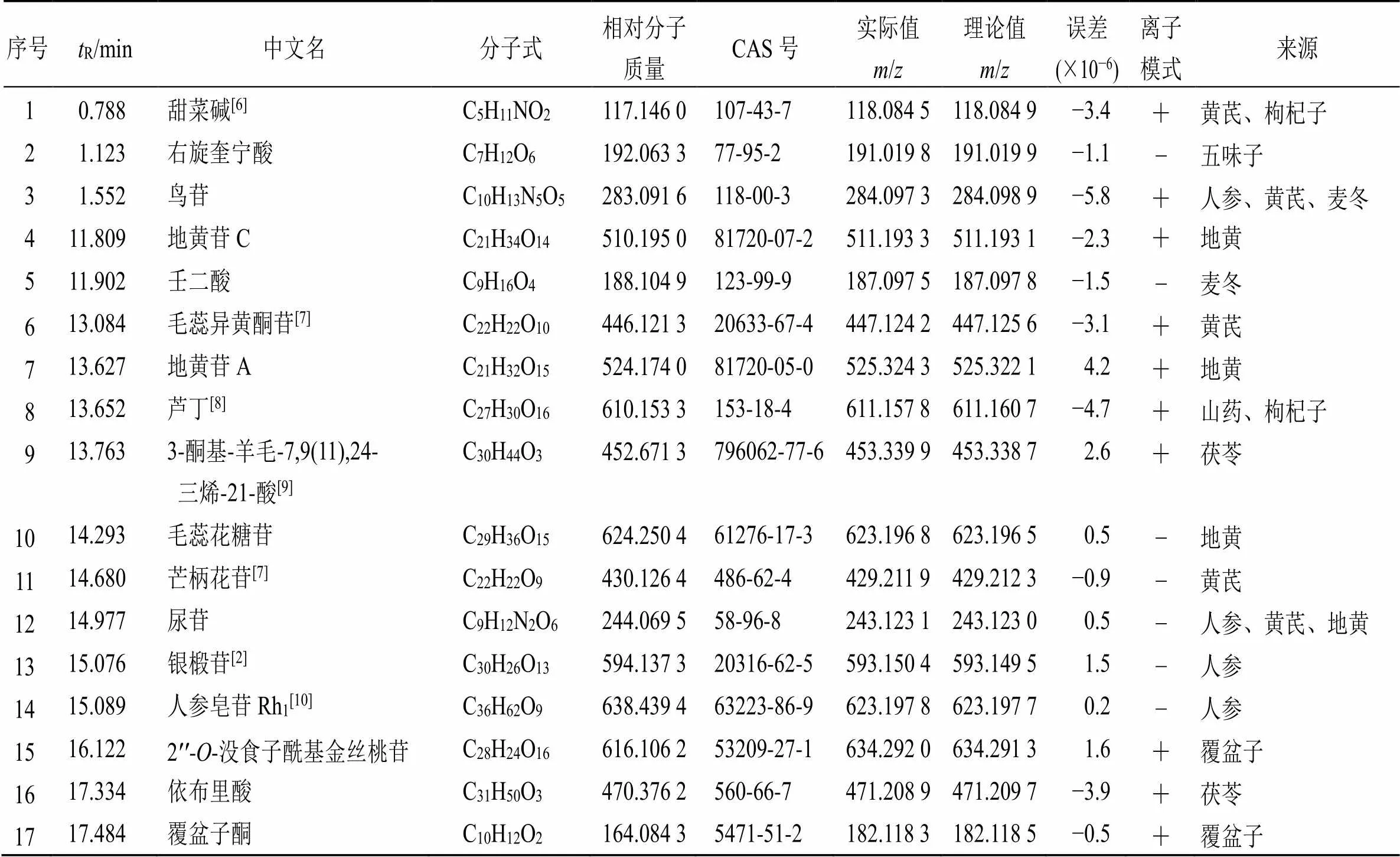
表1 参芪降糖颗粒UPLC-Q/TOF MS分析

续表1

续表1
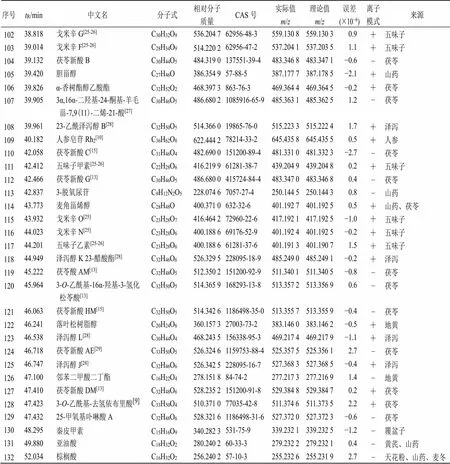
续表1
3.1.1 人参皂苷Rg1在ESI+模式下,保留时间为25.373 min,人参皂苷Rg1的相对分子质量为800.492 1,其多级质谱显示具有/441.369 4、423.359 0、405.347 9的特征碎片离子,人参皂苷Rg1在正离子模式[M+H]+下/801.343 1裂解过程中,首先失去1分子葡萄糖后产生/621.432 9 [C36H60O8]+,继而裂解失去1分子水产生603.416 4 [C36H58O7]+,该离子进一步裂解失去1分子水产生/559.380 1 [C36H56O6]+,同时,/621.432 9 [C36H60O8]+失去1分子葡萄糖产生/441.369 4 [C30H48O2]+,继而裂解失去1分子水产生/423.359 0 [C30H46O6]+,该离子进一步裂解失去1分子水产生/405.347 9 [C30H44]+,故鉴定为人参皂苷Rg1,其结构解析过程见图2。
3.1.2 毛蕊花糖苷 在ESI−模式下,保留时间为14.30 min,准分子离子峰为/623.196 6 [M-H]−,该准分子离子在进一步的MS/MS裂解过程中,在芳烃与葡萄糖间的碳氧键断裂产生/461.164 8 [C20H29O12]−和/161.024 1 [C9H5O3]−,/161.024 1 [C9H5O3]−进一步裂解产生/133.027 6 [C8H5O2]−,故鉴定为毛蕊花糖苷,其结构解析过程见图3。
3.1.3 茯苓酸 在ESI+模式下,保留时间为28.222 min,准分子离子峰为/529.348 9 [M+H]+,该离子的多级质谱显示具有/469.324 1、451.316 0、433.312 1的碎片离子。该准分子离子裂解失去1个羧甲基产生/469.324 1 [C31H49O3]+,进一步失去1分子水产生/451.316 0 [C31H47O2]+,同时准分子离子/529.348 9 [M+H]+失去C7H12的取代基产生/433.312 1 [C26H41O5]+,故鉴定为茯苓酸,其结构解析过程见图4。

图2 人参皂苷Rg1结构解析过程

图3 毛蕊花糖苷结构解析过程
3.1.4 黄芪紫檀烷苷 在ESI+模式下,保留时间为19.60 min,/为482.197 3。该基峰离子/482.197 3 [M+NH4]+比较容易失去1分子葡萄糖产生/303.120 1 [C17H19O5]+离子,继而失去黄烷基的母核产生/167.070 0 [C9H11O3]+,进一步裂解产生/123.043 5 [C7H7O2]+,故鉴定为黄芪紫檀烷苷,其结构解析过程见图5。
3.2 挥发性成分
按“2.1.2”项方法制备供试品溶液,在“2.2.2”项分析条件进样分析,得到参芪降糖颗粒中挥发性成分的总离子流图(图6)。所得数据经美国国家标准与技术研究所数据库(National Institute of Standards and Technology,NIST2014)质谱数据库检索匹配,采用峰面积归一化法计算相对含量(表2)。参芪降糖颗粒挥发油中共定性出86种化学成分,占已分离总组分相对含量的80.7%。从表2中可看出,参芪降糖颗粒中主要挥发性成分为酮类(9种,27.31%)、烃类(34种,21.2%)、醇类(15种,21.8%)、醛类(17种,5.49%)、酯类(5种,3.02%)、脂肪酸类(3种,0.89%)、酚类(2种,0.86%)、杂环类(1种,0.13%)等,其中含量较高的成分为长叶松香芹酮(19.88%)、衣兰烯醇(7.83%)、γ-杜松烯(0.85%)等来源于五味子,橙花叔醇(2.33%)来源于人参、茯苓,α-毕橙茄醇(2.1%)来源于人参,α-紫罗酮(1.11%)来源于地黄,亚油酸乙酯(1.02%)来源于人参、泽泻,花侧柏烯(0.85%)来源于人参、五味子,棕榈酸乙酯(1.16%)、棕榈酸(0.74%)来源于茯苓、麦冬、泽泻。

图4 茯苓酸结构解析过程

图5 黄芪紫檀烷苷结构解析过程

图6 参芪降糖颗粒中挥发性成分的总离子流图
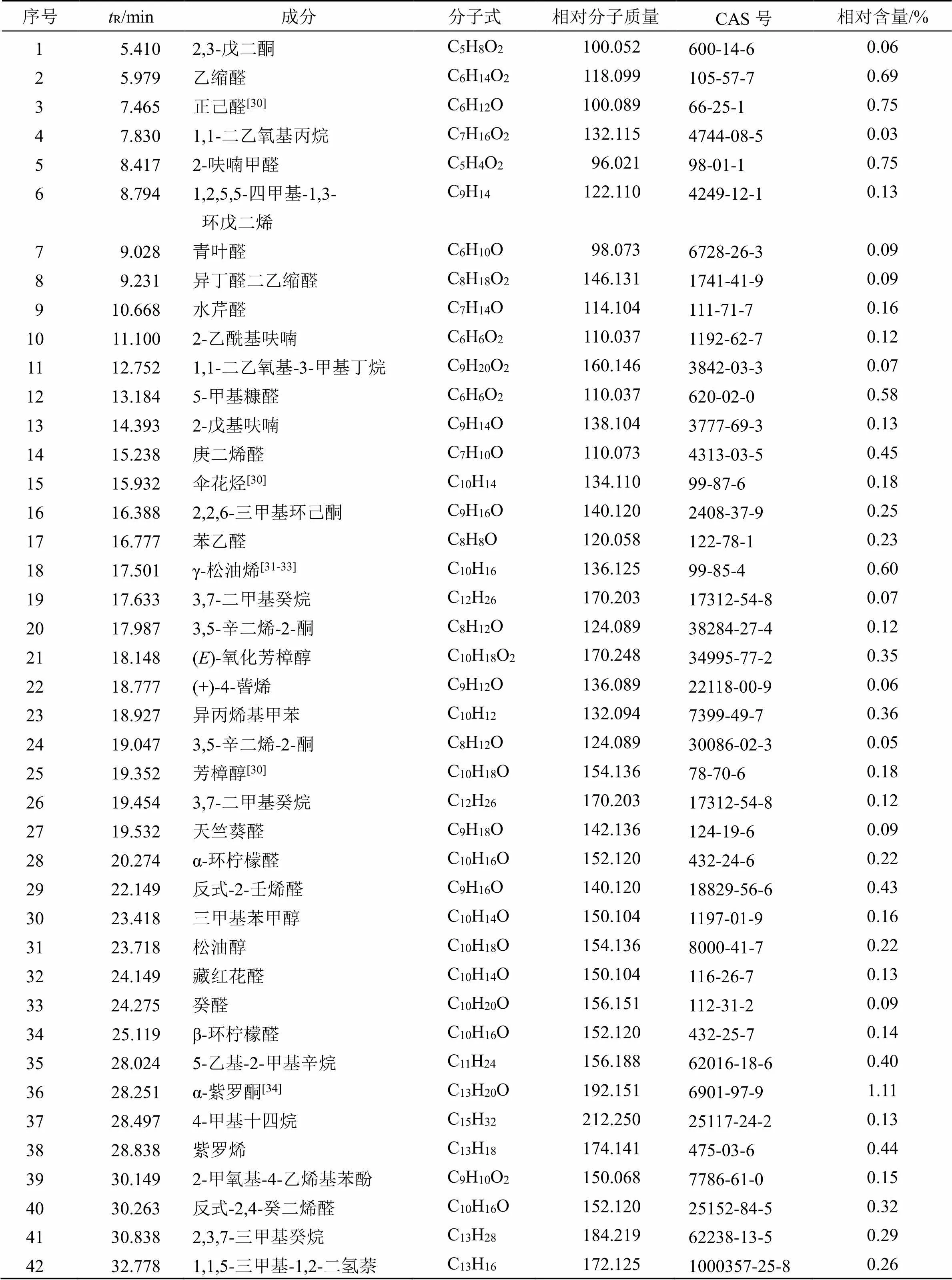
表2 参芪降糖颗粒中挥发性成分分析结果

续表2
4 讨论
参芪降糖颗粒是由人参(茎叶)皂苷、黄芪等11味中药按照“君臣佐使”配伍而成的复方制剂。方中人参、黄芪为君药,益气养阴,生津止渴。地黄、麦冬、天花粉为臣药,清热育阴,生津润燥,与人参、黄芪相配伍,不温不燥,益气养阴、清热润燥而止渴。枸杞子、五味子、覆盆子共为佐药,封固肾关,不使精微下流,与君臣相协同,补肾摄精,肝肾两益。山药、茯苓、泽泻为使药,健脾养胃,固肾渗湿。君臣佐使,相互配合,共成气阴两补、肺脾肝肾同治之方。本研究利用UPLC-Q/TOF MS技术对参芪降糖颗粒中的非挥发性化学成分进行研究,共鉴定出132种化合物,主要包括皂苷类、黄酮类、木脂素类等。与张慧等[2]采用UPLC-Q-TOF MS/MS法分析参芪降糖颗粒的化学成分相比较,在其基础上,所鉴定的化学成分数量更多,进一步丰富了参芪降糖颗粒的物质基础研究。研究发现人参中的人参皂苷Rb1可增加胰岛素敏感性,改善胰岛素抵抗,同时可通过上调葡萄糖转运体的表达,促进葡萄糖的消耗,调节糖代谢紊乱[37-38]。人参皂苷Rg1可通过降低炎症因子的表达,抑制炎症反应以延缓糖尿病肾病的进展[39]。人参皂苷Re也被证实可以改善糖尿病症状,降低糖尿病大鼠的血糖水平[40]。黄芪中的黄芪甲苷通过抑制肝葡萄糖原磷酸化酶(GP)和葡萄糖-6-磷酸酶(G-6-Pase)活性,调节血糖水平[41]。另有研究发现黄芪甲苷能够降低模型小鼠的血清总胆固醇(total cholesterol,TC)和甘油三酯(triglyceride,TG)水平,调节体内瘦素(leptin)敏感性和产热网络系统[42]。黄芪总黄酮及黄芪多糖能够清除自由基发挥抗氧化作用,且清除能力与浓度有明显的依赖关系[43]。泽泻中的泽泻醇B 23-乙酸酯和泽泻倍半萜成分能够抑制巨噬细胞RAW264.7在γ-干扰素和脂多糖诱导下合成NO的活性,通过抑制一氧化氮合酶(诱导酶)(inducible nitric oxide synthase,iNOS)mRNA的表达发挥作用的,进而发挥抗炎作用[44]。五味子中的五味子乙素通过清除自由基和抗脂质过氧化而发挥抗氧化作用[45-46]。地黄中的梓醇能降低链脲佐菌素诱导的糖尿病大鼠血糖,并呈剂量依赖性,其作用机制是通过促进β-内啡肽的释放,提高葡萄糖转运率,抑制糖异生[47]。以上研究结果表明参芪降糖颗粒可能通过调控胰岛素抵抗、氧化应激、炎症反应等来发挥治疗糖脂代谢紊乱性疾病的作用。
采用GC-MS技术鉴定出参芪降糖颗粒中86个挥发性成分,包括烃类、醇类、醛类、酚酸类、木脂素、脂肪酸类等。研究发现,长叶松香芹酮、β-雪松烯、花侧柏烯、γ-杜松烯、衣兰烯醇、去氢白菖烯等挥发性成分来自五味子[31-33],五味子挥发油具有保肝降酶、调血脂的作用[48]。另有研究表明参芪降糖颗粒挥发性成分中的脂肪酸类和酯类成分,也可能是其药效成分。亚油酸和α-亚麻酸属于多不饱和脂肪酸的n-6(ω-6)和n-3系列,是必需脂肪酸,它们大部分是从饮食中获得,不在人体内合成,必需脂肪酸依赖于双键所发挥的抗氧化活性调节低密度脂蛋白代谢,维持体内脂质平衡,改善血管内皮功能,并有助于降低血压,改善血小板敏感性和血清三酰甘油水平[49-52]。棕榈酸对糖尿病和心脑血管疾病等具有生理调节作用,已有研究表明棕榈酸可以缓解多种代谢疾病如肥胖、高血脂、高血糖等[53-54]。亚油酸乙酯具有降低血清胆固醇和低密度脂蛋白的作用,主要用于预防和治疗动脉粥样硬化、心绞痛等心血管疾病[55]。以上研究结果表明参芪降糖颗粒中的挥发性成分,也是其治疗糖脂代谢紊乱性疾病的关键药效成分,且这些药效成分可能通过作用于脂肪酸代谢通路来发挥降糖调脂作用。
参芪降糖颗粒作为一种复方制剂,其化学成分非常复杂,在体内以何种成分、何种形式发挥药物作用以及作用机制如何尚不明确。近年来血清药物化学和肠道菌群在阐明中药药效物质基础及探讨其药理作用机制的研究中得到广泛的应用。朱宝玉等[56]发现人参皂苷Rb1、Re、Rg2及三七皂苷Fe、毛蕊异黄酮苷、芒柄花素等成分为血中移行成分,研究表明此类成分能够增加胰岛素敏感性,改善胰岛素抵抗,降低血糖水平[37-40]。窦志华等[57]研究发现五味子醇甲、五味子醇乙、五味子酯乙、五味子甲素、戈米辛N、五味子乙素等是五味子的血中药源性成分。另有研究表明,许多中药疗效的发挥与人体肠道微环境的改变有密切关系,或是中药可直接调整肠道菌群结构进而影响健康,亦或肠道菌群影响口服中药在体内的吸收、代谢、转化等而改变中药疗效的发挥。体外实验表明枸杞子、地黄、黄芪等补益类中药对双歧杆菌、嗜酸乳杆菌具有促进作用,从而改善肠道菌群失调[58]。近年来研究发现糖尿病的发生可能与肠道菌群失调有关,如皂苷类成分一般需要经过肠道菌代谢转化为苷元发挥降血糖、降血脂等药理活性。陈新梅[59]研究发现人参皂苷Rg1在大鼠肠内菌所分泌的水解皂苷糖基的酶类如β-葡萄糖苷酶作用下,0~12 h内的代谢产物为一对同分异构体人参皂苷Rh1及人参皂苷F1,12~24 h内的代谢产物为苷元Rpt;代谢产物的极性小于人参皂苷Rg1。沈岚等[60]研究发现麦冬皂苷可被大鼠肠内菌群代谢为薯蓣皂苷元入血。
综上所述,参芪降糖颗粒的分析鉴定结果,可为进一步研究不同化学成分的药理作用机制以及活性成分间的相互作用奠定基础。
5 结论
本研究建立的UPLC-Q/TOF MS和GC-MS分析方法较为全面地表征了参芪降糖颗粒的化学成分,为参芪降糖颗粒的二次开发、组方配伍、药理机制等提供了较好的研究基础。但本研究分析主要集中于化学成分的鉴定分析上,未开展入血成分、药效物质基础研究等。故今后应借助这一分析技术进一步完善参芪降糖颗粒的药效物质基础研究,同时,结合血清药物化学、网络药理学、代谢组学以及宏基因组学等技进一步阐明参芪降糖颗粒改善糖脂代谢紊乱性疾病的作用机制。
利益冲突 所有作者均声明不存在利益冲突
[1] 张蕾, 王雷雷, 黎明东, 等. 参芪降糖颗粒辅助治疗气阴两虚型2型糖尿病临床研究 [J]. 新中医, 2019, 51(4): 166-168.
[2] 张慧, 张晓静, 姜慧洁, 等. UPLC-Q-TOF MS/MS法分析参芪降糖颗粒化学成分 [J]. 中成药, 2017, 39(10): 2101-2108.
[3] Xia Y Y, Liu F L, Feng F,. Characterization, quantitation and similarity evaluation offrom different regions in China by HPLC-Q-TQF-MS and chemometrics [J]., 2017, 62: 134-142.
[4] Zhai W Y, Liu J H, Liu Q,. Rapid identification and global characterization of multiple constituents from the essential oil ofbased on GC-MS [J]., 2017, 40(12): 2671-2681.
[5] 李莎莎. 真武汤治疗肾纤维化大鼠代谢组学研究 [D]. 广州: 广州中医药大学, 2014.
[6] Inbaraj B S, Lu H, Hung C F,. Determination of carotenoids and their esters in fruits ofLinnaeus by HPLC-DAD-APCI-MS [J]., 2008, 47(4/5): 812-818.
[7] Qi L W, Cao J, Li P,. Qualitative and quantitative analysis ofproducts by fast high-performance liquid chromatography-diode array detection coupled with time-of-flight mass spectrometry through dynamic adjustment of fragmentor voltage [J]., 2008, 1203(1): 27-35.
[8] Cherouana S, Touil A, Rhouati S. Two flavonoid glycosides from[J]., 2013, 49(5): 930-931.
[9] 李慧, 黄帅, 单连海, 等. 茯苓皮中三萜酸类成分的研究 [J]. 华西药学杂志, 2016, 31(1): 6-10.
[10] Qi L W, Wang H Y, Zhang H,. Diagnostic ion filtering to characterize ginseng saponins by rapid liquid chromatography with time-of-flight mass spectrometry [J]., 2012, 1230: 93-99.
[11] 肖飞艳, 冯育林, 杨世林, 等. 泽泻化学成分的研究进展 [J]. 中药新药与临床药理, 2009, 20(5): 491-495.
[12] 邹耀洪. 枸杞叶的黄酮类化学成分 [J]. 分析测试学报, 2002, 21(1): 76-78.
[13] Akihisa T, Uchiyama E, Kikuchi T,. Anti-tumor- promoting effects of 25-methoxyporicoic acid A and other triterpene acids from[J]., 2009, 72(10): 1786-1792.
[14] Ma Q J, Han L, Bi X X,. Structures and biological activities of the triterpenoids and sesquiterpenoids from[J]., 2016, 131: 150-157.
[15] 邹叶廷, 徐金娣, 龙芳, 等. 整合UPLC-QTOF-MS/MS全扫描和模拟MRM方法综合评价茯苓乙醇提取物与后续乙酸乙酯萃取物三萜酸类组分化学一致性 [J]. 药学学报, 2019, 54(1): 130-137.
[16] Yoshikawa M, Murakami T, Ikebata A,. Absolute stereostructures of alismalactone 23-acetate and alismaketone-A 23-acetate, new seco-protostane and protostane-type triterpenes with vasorelaxant effects from Chinese[J]., 1997, 45(4): 756-758.
[17] 郑艳, 杨秀伟. 中药材规范化种植茯苓化学成分研究 [J]. 中国现代中药, 2017, 19(1): 44-50.
[18] Nakajima Y, Satoh Y, Katsumata (nee Ohtsuka) M,. Terpenoids ofrhizome and the crude drug[J]., 1994, 36(1): 119-127.
[19] Nukaya H, Yamashiro H, Fukazawa H,. Isolation of inhibitors of TPA-induced mouse ear edema from Hoelen,[J].(Tokyo), 1996, 44(4): 847-849.
[20] 倪付勇, 谢雪, 温建辉, 等. 茯苓非多糖类化学成分的抗补体活性 [J]. 中草药, 2019, 50(11): 2529-2533.
[21] Hikino H, Yoshizawa M, Suzuki Y,. Isolation and hypoglycemic activity of trichosans A, B, C, D, and E: Glycans ofroots [J]., 1989, 55(4): 349-350.
[22] McAnuff M A, Omoruyi F O, Morrison E Y S T A,. Plasma and liver lipid distributions in streptozotocin- induced diabetic rats fed sapogenin extract of the Jamaican bitter yam () [J]., 2002, 22(12): 1427-1434.
[23] 陆兔林, 殷放宙, 李林, 等. RP-HPLC法测定五味子药材中五味子醇甲和五味子乙素的含量 [J]. 中成药, 2006, 28(8): 1210-1212.
[24] Tai T, Shingu T, Kikuchi T,. Triterpenes from the surface layer of[J]., 1995, 39(5): 1165-1169.
[25] Liu H, Lai H, Jia X,. Comprehensive chemical analysis ofby HPLC-DAD-MS combined with chemometrics [J]., 2013, 20(12): 1135-1143.
[26] Lee D K, Yoon M H, Kang Y P,. Comparison of primary and secondary metabolites for suitability to discriminate the origins ofby GC/MS and LC/MS [J]., 2013, 141(4): 3931-3937.
[27] Zheng Y, Yang X W. Poriacosones A and B: Two new lanostane triterpenoids from[J]., 2008, 10(7/8): 645-651.
[28] Yoshikawa M, Tomohiro N, Murakami T,. Studies on alismatisrhizoma. III. stereostructures of new protostane-type triterpenes, alisols H, I, J-23-acetate, K-23-acetate, L-23-acetate, M-23-acetate, and N-23- acetate, from the dried rhizome of[J]., 1999, 47(4): 524-528.
[29] Yang C H, Zhang S F, Liu W Y,. Two new triterpenes from the surface layer of[J]., 2009, 92(4): 660-667.
[30] 张洁, 刘建华, 武晨, 等. 茯苓皮的挥发性成分 [J]. 中国实验方剂学杂志, 2014, 20(18): 66-69.
[31] Chen X Q, Zhang Y, Zu Y G,. Chemical composition and antioxidant activity of the essential oil offruits [J]., 2012, 26(9): 842-849.
[32] Liu C J, Zhang S Q, Zhang J S,. Chemical composition and antioxidant activity of essential oil from berries of(Turcz.) Baill [J]., 2012, 26(23): 2199-2203.
[33] Wang L H, Chen Y S, Song Y T,. GC-MS of volatile components ofobtained by supercritical fluid and conventional extraction [J]., 2008, 31(18): 3238-3245.
[34] 翟彦峰, 邢煜军, 王先友, 等. 地黄叶挥发油GC-MS分析 [J]. 河南大学学报: 医学版, 2010, 29(2): 113-115.
[35] 张成江, 娄方明, 谢增琨. 不同方法提取的枸杞子挥发油化学成分的研究 [J]. 遵义医学院学报, 2011, 34(2): 117-122.
[36] 佟鹤芳, 薛健, 童燕玲. GC-MS法测定人参和西洋参挥发性成分 [J]. 中医药学报, 2013, 41(1): 49-54.
[37] 尚文斌, 郭超, 赵娟, 等. 人参皂苷Rb1通过上调脂肪组织葡萄糖转运体促进葡萄糖消耗 [J]. 中国中药杂志, 2014, 39(22): 4448-4452.
[38] 尚文斌, 郭超, 于希忠, 等. 人参皂苷Rb1与小檗碱配伍对糖尿病小鼠糖脂代谢的影响 [J]. 时珍国医国药, 2015, 26(3): 518-521.
[39] 李赫健, 李虹, 金玉, 等. 人参皂苷Rg1、Rb1的药效及作用机制研究进展 [J]. 武汉大学学报: 理学版, 2019, 65(4): 323-332.
[40] 高钧, 卢守四, 张蕾, 等. 人参皂苷Re促进胰高血糖素样肽-1分泌的研究 [J]. 中国药物与临床, 2011, 11(12): 1383-1385.
[41] Lv L, Wu S Y, Wang G F,. Effect of astragaloside IV on hepatic glucose-regulating enzymes in diabetic mice induced by a high-fat diet and streptozotocin [J]., 2010, 24(2): 219-224.
[42] Wu H, Gao Y, Shi H L,. Astragaloside IV improves lipid metabolism in obese mice by alleviation of leptin resistance and regulation of thermogenic network [J]., 2016, 6: 30190.
[43] 肖啸, 张开伟, 沈学文, 等. 黄芪多糖对犬免疫指标的影响 [J]. 山东畜牧兽医, 2009, 30(11): 3-5.
[44] Kim N Y, Kang T H, Pae H O,.inducible nitric oxide synthesis inhibitors from[J]., 1999, 22(10): 1147-1149.
[45] 牛莉萍. 北五味子挥发油生物活性的研究及其诱导肝癌HepG2细胞凋亡机制的初步探讨 [D]. 武汉: 华中师范大学, 2011.
[46] 闫荟羽, 周微, 曲晓宇, 等. 五味子乙素的药理研究进展 [J]. 中国生化药物杂志, 2014, 34(2): 153-156.
[47] Shieh J P, Cheng K C, Chung H H,. Plasma glucose lowering mechanisms of catalpol, an active principle from roots of, in streptozotocin-induced diabetic rats [J]., 2011, 59(8): 3747-3753.
[48] Jeong J W, Kim J W, Ku S K,. Essential oils purified frominhibits tumor necrosis factor-α-induced matrix metalloproteinase-9 activation and migration of human aortic smooth muscle cells [J]., 2015, 15: 7.
[49] Poudyal H, Panchal S K, Diwan V,.-3 fatty acids and metabolic syndrome: Effects and emerging mechanisms of action [J]., 2011, 50(4): 372-387.
[50] Zhang J, Wang O, Guo Y,. Effect of increasing doses of linoleic and α-linolenic acids on high-fructose and high-fat diet induced metabolic syndrome in rats [J]., 2016, 64(4): 762-772.
[51] Harris W S. The-6/-3 ratio and cardiovascular disease risk: Uses and abuses [J]., 2006, 8(6): 453-459.
[52] Deckelbaum R J. n-6 and n-3 Fatty acids and atherosclerosis: Ratios or amounts? [J]., 2010, 30(12): 2325-2326.
[53] Cao H M, Gerhold K, Mayers J R,. Identification of a lipokine, a lipid hormone linking adipose tissue to systemic metabolism [J]., 2008, 134(6): 933-944.
[54] Bergman B C, Howard D, Schauer I E,. The importance of palmitoleic acid to adipocyte insulin resistance and whole-body insulin sensitivity in type 1 diabetes [J]., 2013, 98(1): E40-E50.
[55] 刘国栋, 辛兵, 黄栋, 等. 亚油酸乙酯抑制钛颗粒诱导的炎症反应及其作用机制 [J]. 中国组织工程研究, 2016, 20(52): 7836-7843.
[56] 朱宝玉, 黄海英, 刘雅敏, 等. 人参、黄芪药对血中移行成分质谱分析 [J]. 中医学报, 2018, 33(12): 2401-2405.
[57] 窦志华, 罗琳, 安莉萍, 等. 五味子血清药化学初步研究 [J]. 中药材, 2013, 36(7): 1146-1148.
[58] 李平兰, 时向东, 吕燕妮, 等. 常见中草药对两种肠道有益菌体外生长的影响 [J]. 中国农业大学学报, 2003, 8(5): 33-36.
[59] 陈新梅. 大鼠肠道酶和菌群对人参皂苷Rg1的代谢转化研究 [J]. 中国实验方剂学杂志, 2011, 17(11): 210-212.
[60] 沈岚, 徐德生, 冯怡, 等. 大鼠肠内菌对麦冬皂苷D'代谢的研究 [J]. 中国中药杂志, 2005, 30(8): 618-620.
Analysis of chemical constituents of Shenqi Jiangtang Granule based on UPLC-Q/TOF MS and GC-MS
WANG Qian1,4, LI Bing-bing2, HUANG Wen-jing1,4, CHENG Guo-liang2, WANG Le-qi1,4, XIAO Xue1,4, YAN Shi-kai1,3,4
1. Institute of Chinese Medicine Sciences, Guangdong Pharmaceutical University, Guangzhou 510006, China 2. State Key Laboratory of Generic Manufacture Technology of Chinese Traditional Medicine, Linyi 276000, China 3. School of Pharmacy, Shanghai Jiao Tong University, Shanghai 200240, China 4. Guangdong Metabolic Disease Research Center of Integrated Chinese and Western Medicine, Guangzhou 510006, China
To study the chemical constituents of Shenqi Jiangtang Granule (参芪降糖颗粒) based on UPLC-Q/TOF MS and GC-MS.The methanol extract of Shenqi Jiangtang Granule was separated on Zorbax RRHD SB C18column (100 mm×2.1 mm, 1.7 μm), and the gradient elution of acetonitrile-water was used as mobile phase at a flow rate of 0.3 mL/min. The chromatographic effluent was detected by mass spectrometry under the positive and negative ion modes of the ESI source. According to the cleavage fragments of MS/MS and literaturea, the main chromatographic peaks were identified by Peakview software. Composition analysis of volatile oil from Shenqi Jiangtang Granule was performed by HP-5MS column (60 m × 250 μm × 0.25 μm), with programmed temperature and EI ion source, and the mass scanning range was/25—500. GC-MS analysis was performed using the enhanced NIST 2014 standard spectrum library for rapid identification of volatile components in Shenqi Jiangtang Granule.A total of 132 non-volatile components and 86 volatile components were identified in Shenqi Jiangtang Granule.This study provides a rapid and effective method for the qualitative analysis of the chemical components of Shenqi Jiangtang Granulecomprehensively and systematically, which lays the foundation for the research on the material basis of pharmacodynamics, secondary development, quality control, and pharmacological mechanism.
ShenqiJiangtang Granule; chemical constituents; UPLC-Q/TOF MS; GC-MS; qualitative analysis
R284.1
A
0253 - 2670(2021)06 - 1568 - 14
10.7501/j.issn.0253-2670.2021.06.004
2020-11-08
国家重点研发计划项目(2018YFC1704200);国家重点研发计划项目(2018YFC1704205)
王 倩(1990—),女,硕士研究生,从事中药分析与质量评价研究。E-mail: 1464887702@qq.com
严诗楷,男,副研究员,从事中医药系统生物学研究。E-mail: shkyan@sjtu.edu.cn
李冰冰,男,博士,从事中药药效物质基础与作用机制研究。E-mail: libingt@126.com
[责任编辑 王文倩]
