抗谷氨酸脱羧酶抗体相关脑炎合并自身免疫性多内分泌腺综合征II型1例
2021-03-17王晓邢媛薄倩澜孙秀巧王志伟田书娟
王晓 邢媛 薄倩澜 孙秀巧王志伟 田书娟
在神经元胞内抗体中,谷氨酸脱羧酶(glutamate decarboxylase,GAD)65是一种非肿瘤性的细胞内抗原,对中枢神经系统具有致病性。抗GAD65-Ab相关自身免疫性脑炎(autoimmune encephalitis,AE)常见临床症状为局灶性发作癫痫、记忆障碍和自主神经功能障碍等[1]。抗GAD65-Ab相关脑炎在临床工作中相对少见,并常与1型糖尿病、甲状腺炎等自身免疫性疾病相关,值得引起神经科医生的重视。本文报告1例首诊于精神卫生科的抗GAD65-Ab相关脑炎合并自身免疫性多内分泌腺综合征。
1 临床资料
患者,女,43岁,教师,因“近记忆力下降1个月”于2019年6月2日入院。患者于1个月前无明显诱因出现近记忆力下降,伴少言、畏寒及间断周身发麻、发紧,发作时起“鸡皮疙瘩”,持续十余分钟可缓解,无言语不利,无肢体麻木无力,无头痛、发热。15 d前就诊于我院精神卫生科,诊断为“焦虑抑郁状态”,予以盐酸度洛西汀肠溶片和奥拉西坦胶囊治疗,上述症状未见改善。12 d前患者出现抽搐发作,表现为双眼向上凝视、口吐白沫、四肢屈曲,伴意识不清,持续约1 min好转,醒后不能回忆发作情况。遂再次就诊于我院精神卫生科,考虑为“抗精神病药诱发的癫痫”,故停度洛西汀,予柴胡安心胶囊口服,未再出现抽搐发作,但近记忆力下降及间断周身发紧仍未见改善。后就诊我院神经内科门诊,以“边缘性脑炎”收入我院。
患者既往2个月前确诊为“1型糖尿病”(抗GAD-Ab阳性),应用胰岛素治疗,血糖控制不佳。发现“桥本氏甲状腺炎”2个月。否认高血压、冠心病、脑血管病、脑炎等病史。子宫肌瘤行子宫切除术后2年。
家族史:父母均有糖尿病病史。
专科查体:神清语利,计算力下降,近记忆力差,双侧瞳孔正大等圆,直径约3 mm,对光反射灵敏,双眼各方向活动自如,无眼震,示齿口角不偏,伸舌居中,四肢肌张力正常,肌力5级,共济运动及感觉系统检查未见异常,四肢腱反射正常,双侧Babinski征阴性,脑膜刺激征阴性。
辅助检查:生化全项,血糖17.00 mmol/L,总胆固醇6.21 mmol/L,低密度脂蛋白4.09 mmol/L。糖化血红蛋白A1c为9.3%。血弓风巨单全项,Ⅱ型单纯疱疹病毒IgG抗体31.32 AU/mL,风疹病毒IgG抗体2.41 AU/mL。甲功七项,抗甲状腺过氧化物酶抗体(A-TPO)339 IU/mL。腰穿脑脊液检查,脑脊液无色透明,压力为115 mmH2O,脑脊液白细胞计数5×106/L。脑脊液糖6.29 mmol/L。脑脊液蛋白402.8 mg/L,抗酸染色+革兰染色+墨汁染色未见明显异常。脑脊液细胞学,无色透明,未见吞噬细胞、浆细胞及转化性淋巴细胞。北京协和医院神经免疫实验室(间接免疫荧光检测)AE相关抗体检测结果,脑脊液抗GAD65-Ab阳性(1:100),血抗GAD65-Ab阳性(1:100)。头颅MRI+DWI,双侧海马旁回、右侧岛叶及颞部异常信号(图1)。增强头颅MRI,强化未见明显异常。甲状腺彩超,甲状腺实质回声欠均匀。腔内彩超,子宫切除术后,宫颈纳囊。动态脑电图,全导可见大量散在性6~7 Hz中波幅慢波。汉密尔顿抑郁量表(Hamilton depression scale,HAMD)15分,汉密尔顿焦虑量表(Hamilton anxiety scale,HAMA)6分,蒙特利尔认知评估量表(Montreal cognitive assessment,MoCA)22分,简易智力状态检查量表(mini-mental state examination,MMSE)26分(回忆力0分)。事件相关电位P300潜伏期:延长。肺CT、心电图、动态心电图未见明显异常。血常规、风湿四项、贫血三项、肿瘤五项、凝血八项、血沉、脑脊液和血清副肿瘤及其他自身免疫性脑炎抗体检测(NMDAr、Caspr2、AMPA1-2、LGI1、GABAb、CV2/CRMP5、PNMA2、Ri、Yo、Hu、Amphiphys)均阴性。
诊疗过程:诊断为①抗GAD65-Ab相关脑炎,②1型糖尿病,③桥本氏甲状腺炎。给予静注人免疫球蛋白(IVIG,每天0.4 g/kg)5 d,联合甲强龙(1 g/d)冲击治疗3 d。患者未再有癫痫发作,间断出汗及周身发紧发麻等自主神经功能症状明显减少,但近记忆力较前改善不明显。继续给予泼尼松龙60 mg/d(每2周减5 mg),3个月复查记忆力仍较差,间断有自主神经功能症状,启动二线治疗药物,给予吗替麦考酚酯1 g/d口服治疗。半年后随访,患者近记忆力较前明显改善,复查MOCA 25分(改善率13.6%),MMSE 28分(回忆力2分,总分改善率7.7%)。18个月后随访复查颅脑MRI:双侧海马、内侧颞叶异常信号,范围稍减小,原右侧岛叶异常信号基本消失(图1)。
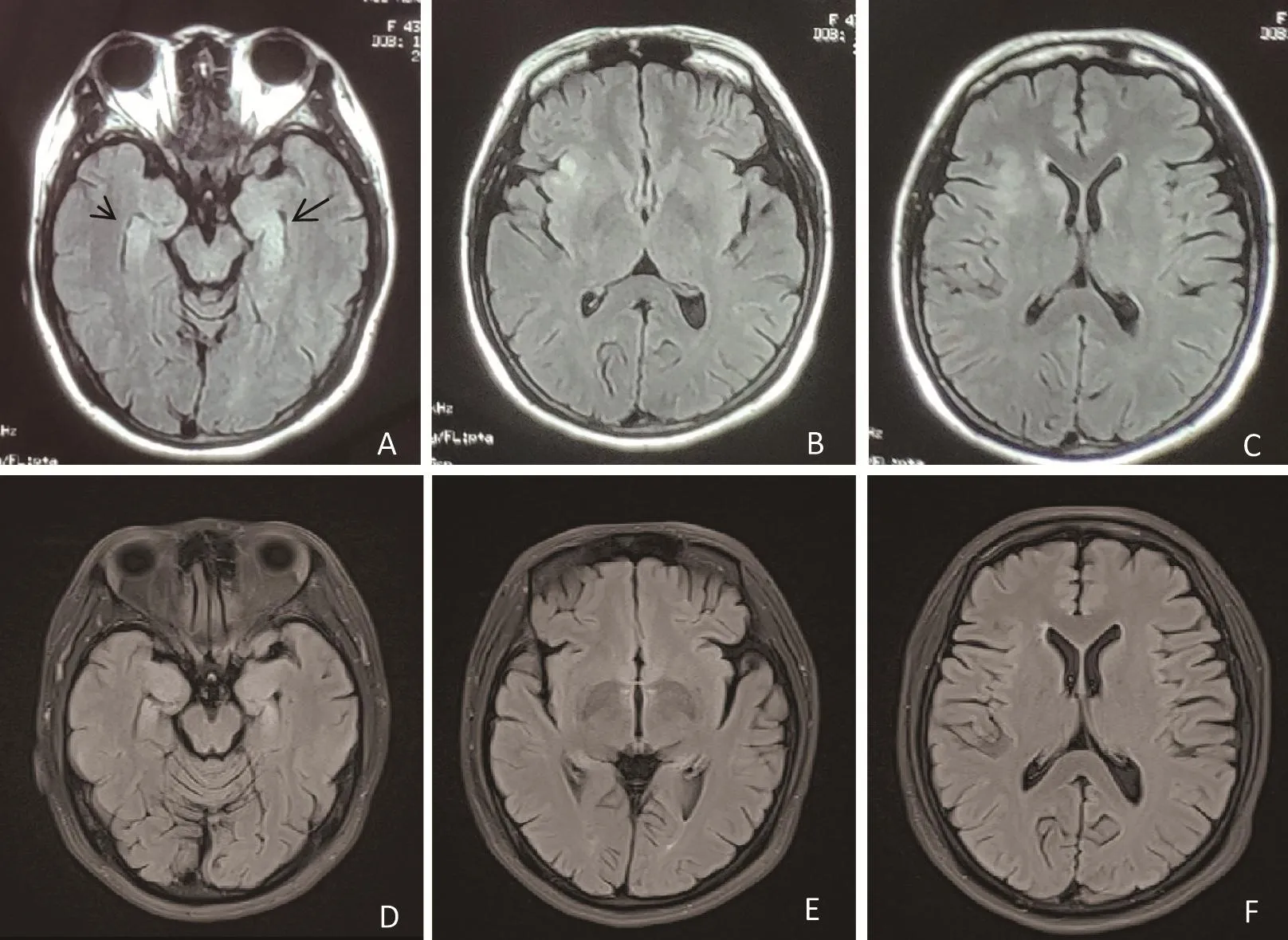
图1 颅脑磁共振液体衰减反转恢复序列 A~C,2019年6月双侧海马,右侧岛叶异常信号。D~F,2021年1月双侧海马异常信号范围缩小,右侧岛叶异常信号消失。
2 讨论
抗GAD65-Ab与多种疾病关联,包括1型糖尿病、AE、僵人综合征(stiff-person syndrome,SPS)、小脑性共济失调和癫痫等[2]。MITOMA等[3]对62例血清抗GAD65-Ab阳性的患者进行研究,发现有41例患者存在多种神经系统异常表现,包括共济失调、眼球运动障碍、癫痫、SPS、锥体外系症状以及脊髓病变等,其中1/3的患者合并1型糖尿病,53%患者的甲状腺抗体检测呈阳性。上述研究提示抗GAD65-Ab可作用于神经系统不同部位,临床表现为单一症状或多种症状并存,且常常同时合并其他自身免疫系统疾病。
本例报告患者为中年女性,亚急性起病,近记忆力损害为主,同时伴有自主神经功能受损,颅脑MRI提示双侧海马受累,脑脊液及血抗GAD65-Ab均为阳性,参照2017年《中国自身免疫性脑炎诊治专家共识》[4],诊断为抗GAD65-Ab相关脑炎。
抗GAD65-Ab不仅仅存在于AE中,还可见于SPS、小脑性共济失调(cerebellar ataxia,CA)、自身免疫性多内分泌腺综合征(autoimmune polyglandular syndrome,APS)及 1型糖尿病等疾病。其中SPS是抗GAD-Ab相关脑炎最常见的综合征,表现为听觉、触觉、视觉诱发的发作性痛性痉挛、中轴肌和四肢肌进行性肌强直及焦虑抑郁表现或恐惧症;CA是其第二常见综合征,最常见的症状包括步态共济失调、构音障碍和眼球震颤[5]。本文患者无上述相关临床表现,故不支持SPS及CA诊断。另外GAD65-Ab还存在于胰岛β细胞中,可导致自身免疫性糖尿病(1型糖尿病),约80%的1型糖尿病患者血清抗GAD65-Ab阳性,但抗体滴度较抗GAD65-Ab阳性的神经系统疾病患者低100倍[6-7]。患者同时还合并有桥本氏甲状腺炎,若病程中表现为Addison病、自身免疫性甲状腺病和1型糖尿病中的至少2种即可诊断为自身免疫性多内分泌腺综合征Ⅱ型(autoimmune polyglandular syndrome type Ⅱ,APS-Ⅱ)[8],本病例存在高滴度抗GAD65-Ab,中枢神经系统损伤临床表现,同时合并1型糖尿病,桥本氏甲状腺炎,故考虑为抗GAD65-Ab相关脑炎合并APS-Ⅱ。
在治疗方面,AE的急性期治疗主要包括一线治疗(激素、IVIG、血浆置换)及二线治疗(环磷酰胺、利妥昔单抗等)[9]。本例患者给予激素联合IVIG治疗有效,未再出现癫痫发作,自主神经功能症状有所改善,但记忆力减退无明显缓解,3个月复诊时无明显改善,遂启动吗替麦考酚酯免疫抑制治疗,半年后复诊患者记忆力减退症状较前改善,且随访至今无复发,提示对于一线治疗效果不满意的患者,及时启动二线治疗可以获得较好的获益。
以往的研究认为,持续的高抗GAD65-Ab滴度往往提示治疗反应差,而对临床治疗有效果的患者,该抗体滴度往往会降低[10-11],抗GAD65-Ab滴度与症状严重程度无关[12]。有研究则认为疗效的评定与临床表现的关联更为密切,故建议使用临床治疗反应和抗体滴度随时间的“相对”趋势来指导治疗[13]。本病例后期未监测抗体滴度,但通过临床治疗反应给予治疗方案的调整,临床症状得到了有效改善,仍建议后期随访进行抗体滴度检测。但是否可将抗体滴度作为指导长期免疫治疗的有效指标,值得谨慎考虑并进一步研究。
总之,对出现记忆力损害、自主神经功能障碍、癫痫或精神症状,尤其是合并1型糖尿病和/或桥本氏甲状腺炎等多内分泌腺综合征或其他自身免疫系统疾病的患者,不论是神经内科或精神科医师都需考虑到抗GAD65-Ab相关脑炎。
