亚低温治疗对脓毒症急性肾损伤小鼠肾功能的影响
2021-03-17莫亚华汤展宏
莫亚华,汤展宏
(广西医科大学,广西 南宁 530021)
脓毒症患者会发生多个器官功能障碍,其死亡率较高。罹患脓毒症是导致急性肾损伤的独立危险因素。据统计,脓毒症所致急性肾损伤患者的数量约占所有急性肾损伤患者数量的一半。亚低温治疗是一种以物理方法将患者的体温降低到预期水平,从而治疗其所患疾病的疗法。本文主要是探讨对脓毒症急性肾损伤小鼠进行亚低温治疗对其肾功能的影响。
1 资料与方法
1.1 一般资料
本次研究开展的时间为2019 年7 月至2020 年6 月。本文的研究对象为48 只雄性昆明小鼠。这些小鼠的体重为(25±3)g。根据随机数表法将这些小鼠分为假手术组、脓毒症模型组和亚低温组。
1.2 方法
将脓毒症模型组小鼠和亚低温组小鼠制成脓毒症急性肾损伤模型,具体的方法是:向小鼠的腹腔内注射0.15 mg/kg浓度为3%的水合氯醛,对其进行麻醉。对小鼠的腹部皮肤进行消毒。沿小鼠腹部的正中线剪开其皮肤,分离皮下组织。将小鼠的盲肠拖出其腹腔。在小鼠盲肠末端2/3 处结扎其盲肠。用18 号针头穿通小鼠盲肠末端的肠壁,挤出部分粪便。将盲肠放回小鼠的腹腔。逐层缝合切口。对小鼠的切口进行消毒,避免粪便污染其切口。对假手术组小鼠进行假手术,具体的方法与建立脓毒症急性肾损伤模型的方基本相同,但不对其盲肠进行结扎和穿孔,在翻动其肠道后即可关闭其腹腔。术后为亚低温组小鼠进行亚低温治疗,方法是:将小鼠放入亚低温治疗仪中。将治疗温度设置为33 ~35℃。持续治疗6 h。然后对小鼠进行体温复苏,复苏时间为1 h,复苏目标为36℃。
1.3 观察指标
建模后12 h,在每组小鼠中选择8 只小鼠,并取出其左侧的肾脏。将小鼠的肾脏保存在-80℃的环境中。然后用酶联免疫吸附法检测三组小鼠肾组织肿瘤坏死因子α(TNF-α)及白细胞介素1β(IL-1β)的水平。建模后24 h,将每组小鼠中未进行肾组织TNF-α 及IL-1β 检测的8 只小鼠摘除眼球取血。用离心机对血样进行离心操作。用二乙酰一肟法检测三组小鼠血清尿素氮(BUN)的水平,用除蛋白苦味酸比色法检测其血清肌酐(Cr)的水平。建模后24 h,取出三组小鼠右侧的肾脏,用浓度为10% 的福尔马林固定。将小鼠的肾脏进行脱水、石蜡包埋、切片及HE染色后,观察其肾组织结构的变化。在高倍镜视野下为每只小鼠随机选取20 个肾小管进行肾损伤评分。若小鼠肾小管的形态正常,记0 分。若小鼠肾小管受损的面积≤25%,记1 分。若小鼠肾小管受损的面积为26%~50%,记2 分。若小鼠肾小管受损的面积为51% ~75%,记3 分。若小鼠肾小管受损的面积为76%~100%,记4 分[1]。
1.4 统计学方法
将本次研究中的数据均采用SPSS 23.0 统计软件进行处理,计量资料用均数± 标准差(± s )表示,计数资料用百分比(%)表示。三组间数值比较用单因素方差分析,两两比较用LSD-t 检验。以P <0.05 为差异具有统计学意义。
2 结果
2.1 建模后12h 三组小鼠肾组织TNF-α 及IL-1β 的水平
建模后12 h,脓毒症模型组小鼠及亚低温组小鼠肾组织TNF-α 及IL-1β 的水平均高于假手术组小鼠,P <0.05;亚低温组小鼠肾组织TNF-α 及IL-1β 的水平均低于脓毒症模型组小鼠,P <0.05。详见表1。
表1 建模后12 h 三组小鼠肾组织TNF-α 及IL-1β 的水平(pg/ml,± s )

表1 建模后12 h 三组小鼠肾组织TNF-α 及IL-1β 的水平(pg/ml,± s )
注:a 与假手术组相比,P <0.05 ;b 与脓毒症模型组相比,P <0.05。
指标 假手术组(n=8)脓毒症模型组(n=8)亚低温组(n=8) F 值 P 值TNF-α 131.45±0.73 244.55±14.93a 205.85 ±12.73ab 205.54 <0.05 IL-1β 91.66±13.81 248.81±67.32a 197.23±43.26ab 23.35 <0.05
2.2 建模后24h 三组小鼠血清BUN 及Cr 的水平
建模后24 h,脓毒症模型组小鼠及亚低温组小鼠血清BUN 及Cr 的水平均高于假手术组小鼠,P <0.05;亚低温组小鼠血清BUN 及Cr 的水平均低于脓毒症模型组小鼠,P <0.05。详见表2。
表2 建模后24 h 三组小鼠血清BUN 及Cr 的水平(μmol/L,± s )
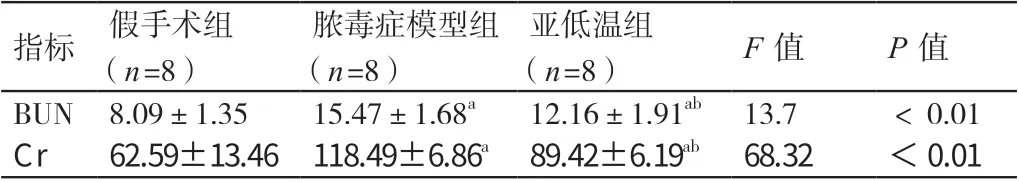
表2 建模后24 h 三组小鼠血清BUN 及Cr 的水平(μmol/L,± s )
注:a 与假手术组相比,P <0.01 ;b 与脓毒症模型组相比,P <0.01。
指标 假手术组(n=8)脓毒症模型组(n=8)亚低温组(n=8) F 值 P 值BUN 8.09±1.35 15.47±1.68a 12.16±1.91ab 13.7 <0.01 Cr 62.59±13.46 118.49±6.86a 89.42±6.19ab 68.32 <0.01
2.3 建模后24h 三组小鼠肾组织结构的变化
假手术组小鼠肾小球、肾小管的结构完整。脓毒症模型组小鼠的肾小球萎缩,肾小球与基底膜分离,部分肾小球肿胀破裂,其肾小管上皮细胞有空泡变性的情况,其肾小管的管腔变窄,肾小管之间有炎症细胞。亚低温组小鼠的肾小球无明显萎缩的情况,其肾小管的包膜完整,管腔未扩张,无明显变性的情况。三组小鼠肾组织结构的变化见图1、图2、图3。
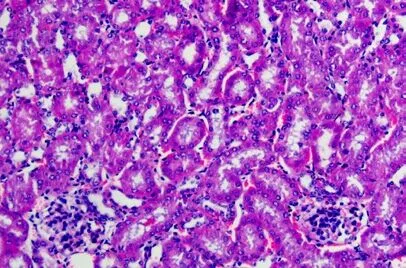
图1 假手术组小鼠肾脏组织结构变化
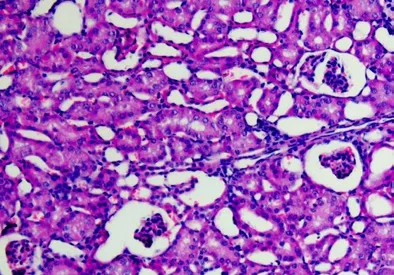
图2 脓毒症模型组小鼠肾脏组织结构变化
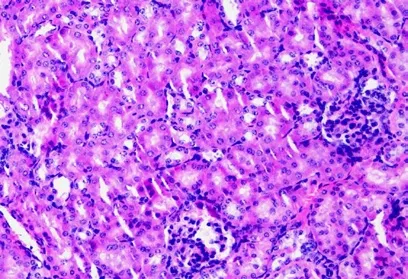
图3 亚低温组小鼠肾脏组织结构变化
2.4 建模后24h 三组小鼠的肾损伤评分
建模后24 h,脓毒症模型组小鼠及亚低温组小鼠的肾损伤评分均高于假手术组小鼠,P <0.05;亚低温组小鼠的肾损伤评分低于脓毒症模型组小鼠,P <0.05。三组小鼠的肾损伤评分见图2。
3 讨论
急性肾损伤是脓毒症患者比较常见的一种并发症。急性肾损伤是导致脓毒症患者死亡率提高的独立危险因素[2]。导致脓毒症急性肾损伤发生和发展的机制包括炎症介质释放、氧化应激反应、线粒体功能障碍、肾小管上皮细胞损伤及缺血再灌注损伤等。
在脓毒症患者发病的早期,革兰阴性菌的脂多糖、革兰阳性菌的脂磷壁酸等组分会进入其循环系统,其体内免疫细胞表面的模式识别受体识别到细菌产物后,会激活免疫反应,促使其体内释放大量的白细胞介素1(IL-1)、TNF-α 及白细胞介素6(IL-6)等促炎症细胞因子,使其体内发生炎症级联“瀑布反应”,病情严重的患者会发生器官功能衰竭[3-4]。肾是炎症细胞因子最易攻击的靶器官之一。脓毒症患者体内大量的细胞因子、趋化因子及补体会释放到其血液中。在血液流经该病患者的肾组织时,这些物质会聚集在其肾小管内,对其肾小管细胞造成破坏[5]。
目前,亚低温疗法可用于治疗脓毒症、难治性癫痫、出血性脑卒中、心脏骤停、缺血缺氧性脑病、脑梗死及颅脑外伤[6-9]。使用亚低温疗法治疗脓毒症的原理包括:1)脓毒症患者体内的多种炎症细胞因子能促进氧自由基、组胺等物质的产生,对其细胞及组织造成不可逆的损伤。对脓毒症患者进行亚低温治疗能减少其体内炎症细胞因子的产生,减轻其体内的氧化应激反应和炎症反应。2)Toll 样受体2(TLR2)信号通路的激活会引起炎症反应。对脓毒症患者进行亚低温治疗可降低其体内TLR2 的表达,减少TLR2 信号通路的激活,改善其氧分压和氧合指数,减轻其器官受到的损伤。3)脓毒症患者体内微生物及其毒素、胞壁产物等会进入其血液中,激活其体内免疫细胞表面的模式识别受体,引起细胞因子级联反应,使其体内的细胞缺血缺氧、代谢紊乱。对脓毒症患者进行亚低温治疗能保持其细胞膜的稳定型,避免其细胞内钙离子过度积累,调节其细胞的能量代谢。
本次研究的结果证实,对脓毒症急性肾损伤小鼠进行亚低温治疗可降低其体内炎症细胞因子的水平,改善其肾功能。
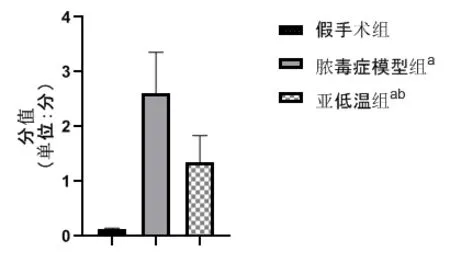
图4 建模后24 h 三组小鼠的肾损伤评分
