儿童髓母细胞瘤脑脊液循环肿瘤DNA检测可行性分析
2021-03-17孙艳玲刘晶晶李苗任思其刘妍张金李舒婷龚小军王圆杜淑旭武万水孙黎明田永吉
孙艳玲 刘晶晶 李苗 任思其 刘妍 张金 李舒婷 龚小军 王圆 杜淑旭 武万水 孙黎明 田永吉
1首都医科大学附属北京世纪坛医院儿科(北京100038);2首都医科大学附属北京天坛医院小儿神经外科(北京100050)
髓母细胞瘤(medulloblastoma,MB)是儿童常见的恶性脑肿瘤,约占所有中枢神经系统肿瘤的20%,目前在手术、全脑全脊髓放疗以及辅助化疗的多模式治疗下,标危组5年生存率可达85%,高危组可达70%,但仍有近30%患者出现复发及进展,而一旦复发或进展,中位生存期仅有1年左右,2年生存率25%,总生存率不超过10%[1-2]。在2016年[3]的中枢神经系统肿瘤分类中对MB 增加了分子分型,然而一旦病情进展或复发,82%呈脑脊膜播散伴或不伴有局部复发,仅25%可获得再次手术或活检获得病理组织[4],亟待寻找一种新的可供选择的分子检测手段用于评估基因突变状态。近年来,随着超敏感测序技术的发展,肿瘤的精准个体化治疗成为目前治疗的方向。数字PCR(dPCR)可以检测出丰度为0.01% ~0.1%的突变等位基因,而新一代测序(next-generation sequencing,NGS)可平行检测多种突变。循环肿瘤DNA(circulating tumor DNA,ctDNA)的半衰期不到两个小时,可动态反应肿瘤的实时情况。2016年FDA 首次批准液态活检技术-血液ctDNA 的测定用于非小细胞肺癌中EGFR 突变的诊断和靶向治疗,以及早期复发动态监测。然而由于血脑屏障的存在,原发脑肿瘤患者的血浆中罕有检出ctDNA。近来越来越多的研究显示,在中枢神经系统原发肿瘤(脑胶质瘤为主)及转移癌的患者脑脊液中可以检测出ctDNA,阳性率70%[6],但关于儿童MB 尚缺乏相关数据及研究。本课题通过对比儿童MB肿瘤组织和脑脊液ctDNA 检测结果,确定脑脊液液态活检在MB 中的可行性,探索脑脊液液体活检用于MB 动态监测的意义,并对进展及复发患儿再次进行基因诊断以实施个体化的精准治疗。
1 对象与方法
1.1 研究对象选取2019年4月至2019年12月北京天坛医院小儿神经外科收治的患儿6 例,术前均依据头颅核磁影像学诊断为MB,以及同期于我院住院的初治MB 患儿1 例,头颅及全脊髓核磁增强扫描提示存在脊髓播散MB。
1.2 髓母细胞瘤分类诊断标准及分期术后组织标本经天坛神经外科病理研究所和北京宣 武医院病理科确诊为MB 并行病理分型,共分为四种病理类型:经典型(classic medulloblastoma,CMB)、促纤维增生/结节型(desmoplastic/nodular medulloblastoma DMB)、广泛结节型(medulloblastoma with extensive nodularity,MBEN)、大细胞/间变型(large cell/anaplastic,LC/A);TAYLOR 等[8]提出MB 包括4 种独立的分子学亚型:WNT、SHH、3 型(Group3)、4 型(Group4),3 型和4 型属于非WNT/SHH 亚型。根据Chang′s 分期[9]将肿瘤分为5 期:M0 期指无肿瘤转移者,M1 期为仅脑脊液中有肿瘤细胞,M2期为仅脑部核磁共振成像(MRI)发现肿瘤转移灶,M3 期为脊髓MRI 发现肿瘤转移灶,M4 期为神经系统外发现肿瘤转移灶。
1.3 方法
1.3.1 采样术中样本留取:术中先行枕后正中入路留取脑脊液标本4 ~6 mL 及外周血streck 采血管4 mL。术后3 ~4 周样本留取:于术后3-4 周首次化疗前行腰椎穿刺留取脑脊液2 ~4 mL,并外周血streck 采血管4 mL。采集后4 ℃运输,2 ~3 h内-4 ℃离心10 min,分离后于-80 ℃保存。
1.3.2 ctDNA 提取脑脊液样本与200 μL 的Q Sepharose 阴离子交换树脂混合,置于旋转仪上室温孵育,将收集的沉淀利用Micro Bio-SpinTM(Bio Rad)色谱柱清洗后洗脱,洗脱后的DNA 用Qia Quick columns(Qiagen)进一步纯化。
1.3.3 ctDNA 的目标区域捕获和建库方案目标捕获和MB 密切相关基因的全部外显子区域,以血液作为参照样本排除胚系突变,用Covaris 破碎仪将基因组DNA(石蜡组织和血液)随机打断成长度为150 bp 大小的片段。将基因组DNA 片段以及脑脊液上清ctDNA,分别作为模板配制第一步PCR体系,将PCR 反应体系利用Rain Drop Source(Rain Dance Technologies)系统将单个分子分散至油包水液滴中,制备好的油滴经第一步PCR 扩增捕获目标区域,破坏油滴释放扩增子,再通过第二步PCR添加适用于illumina 测序平台的接头序列,磁珠法纯化DNA,对完整的DNA 文库用Agilent 2100 检测仪检测片段大小,利用文库定量试剂盒精确定量DNA 浓度,质检合格的文库进行后续实验。
1.3.4 髓母细胞瘤循环肿瘤DNA 的高通量测序对于游离DNA 中含量极低的循环肿瘤DNA片段,目标测序深度为20 000 ×,根据捕获区间大小计算文库输入量。目标捕获区域片段长度主要集中在160 ~200 bp 之间,选择PE150 测序策略通illumina 公司的HiSeq X Ten 测序仪进行高通量测序,下机数据Q30在90%以上的进行后续生信分析。
1.3.5 高通量测序数据进行生物信息学分析对获得的下机数据按index 进行拆分,得到原始测序序列(Raw Reads)。对Raw Reads 的数据量、碱基含量、碱基质量等结果进行统计,过滤不合格的数据,得到Clean Reads。将Clean Data 按分段比对的方式比对到参考基因组上。修正后的比对结果将作为输入文件进行突变检测、注释和统计。在体细胞SNV、Indel 的检测过程中,对正常样本和肿瘤样本进行成对分析,以检测出体细胞内与肿瘤发生相关的突变。
2 结果
2.1 脑脊液上清较脑脊液沉淀检出更丰富基因突变采用Agilent 2100 生物分析仪对标本ctDNA 片段大小进行进行质控分析,3 例在150 ~200 bp 处没有峰值,而在2 885 bp 处出现峰值,非ctDNA 片段,质控不合格,建库失败,未进行基因检测。样本192D360 采用952 基因对脑脊液上清、脑脊液沉淀及组织标本进行比对,脑脊液上清中较脑脊液沉淀可以检测出更多的基因突变,且这些突变囊括MB 相关的重要基因(图1)。
2.2 脑脊液基因突变检出较组织更丰富4例建库成功的患儿,男3 例,女1 例,年龄3 ~7 岁;CMB、DMB 各2 例;M0 期2 例;M2、M3 期各1 例;SHH、G4各2 例;3 例于术中采集ctDNA,1 例于腰穿时采集ctDNA。采集的ctDNA 浓度在0.137 ~57 ng/μL 之间。脑脊液SNV 检出较组织更丰富(13/11、25/12、24/10)。脑脊液检测出MB 相关重要基因突变,阳性率75%。组织检测出MB 相关重要基因突变,阳性率50%。CSF 检测出7 个MB 相关基因突变,组织检测出2 个MB 相关基因突变(表1)。
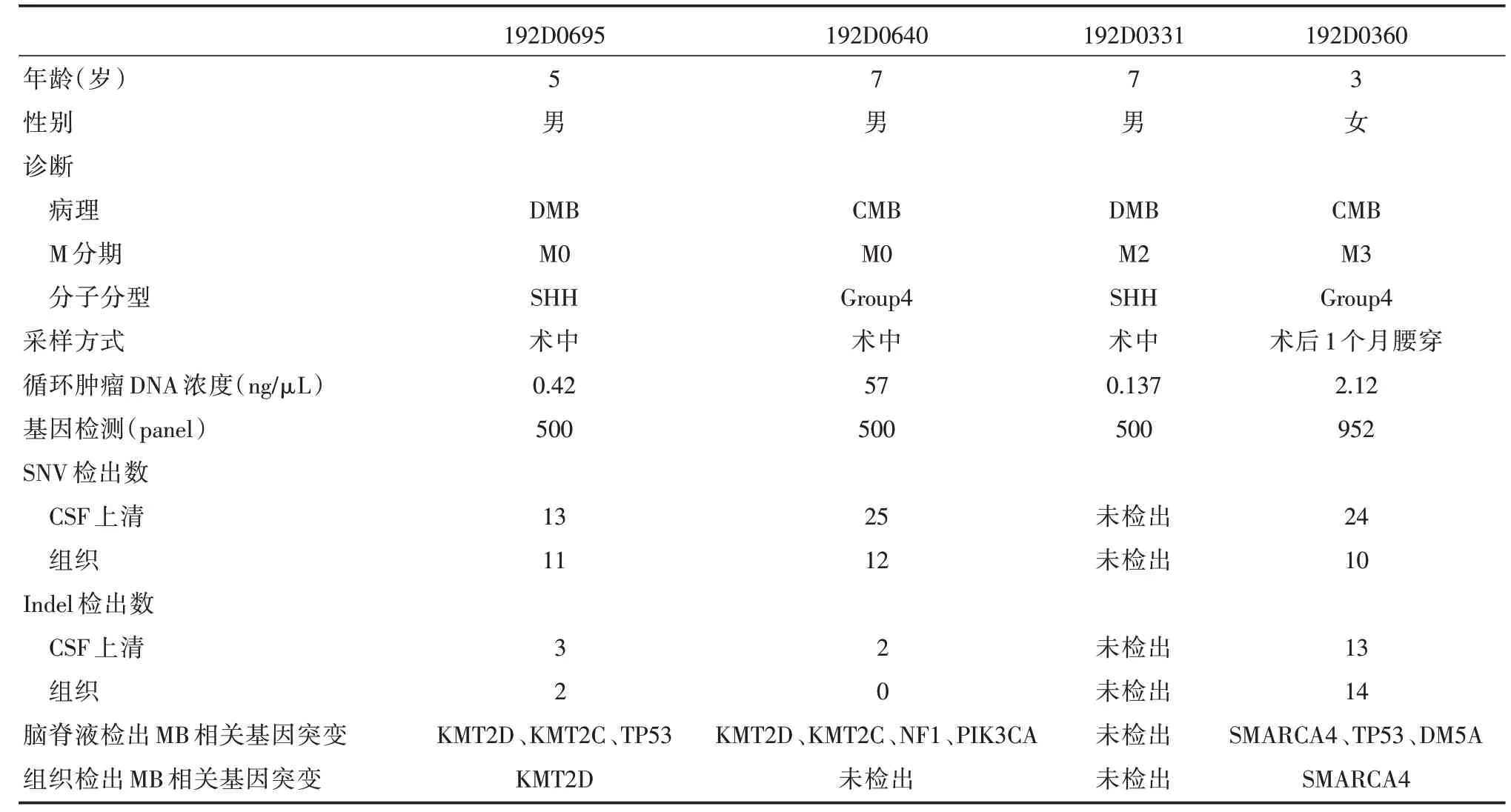
表1 临床资料及基因突变检出情况Tab.1 Clinical data and gene mutation detection status
3 讨论
MB 是儿童常见的恶性脑肿瘤,总体发病率2.34 ~5.96/100 万。随着基因组学的完善,对于MB 的生物学特征有了更进一步的理解。MB 现在被认为是不同分子病理疾病实体的总称,并在2016年的CNS 分类[3]中被分为WNT、SHH-TP53 野生型、SHH-TP53 突变型、非-WNT/非-SHH(包括Group3 和Group4),有MYC 扩增或TP53 突变的患者总体预后较差。但目前针对儿童MB 的ctDNA的系统性监测鲜有报道。
2016年FDA 已批准液态活检技术用于非小细胞肺癌中的EGFR 突变检测,且已有研究发现液体活检作为一种无创检测技术,可以用于肺癌的早期复发动态监测,甚至可以比影像学检查提前一年发现癌症复发的迹象[10]。现在血浆ctDNA 已被用于多种肿瘤的诊断、预后判断及精准治疗,如胰腺癌、肝细胞癌、前列腺肿瘤、直肠癌、甲状腺癌等[11-13]。与经典的组织病理相比,液体活检克服了传统组织活检的侵入性、取样困难等局限性,使肿瘤的实时动态监测成为可能。而且ctDNA 的遗传信息和肿瘤组织有良好一致性,可以动态反映肿瘤基因谱特征[14]。
BETTEGOWDA 等[15]针对640 例脑肿瘤患者进行血浆ctDNA 测定,其中136 例为14 个癌种的脑转移癌,41 例为脑胶质瘤、MB 等原发脑肿瘤,原发脑肿瘤敏感性低于其它肿瘤,在神经系统肿瘤患者中,脑脊液与肿瘤细胞接触更为亲密。脑脊液肿瘤细胞与原发肿瘤组织相匹配,但也有差异,特定的基因组区域在脑脊液肿瘤细胞中经常改变。SHANKAR 等[16]发现原发脑肿瘤的脑脊液ctDNA浓度明显高于血浆ctDNA 浓度,可检测到ctDNA的患者比未检测到ctDNA 的患者生存质量更差,ctDNA 分析可检测到相应组织样本中所缺失的突变。SIMONELLI 等[6]回顾ctDNA 液体活检在脑胶质瘤患者中的应用历史,灵敏度约为70%,在脑脊液样本中检测到TERTp 突变,灵敏度为92%,CSF-tDNA 中的低TERTp 突变总体存活时间明显更长。ctDNA 的液体活组织检查是诊断胶质瘤,特别是弥漫性中线胶质瘤的一个很有前途的工具。PAN 等[17]提示基于数字PCR 和靶向扩增子测序的方法对CSF ctDNA检测是有效且高灵敏度的。ESHINI等[18]研究表明,88%的DMG 患者的脑脊液上清液中鉴定出H3K27M,其中CSF 中ctDNA 的富集程度最高(诊断时达75%)。可尝试作为小儿弥漫中线胶质瘤监测和细胞体外治疗反应的可行方法。
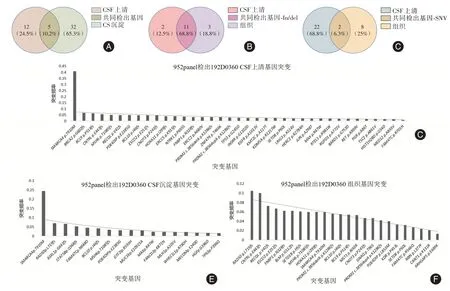
图1 192D0360 脑脊液上清、脑脊液沉淀及组织基因突变Fig.1 Gene mutations in the CSF supernatant,CSF precipitate and tissue of sample 192D0360
SPINDLER等[19]通过PCR及测序法证实血浆中ctDNA 分子比非突变的ctDNA 分子短。UNDERHILL 等[20]在大鼠异种移植模型中测定ctDNA 的片段在134 ~144 bp 之间,尽管这种缩短的原因尚未明确。在本研究中,最初3 例采样后直接-80 ℃冻存,之后统一进行复苏离心ctDNA 提取,采用Agilent 2100 生物分析仪质控分析发现非ctDNA 片段,考虑存在细胞破坏,大片段基因组干扰,无法进行深度测序,排除实验外。后脑脊液样本采集后4 ℃运输,2 ~3 h 内行-4 ℃离心10 min,分离后于-80 ℃保存。调整实验流程后,样本192D360 做为预实验,提取DNA 后应用Agilent 2100 进行DNA片段测试,在150 ~200 bp 处显示有峰值,采用952基因成功测序,对比脑脊液上清、沉淀及组织标本基因突变检出情况,脑脊液上清共检出37 个基因突变,脑脊液沉淀共检出17 个基因突变,共有突变5 个,其中与MB 密切相关的SMARCA4、TP53、KDM5A 三个基因突变在脑脊液样本中检出。SMARCA4 在上清和沉淀都有检出,TP53 和KDM5A 在上清检出,提示脑脊液上清中或许可以检测出更多的基因突变,且这些突变囊括MB 相关的重要基因,与PENTSOVA 等[21]研究一致,确立以脑脊液上清做为后期研究的方向。本组数据显示CSF 和肿瘤组织检出Indel 一致性高,而SNV 一致性低。脑脊液SNV 检出较组织更丰富。脑脊液MB 相关基因突变检出阳性率75%,组织MB 相关重要基因突变检出阳性率50%。脑脊液检测出KMT2D、KMT2C、TP53、NF1、PIK3CA、SMARCA4、KMD5A 等MB 相关基因突变,组织检测出KMT2D、SMARCA4 等MB 相关基因突变,分析可能与ctDNA片段短150 bp,测序深度达20000x 有关[22]。但本研究数据尚少,需进一步扩大样本量并多中心研究明确。
综上所述,脑脊液ctDNA 作为液体活检在MB 诊断中有一定作用。现有的研究提示脑脊液ctDNA 的检测对于提示疾病进展及预后具有一定的作用,但囿于脑脊液标本量以及儿童MB 基因突变的检出率及突变丰度等,目前对于MB 的进展、复发的判断仍以影像学检查为主。本研究初步提出脑脊液液体活检在MB 的诊断中是可行的,摸索了最优化的实验条件,提示尤其在复发MB 患儿无法手术获得组织标本时脑脊液ctDNA 检测可能为进一步的个体化治疗的提供方向,是一个初步的尝试,ctDNA 的浓度及基因突变程度对预后生存期意义还有待进一步观察,后续会进行更大样本的验证。
