基于化疗的PD-1抑制剂在晚期肺腺癌治疗中效果及安全性分析
2021-03-17李兴马丽娜程小珍崔荣花张曙波
李兴 马丽娜 程小珍 崔荣花 张曙波
中南大学湘雅医学院附属海口医院1肿瘤化疗科,2神经内科(海口570208)
肺癌在我国肿瘤患者的发病率和病死率中均居首位,肺腺癌是最常见的病理类型。肺癌早期症状不明显,确诊时多已是中晚期,丧失了手术治疗时机。含铂双药化疗是中晚期肺癌的主要治疗方法,可有效提高肺腺癌患者的无病生存期,但是多数患者最终会复发并转移,5年生存率不到15%,预后较差[1-2]。近代靶向治疗、免疫治疗在肿瘤治疗中获得重大突破。研究显示,肿瘤复发与其免疫逃避能力有关[3-4]。程序性细胞死亡蛋白-1(programmed cell death 1,PD-1)及其配体(PD-L1)是免疫逃逸发生的主要机制,抑制该通路可明显改善患者预后[5-7]。派姆单抗(Pembrolizumab,K药)是以PD-1 为靶点的治疗药物,KEYNOTE-189 研究奠定了K 药联合培美曲塞和铂类在非鳞非小细胞肺癌一线治疗地位,但国内相关研究较少[8-9]。我科晚期肺腺癌患者采用K 药联合培美曲塞+顺铂治疗效果良好,且副反应低,现报道如下。
1 资料与方法
1.1 临床资料以我院2018年8月至2019年7月86 例晚期肺腺癌患者为研究对象,根据患者治疗方案不同随机分为观察组(40 例)和对照组(46 例)。纳入标准:(1)患者均经病理结果确诊为肺腺癌,TNM 分期为ⅢB~Ⅳ期,PD-L1≥1%,均为无驱动突变的非小细胞肺癌(NSCLC),未经化疗、放疗及免疫治疗等;(2)具有良好沟通能力,愿意配合完成研究;(3)患者均了解研究基本过程,已签署知情同意书。排除标准:(1)合并自身免疫系统疾病、其他部位肿瘤者;(2)驱动基因、EGFR 和ALK 阳性患者;(3)对本研究中所用药物过敏者;(4)不能按时随访者。本研究经我院伦理委员会审核通过。两组一般资料比较差异无统计学意义(P>0.05),见表1。
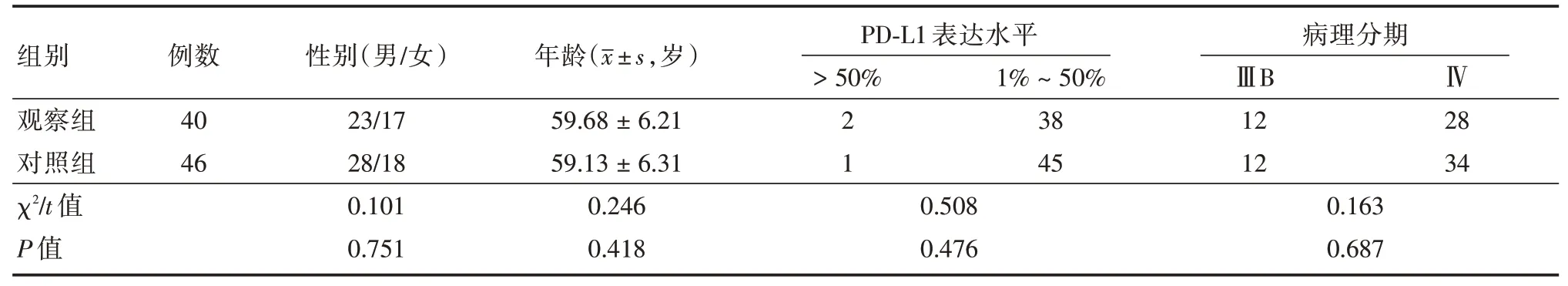
表1 两组一般资料比较Tab.1 Comparison of general data between two groups
1.2 方法对照组和观察组均采用培美曲塞(江苏豪森药业股份有限公司,国药准字H20051288)联合顺铂(南京制药厂有限公司,国药准字H20030675)治疗,每周第一天给予培美曲塞静脉滴注,剂量为500 mg/m2,顺铂静脉滴注,剂量为75 mg/m2,共4 个周期。观察组在对照组基础上,另给予PD-1 抑制剂派姆单抗治疗,每3 周给予1 次静脉点滴,剂量为200 mg。随访12 个月,记录患者无进展生存期(progression-free survival,PFS)及不良反应等。
1.3 观察指标以客观缓解率(objective response rate,ORR)、无进展生存期(progression free survival,PFS)、血清肿瘤标志物水平、不良反应发生率为观察指标。(1)治疗效果:采用实体瘤疗效评价标准(RECIST 1.1)对患者治疗效果进行评估,以ORR 和PFS 为观察终点。①完全缓解(CR):除结节性疾病外,所有目标病灶完全消失。所有目标结节须缩小至正常大小(短轴<10 mm)。②部分缓解(PR):所有可测量目标病灶的直径总和低于基线≥30%。③疾病进展(PD):以整个实验研究过程中所有测量的靶病灶直径之和的最小值为参照,直径和相对增加至少20%(如果基线测量值最小就以基线值为参照);除此之外,必须满足直径和的绝对值增加至少5 mm(出现一个或多个新病灶也视为疾病进展)。④疾病稳定(SD):靶病灶减小的程度没达到PR,增加的程度也没达到PD 水平,介于两者之间,研究时可以直径之和的最小值作为参考。客观缓解率(ORR)=CR 与PR。(2)血清肿瘤标志物:细胞角蛋白19 片段(Cytokeratin-19-fragment,CYFRA21-1)、癌胚抗原(carcino-embryonic antigen,CEA)。采集患者静脉血液,在4 ℃条件下,以3 000 r/min,分离血清,使用酶联免疫方法检测,试剂盒购自上海邦景实业有限公司,操作严格按照说明书。(3)不良反应:疲乏、恶心、皮疹、骨髓抑制、甲状腺功能异常等,根据周期对患者不良反应进行评价,根据NCI-CTC4.0 版评估不良反应轻重级别,1~4 级,级别越高表示患者相应不良反应程度越严重。
1.4 统计学方法采用SPSS 20.0 软件进行统计学分析。计量资料以均数±标准差表示,组间比较采用t检验;计数资料以例(%)表示,组间比较采用χ2检验;以P<0.05 为差异有统计学意义。
2 结果
2.1 两组ORR 及PFS 比较观察组ORR 明显高于对照组(P<0.05)。观察组PFS 中位为9.3 个月,对照组PFS 中位数为5.3 个月。见表2。
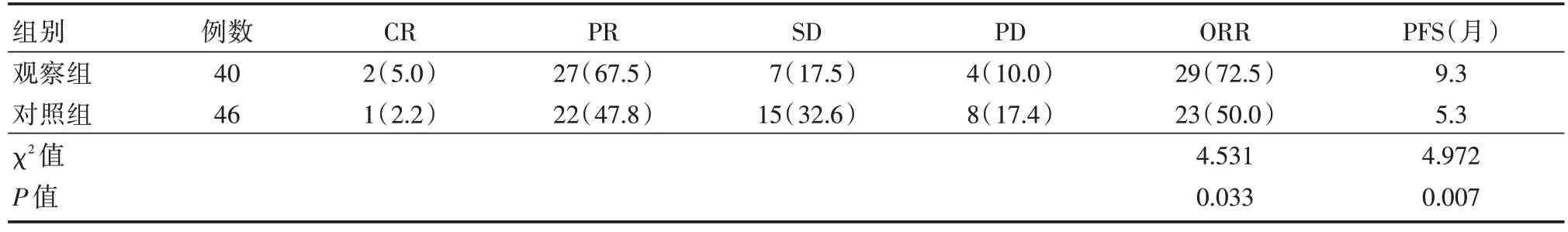
表2 两组ORR 及PFS 比较Tab.2 Comparison of Orr and PFS between the two groups 例(%)
2.2 两组血清肿瘤标志物水平比较治疗前,观察组CYFRA21-1、CEA与对照组相比差异无统计学差异(P<0.05);治疗后3 个月,观察组CYFRA21-1、CEA 与对照组相比明显较低(P<0.05)。见表3。
表3 两组血清肿瘤标志物水平比较Tab.3 Comparison of serum tumor markers between the two groups ±s,ng/mL
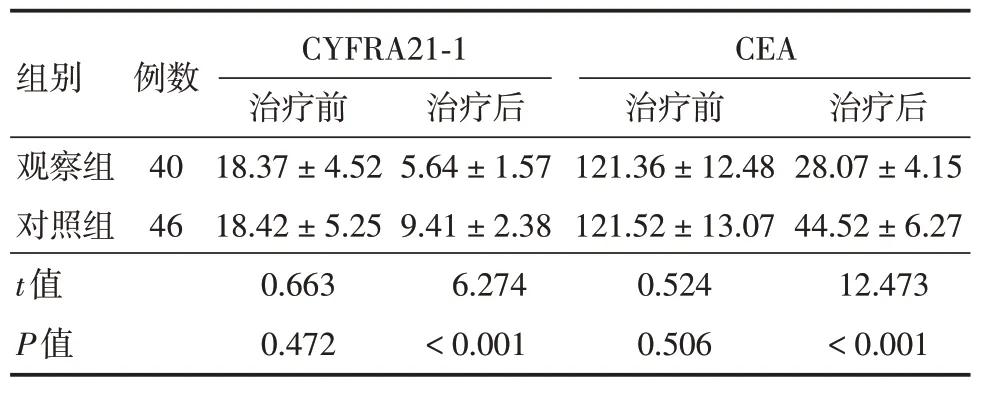
表3 两组血清肿瘤标志物水平比较Tab.3 Comparison of serum tumor markers between the two groups ±s,ng/mL
CYFRA21-1CEA 组别观察组对照组t值P值例数40 46治疗前18.37±4.52 18.42±5.25 0.663 0.472治疗后5.64±1.57 9.41±2.38 6.274<0.001治疗前121.36±12.48 121.52±13.07 0.524 0.506治疗后28.07±4.15 44.52±6.27 12.473<0.001
2.3 两组不良反应发生率比较观察组疲乏、恶心、粒细胞减少、血小板降低发生率与对照组比较差异无统计学意义(P>0.05);观察组皮疹、甲状腺功能减退发生率高于对照组,两组甲状腺功能异常发生率差异有统计学意义(P= 0.041);无其他免疫不良反应发生。见表4。
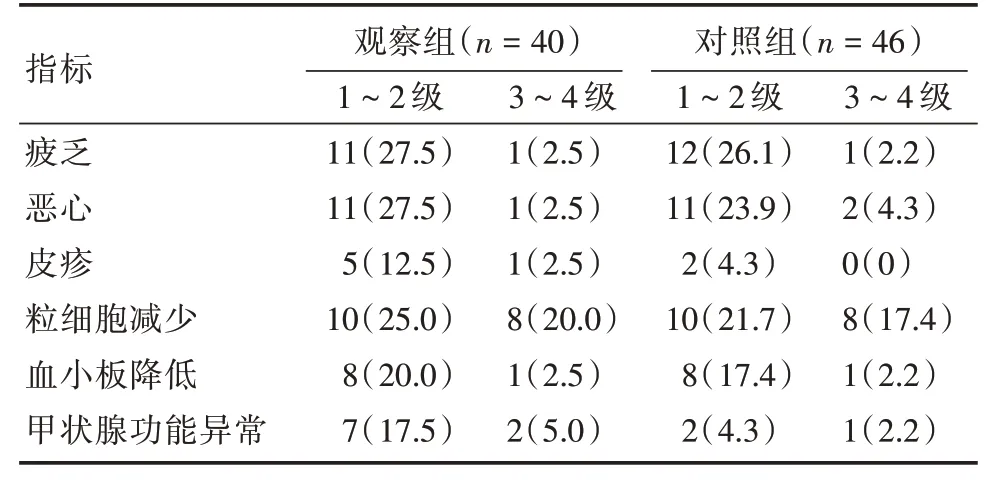
表4 两组不良反应发生率比较Tab.4 Comparison of the incidence of adverse reactions between the two groups 例(%)
3 讨论
肺腺癌早期无明显症状,多数患者发现时已处于中晚期,驱动基因阴性患者只能选择化疗为主要治疗方式[10-12]。培美曲塞含有吡咯嘧啶基团结构,具有细胞内叶酸的功能,从而抑制肿瘤生长,但是随治疗时间延长患者终会出现耐药[13-14]。PD-1属于免疫球蛋白家族成员,在多种细胞中具有表达,如T 细胞、自然杀伤细胞及单核细胞等[15-16]。在正常人体内,PD-1 可识别免疫细胞抗原,对外周组织免疫细胞功能进行调节,从而维持正常的免疫应答,防止患者发生自身免疫相关性疾病。PD-L1 是PD-1 的配体,在免疫反应中具有负调控作用[17-18]。当PD-1 与其配体PD-L1 结合后会通过招募蛋白酪氨酸酶-1(SHP-1)等对其下游信号通路PI13K/AKT 等产生阻滞,进而对T 细胞增殖及细胞因子产生抑制作用[19-20]。当机体发生肿瘤时,多数患者会出现PD-1/PD-L1 表达增高,从而对肿瘤浸润淋巴细胞起到抑制作用,导致患者发生免疫逃逸。Pembrolizumab 是一种PD-1 免疫球蛋白G4 单克隆抗体,具有靶向负向免疫调节的功能,在晚期实体瘤治疗中疗效较好,不良反应低[21-22]。本研究采用Pembrolizumab 联合一线主要化疗药物对PD-L1 ≥1%且均为无驱动突变的NSCLC 患者进行治疗,由于ⅢB 期的患者占比例较高,故患者治疗后ORR 比较高。
本研究结果显示,观察组ORR 明显高于对照组,提示Pembrolizumab治疗效果更好,可能与其降低肿瘤细胞免疫逃逸发生有关[21-22],与KEYNOTE189研究中观察相比ORR 较高,考虑和研究人群中IIIB 期的患者占比例高有关。观察组PFS 中位数明显大于对照组,提示Pembrolizumab 联合化疗能够明显改善患者预后,进而延长患者无进展生存期。观察组血清、CYFRA21-1 及CEA 表达水平明显低于对照组,CYFRA21-1 存在于凋亡的肺泡上皮细胞角蛋白碎片中,可作为非小细胞肺癌疗效及预后的评估指标。CEA在多种肿瘤中表达,对大肠癌、肺癌等疗效判断、病情评估具有重要作用。观察组皮疹、甲状腺功能减退发生率高于对照组,且两组甲状腺功能异常发生率差异有统计学意义,提示Pembrolizumab 易引起患者发生皮疹和甲状腺功能异常,以甲减为多,但是该药对患者无其它明显不良反应。本研究印证了一线K 药联合化疗在晚期驱动基因阴性肺腺癌中的治疗优势,有效且安全,但需要较长时间的临床观察。综上所述,PD-1 抑制剂在晚期肺腺癌中疗效好且安全性较高,值得在临床中推广应用。
