胎儿生长受限孕妇血清、胎盘组织中Klotho及VEGFR2蛋白的表达及其临床意义
2021-03-17刘蕾朱锦明李亚楠彭凤云
刘蕾 朱锦明 李亚楠 彭凤云
1徐州医科大学研究生院(江苏徐州221006);2徐州妇幼保健院(江苏徐州221009)
人类基因KL 定位于染色体13q12,由5 个外显子组成,其翻译产物蛋白具有膜型和分泌型2种亚型[1]。分泌型Klotho 蛋白(sKL)主要分布于血液中,少量存在于尿液和脑脊液中[2],其以体液因子的形式存在于循环系统中,人体缺乏KL 蛋白可表现为内皮功能障碍、动脉硬化及血管生成受损等。KUSABA 等[3]证实KL 与VEGR2 和瞬时受体潜在的canonical-1 Ca2+通道相关,以维持内皮细胞的完整性。
胎儿生长受限(fetal growth restriction,FGR)是围产期死亡的第二大最常见原因[4]。2019年ACOG发布的FGR实践指南将FGR定义为:估计胎儿体重(estimated fetal weight,EFW)低于相应胎龄第10 百分位数以下的胎儿[5]。FGR 胎儿的围产期发病率和死亡率以及长期健康缺陷的风险较正常胎儿更高,然而FGR目前缺乏有效的治疗方法,早期诊断、筛查高危因素,成为防治重点。目前关于FGR 发病原因及发病机制无明确定义,其中胎盘功能不全与FGR 的发病有着密切联系,本实验将通过检测FGR 孕妇血清、胎盘组织中KL 蛋白及VEGFR2的表达水平,研究其表达水平差异是否影响正常胎盘血管网的形成及其对血管功能的影响,推测其在FGR 发生发展中的可能作用,以期为FGR 的病因提供新的思路,为预测FGR 的发生及评估孕妇胎盘功能提供新的方向,以及为FGR 治疗提供新的靶点。
1 资料与方法
1.1 一般资料选择2019年1月-2020年6月在徐州医科大学附属徐州妇幼保健院产科住院分娩的FGR 患者60 例。纳入标准:(1)符合相关诊断标标准;(2)产妇及其家属均自愿签署知情同意书。排除标准:(1)自身免疫缺陷等疾病;(2)多胎妊娠;(3)伴严重肝肾等重要器官障碍性疾病;(4)受染色体和/或先天性异常影响的孕妇;(5)产前筛查提示胎儿可能存在发育异常;(6)父母双方身材矮小或有家族性FGR 病史,另选择同期正常孕晚期孕妇30 例作为对照组,对照组病例排除内外科合并症和产科并发症。其中,FGR 患者60 例,根据诊断时的孕周,将其分为:早发型FGR30 例(发病孕周<32 周);晚发型FGR30 例(发病孕周≥32周)[6-9]。3 组均为单胎妊娠。3 组间平均年龄、孕次、产次差异无统计学意义(P>0.05),分娩孕周之间比较差异有统计学意义(P<0.05)。见表1。研究对象均征求本人书面同意并经徐州医科大学附属徐州妇幼保健院伦理委员会同意(批准号:徐州市妇幼保健院[2020]伦审第(01)号)。
表1 三组孕妇一般情况比较Tab.1 The general situation of pregnant women in three groups was compared±s
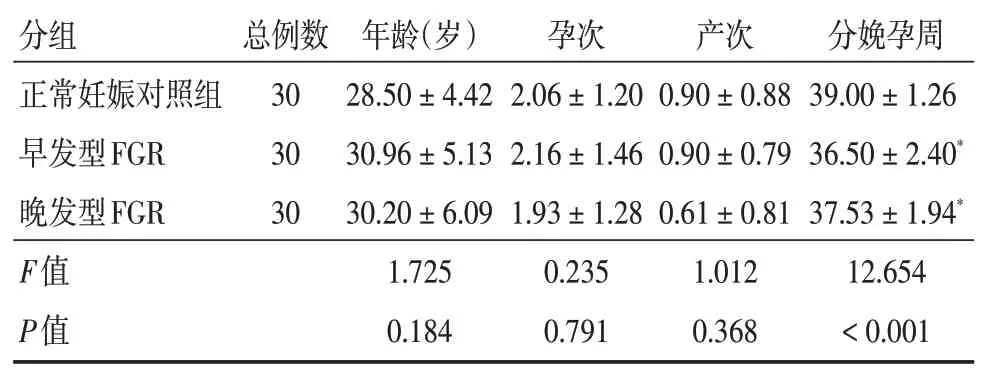
表1 三组孕妇一般情况比较Tab.1 The general situation of pregnant women in three groups was compared±s
注:与正常妊娠对照组相比,*P <0.05
分组 总例数 年龄(岁) 孕次 产次 分娩孕周正常妊娠对照组3028.50±4.422.06±1.200.90±0.8839.00±1.26*早发型FGR晚发型FGR F值P值30 30 30.96±5.13 30.20±6.09 1.725 0.184 2.16±1.46 1.93±1.28 0.235 0.791 0.90±0.79 0.61±0.81 1.012 0.368 36.50±2.40 37.53±1.94*12.654<0.001
1.2 ELISA 法检测sKL、sVEGFR2所有的入组的研究对象均于入院后当日抽取肘静脉血4 mL,离心,留取上清液,应用ELISA 方法检测血清中sKL、sVEGFR2 的表达水平。
1.3 免疫组化检测胎盘组织中KL、VEGFR2采用免疫组化SP 二步法检测胎盘组织中KL、VEGFR2,一抗为兔抗人单克隆KL 抗体(英国Abcam 公司)、VEGFR2 单克隆抗体(英国Abcam 公司)严格按照试剂盒说明书步骤操作。根据阳性细胞百分率和细胞染色强度确定Klotho 及VEGFR2 的表达水平。参照FROMOWITZ 等[10]的综合计分法进行半定量分析,根据阳性细胞分布范围和染色强度确定蛋白的表达水平。以胞膜或胞质出现明显的棕黄色颗粒为阳性细胞,无着色或与背景颜色一致的为阴性细胞。阳性细胞百分数:≤5%为0 分,6%~25%为1 分,26%~49%为2 分,≥50%为3 分;阳性细胞着色强度:无着色为0 分,浅棕褐色为1 分,棕褐色为2 分,深褐色为3 分;两项评分相加:0~1 分为阴性,>1 分为阳性。
1.4 Western blot 检测胎盘KL、VEGFR2 蛋白量表达用蛋白提取试剂盒提取组织蛋白,并用BCA 法进行蛋白定量。配制SDS-PAGE 凝胶,电泳;切胶,电转,脱脂牛奶封闭液室温封闭2 h,放入KL 单抗(1∶1 000)、VEGFR2 单抗(1∶1 000)孵育过夜,洗膜,加入相应二抗(1∶5 000)孵育;洗涤后曝光,以β-actin 作为内参照。蛋白的相对表达量用待测蛋白与β-actin 的灰度值比值计算。
1.5 实时荧光定量PCR(RT-qPCR)测定胎盘KL mRNA、VEGFR2 mRNA 的表达量采用Trizol 法处理组织样品,提取总RNA 逆转录为cDNA。后进行聚合酶链式反应(PCR)扩增,目的基因KL 引物序列,上游:5′-CTGGATGGTATCAATCTTTGCG-3′,下游:5′-ATCTGCAGCATAACGATAGAGG-3′,目的基因VEGFR2 引物序列,上游:5′-GGAGCTTAAGAATGCATCCTTG-3′,下游:5′-GATGCTTTCCCCAATACTTGTC-3′,目的基因扩增30个循环,以甘油醛-3-磷酸脱氢酶(GAPDH)作为内参对照,计算相对含量。最后通过2-△△CT法计算各组表达水平的倍数差异。
1.6 统计学方法采用SPSS 22.0 统计软件进行统计分析。检验数据正态性及方差齐性后,计量数据以计算,多个样本均数比较采用单因素方差分析;计数资料使用例数或(%)表示,采用χ2检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 ELISA 检测结果结果显示FGR 组孕妇血清中sKL、sVEGFR2 表达低于正常妊娠对照组(P<0.05),其中早发型FGR 组和晚发型FGR 组差异无统计学意义(P>0.05)。见表2。
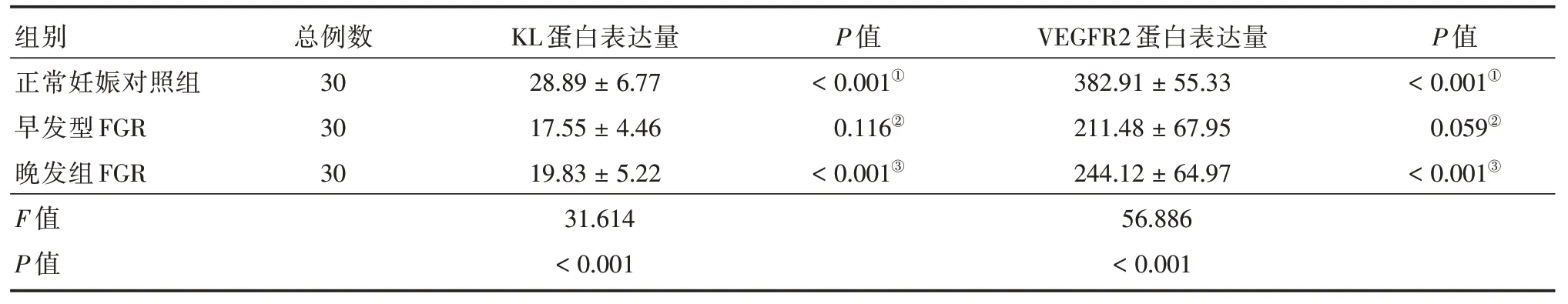
表2 三组孕妇外周血中sKL、VEGFR2 的表达量Tab.2 Expression levels of sKlotho and VEGFR2 in peripheral blood of three groups of pregnant women x±s,pg/mL
2.2 免疫组化结果结果显示KL蛋白主要表达于胎盘合体滋养细胞的细胞膜、细胞质及胎盘血管内细胞中(图1),VEGFR2 主要表达于胎盘血管内皮细胞中(图2)。FGR 组中KL、VEGFR2 蛋白表达低于正常妊娠对照组(P<0.05),其中,早发型和晚发型差异无统计学意义(P>0.05)。见表3。
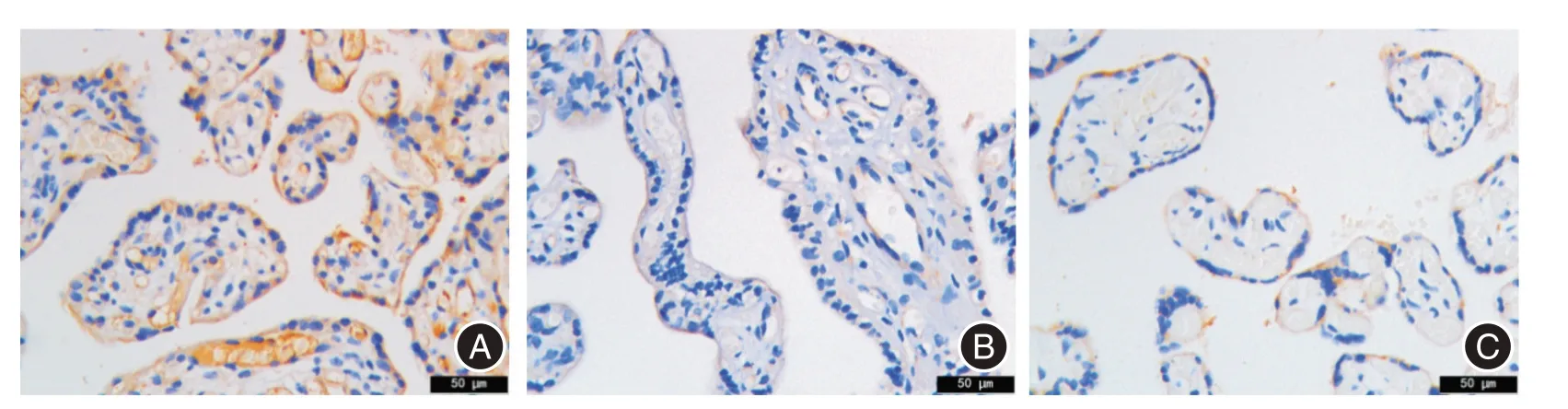
图1 KL 在胎盘组织中的表达(DAB 染色,×400)Fig.1 Expression of KL in placental tissues(DAB staining,×400)
2.3 三组孕妇胎盘组织中KL、VEGFR2 蛋白及mRNA 表达水平FGR 组中KL mRNA、VEGFR2 mRNA 及蛋白表达水平均低于正常妊娠对照组(P<0.05),其中早发型FGR 组和晚发型FGR 组差异无统计学意义(P>0.05)。见图3。
3 讨论
KL 基因编码α-Klotho、β-Klotho 及KL 相关蛋白,通过转录形成两种转录本:一种是全长,该转录本可翻译为由1 012 个氨基酸组成的分子量为130 kD 的跨膜蛋白,即膜型;另外一种转录本可翻译为N 端的549 个氨基酸,分子量为65~70 kD 的分泌型蛋白[11]。血液循环中的KL蛋白由膜型KL蛋白经水解产生的胞外区片段和分泌型KL 蛋白组成。缺乏KL 蛋白会影响内皮细胞的完整性,其表达与血管钙化、动脉粥样硬化、肾病及肿瘤等多种疾病有关。在成人中,血管内皮生长因子(VEGFs)是胚胎发育和血管形成过程中血管发育的重要调节因子。已有研究表明,在哺乳动物中,存在几个不同的剪接变体和加工形式的五种VEGF 配体,这些配体以重叠的模式结合三种酪氨酸激酶受体(RTKs),即VEGFR1、VEGFR2和VEGFR3,以及共受体,如硫酸肝素蛋白多糖(HSPGs)等[12],sVEGFR2是一种免疫激活受体,由内皮细胞表面蛋白水解形成,伴随配体诱导下VEGFR2 的形成,在刺激新血管发生与生长以及维持血管壁的完整性和正常通透性方面均有重要意义。KUSABA 等[8]证实VEGF 介导的Ca2+信号通路通过与KL 的相互作用而受到严格的调控,并且KL 在VEGF 介导的血管活动以及内皮功能的维持中发挥重要作用。
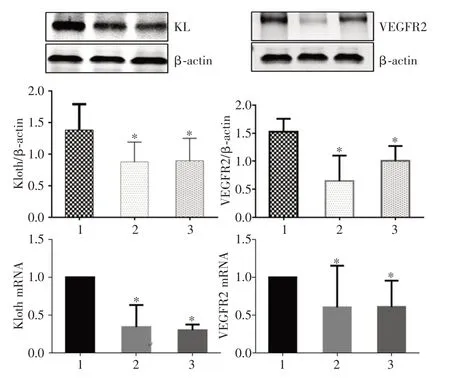
图3 三组孕妇胎盘组织中KL mRNA 及VEGFR2 mRNA 的表达Fig.3 Expression of KL mRNA and VEGFR2 mRNA in placental tissues of three groups of pregnant women
宫内生长受限常伴有胎盘血管疾病,胎盘功能异常导致的胎盘灌注不良是FGR 最常见的病因[13],主要表现为胎盘血管建立不全、胎盘滋养细胞侵入功能障碍,影响子宫螺旋小动脉生理性重铸,使胎盘血流量减少,从而影响胎儿血供。与正常妊娠胎儿胎盘相比,FGR 胎儿胎盘病理形态学改变为胎盘体积缩小;镜下病理改变表现为绒毛内间质增生、钙化,纤维素样坏死增多;绒毛内血管减少甚至消失,管腔狭窄,甚至闭塞[14]。以上改变导致胎盘血流不足,交换面积减少,限制了氧及营养物质的摄取和转运,是造成FGR 胎盘功能减退的形态学基础[15]。在KL 蛋白与妊娠相关疾病中,现有研究表明,与正常妊娠相比,子痫前期胎盘KL mRNA 和蛋白表达降低,子痫前期产妇血清中KL降低[16-17]。FRANKLIN 等[18]报道称KL蛋白在小于胎龄儿(small for gestational age infants,SGA)脐血及中表达下降,并与血管生成素2 相关,可能在血管介导的胎盘衰老加速导致的宫内生长受限中发挥作用,另有研究观察到,与正常出生体重组相比,巨大儿妊娠胎盘中KL 基因表达较高[19]。FGR 同妊娠期高血压与妊娠期糖尿病等妊娠并发症一样,都有着胎盘血管及微循环的改变,推测KL 蛋白可能通过调控胎盘血管生成,影响胎盘循环,从而参与与胎盘血管病变相关的一系列妊娠并发症的病理生理改变。
本研究结果显示KL 蛋白主要定位于胎盘合体滋养细胞的细胞膜与细胞质及胎盘血管内皮细胞中,而VEGFR2 主要定位于胎盘血管内皮细胞中,从蛋白及mRNA 水平上均显示KL、VEGFR2 表达在FGR 组中低于正常妊娠对照组(P<0.05),而在早发型FGR 与晚发型FGR 中,KL、VEGFR2 的表达差异无统计学意义(P>0.05),同时在FGR 组的胎盘病理切片中观察到了程度不同的血管灌注不足,终末绒毛血管形成欠佳、纤维素样坏死缺血,绒毛间质纤维化,合体结节增多,及小灶状梗死、钙化。因此笔者推测KL 蛋白与VEGFR2 相互作用,影响正常胎盘血管形成和发育,造成胎盘异常病理改变,从而导致胎盘血流进一步减少,胎盘发育不良,血管钙化、微绒毛数量和密度明显减少,阻碍母儿营养交换,从而导致FGR 的发生。ELISA检测结果显示FGR 组孕妇血清中sKL 及sVEGFR2的含量低于对照组(P<0.05),其中早发型FGR组与晚发型FGR 组比较差异无统计学意义(P>0.05),推测sKL 可能作为一种体液调节因子,与VEGFR2共同作用,通过体液循环,最终作用于胎盘,调控胎盘血管生长,sKL 蛋白表达减少,导致血管钙化,胎盘血管功能受损,胎儿营养缺乏,进而发展为FGR。早发型FGR 组与晚发型FGR 组虽差异无明显统计学意义(P<0.05),但早发型FGR 孕妇外周血清中sKL 蛋白含量的均值低于晚发型FGR,有研究[20]表明早发型FGR 胎盘螺旋动脉重构缺陷,周围缺氧干扰绒毛发育,胎盘效率降低较晚发型FGR更常见,早发型FGR可能存在更早期的胎盘血管功能障碍,较晚发型FGR 在病理生理上表现的更为典型,本次研究的孕周为孕晚期,而在孕晚期早发型FGR 孕妇及晚发型FGR 孕妇均已形成胎盘不可逆的病理改变,这可能是造成KL 与VEGFR2的表达在孕妇胎盘及血清中表达无明显差异的原因。
综上所述,本研究表明KL 蛋白、VEGFR2 蛋白在FGR 孕妇母体血清及胎盘中的表达量降低,提示KL 蛋白可能与VEGFR2 共同作用参与FGR 的发生发展,推测KL 通过与VEGFR2 相互作用,调节胎盘血管内皮功能,从而影响胎盘胎儿循环。KL 与VEGFR2 具体在胎盘血管上的作用机制有待进一步研究,可以从细胞水平探讨KL 与VEGFR2在胎盘血管形成上的相互作用机制,本文局限于孕晚期研究,可进一步追溯FGR 孕妇孕早期及孕中期,以期为FGR 的预测、预防提供一个新的靶点,以便于最大程度降低FGR 母儿风险。
