白鲜碱通过Wnt/β-catenin信号通路抑制前列腺癌骨转移PC-3细胞的作用
2021-03-17廖壮文梁采宇陈灿伟杨进顺黄帅
廖壮文 梁采宇 陈灿伟 杨进顺 黄帅
广州医科大学附属第二医院骨科(广州510260)
前列腺癌(PCa)是上皮性恶性肿瘤的一种,是男性常见的恶性肿瘤[1]。前列腺癌之所以危害患者生命,主要是由于肿瘤转移导致的一系列病理性破坏[2]。其中骨转移是晚期前列腺癌发病率最高的并发症,且一旦癌细胞扩散到骨骼,它们会显著破坏正常的骨重建,导致骨折、神经压迫、疼痛和高钙血症[3]。晚期前列腺癌因淋巴结及远处器官转移等各种因素,导致治疗效果差[4-5]。目前,在临床治疗上,能有效治疗前列腺癌的方案很少,尤其是发生骨转移的患者预后很差[6-7]。但对于还没发生转移的前列腺癌,采取雄激素去除治疗可获得较好的疗效[8-9]。所以,要治疗前列腺癌、提高患者生存时间以及改善预后最关键的一步在于如何阻止或延迟患者前列腺癌远处转移的发生。
既往研究表明,前列腺癌为上皮性肿瘤的一种,其发生恶性肿瘤转移主要是通过上皮细胞转化为间质性细胞[10],使细胞极性丧失,失去细胞间的紧密连接,从而增强肿瘤细胞的迁移及侵袭能力,这个过程医学上称为上皮-间充质转化(epithelial-mesenchymal transition,EMT)[11-12]。临床上大部分前列腺癌患者经过常规技术疗法后[13],可发现残余的前列细胞癌细胞呈现显著的EMT 表现[14]。因此,猜测EMT 对前列腺癌的转移可能起着重要作用,抑制EMT 过程将大大增加前列腺癌的治疗效果。
白鲜碱(Dictamnine)是一种天然生物碱,可从白鲜根中提取提纯出来[15]。根据现有的研究实验表明,白鲜碱对某些肿瘤细胞有着抑制细胞增殖、侵袭和转移的作用。但白鲜碱能否抑制前列腺癌细胞转移和抑制EMT 及机制还不清楚。因此本次研究探究白鲜碱对前列腺癌细胞是否有着同样的作用。
本次研究中,通过使用白鲜碱以及联合使用Wnt 通道激活剂(LiCl)分别作用于前列腺癌细胞,分析前列腺癌细胞的增殖、迁移、侵袭能力的改变,从而探究出白鲜碱能否抑制前列腺癌EMT过程及其机制,为治疗前列腺癌提供新的治疗方向。
1 材料与方法
1.1 材料人前列腺癌PC-3 细胞购于ATCC(美国典型培养物保藏中心,美国),培养基采用型号RPMI-1640(加入1 × 105U/L 青霉素、100 mg/mL 链霉素和10%胎牛血清)。培养箱环境设置为37 ℃,5%CO2。将PC-3 细胞接种于培养基置于培养箱中培养,每两天进行一次换液。取对数生长期细胞进行试验。
1.2 MTS 检测细胞增殖使用0.25%胰蛋白酶消化PC-3 细胞,重悬后接种于培养板(96 孔,每孔100 μL,细胞浓度3×104个/mL)。待细胞贴壁后,分别加入不同浓度的白鲜碱作为实验组(0、50、100、200、400、800 μmol/L),并建立DMSO 对照组,每一组设定8 个复孔,培养48 h 后,测定各组细胞增殖情况。并得出白鲜碱对PC-3 细胞的半抑制浓度(IC50)。然后通过MTS 检测半抑制浓度白鲜碱处理PC-3 细胞的增殖率,分别在培养0、1、2、3 d时,于每孔加入10 μL 的MTS 试剂,在37 ℃恒温箱中孵育3 h,使用多功能酶标仪检测各孔的吸光值A(490 nm),观察白鲜碱在不同的处理时间对PC-3细胞增殖的影响。
1.3 白鲜碱对PC-3 细胞形态变化影响取PC-3细胞对数生长期细胞进行试验。同时加入不同浓度的白鲜碱,实验组(100、200 μmol/L)与对照组(0 μmol/L),继续置于培养箱中培养24 h 后取出,分别于显微镜下观察各组PC-3 细胞形态。
1.4 Transwell 检测细胞迁移取对数生长期的PC-3 细胞进行迁移试验。在Transwell 上室加入200 μL 含2 × 104个细胞的培养液(含0.2% FBS),下室分别加入600 μL 培养基(含10% FBS),其中分别加入终浓度为0、100 和200 μmol/L 的白鲜碱。配置PBS 溶液并进行预冷用以洗涤。待细胞培养24 h 后取出Transwell 小室,因小室上室存在残余未穿过细胞,需使用PBS 洗涤3 次并用棉签小心谨慎地去除。4%多聚甲醛固定细胞后,使用结晶紫染色20 min。染色后再次PBS 洗涤,置于显微镜观察并计数穿过膜的细胞数,计算各组的平均值。
1.5 Transwell 检测细胞侵袭提前使用Matrigel基底胶包被Transwell 上室后进行细胞侵袭实验,后续步骤同上。
1.6 PCRPCR 技术检测目标蛋白转录mRNA水平,首先提取总mRNA(使用RNA 分离试剂盒(Qiagen,USA),通过逆转录从总mRNA 中提取信使RNA(mRNA)和miRNA,该过程使用cDNA 合成试剂盒(RFS,美国)进行逆转录。使用iQ SYBR Green(BIO-RAD,USA)在CFX96 系统上扩增和定量互补DNA(cDNA)。Real-time PCR 按照标准方法进行。利用RiboBio(中国广州)合成并纯化U6、E-cadherin、vimentin、Snail、β-catenin 的引物。内源性对照为U6 或甘油醛-3-磷酸脱氢酶(GAPDH)。最后计算基因相对表达水平(使用2-△△Ct法)。
1.7 蛋白质免疫印迹(Western blot)实验取对数生长期的PC-3 细胞,分成实验组及对照组,其中实验组按白鲜碱剂量分成不同的剂量组(100、200 μmol/L 的白鲜碱)。培养24 h 后,加入细胞裂解液裂解。刮取细胞、超声裂解、低温高速离心后收集上清液。根据说明书提取细胞核蛋白,测蛋白浓度。配置分离胶,分离胶凝固后于上层加入浓缩胶,同时插入梳子制作胶孔。待胶凝固后于胶孔中加入蛋白样品,进行电泳。电泳完成后转膜。加入50 g/L 脱脂奶粉进行摇床封闭90 min。分别加入一抗vimentin(1∶1 000)、E-cadherin(1∶1 000)、β-catenin(1∶1 000)、Snail(1∶1 000)和β-actin 抗体(1∶3 000)置于4 ℃冰箱过夜后,使用TBST 进行洗膜,加入HRP 标记的山羊抗兔抗体(1∶3 000),在室温下避光孵育2 h。洗膜、荧光显影。使用Quantity One 软件扫描并做灰度分析。
1.8 LiCl 和白鲜碱联合处理细胞采用Wnt 通路激活剂LiCl(5 μmol/L)处理细胞3 h 后,使用上述PCR 技术检测相关mRNA 水平。随后取出部分细胞样本,再加入200 μmol/L 白鲜碱作用细胞24 h。剩余样本作为对照组同时进行培养24 h。最后利用上述PCR 技术检测相关mRNA 水平,利用Western blot 检测相关蛋白的表达水平。
1.9 统计学方法采用SPSS 18.0 软件分析数据。正态分布的计量资料以均数±标准差的形式表示,通过独立样本的t检验两两比较,使用方差分析的方法分析多组间数据的比较。以P<0.05表示差异有统计学意义。
2 结果
2.1 不同浓度的白鲜碱对PC-3 细胞增殖的影响将不同浓度的白鲜碱处理PC-3 细胞48 h 后,随着白鲜碱浓度的升高,细胞增殖受到抑制的程度越来越显著,且呈剂量依赖性,其中,PC-3 细胞增殖的半抑制浓度IC50约为200 μmol/L,差异有统计学意义(P<0.01),见图1。
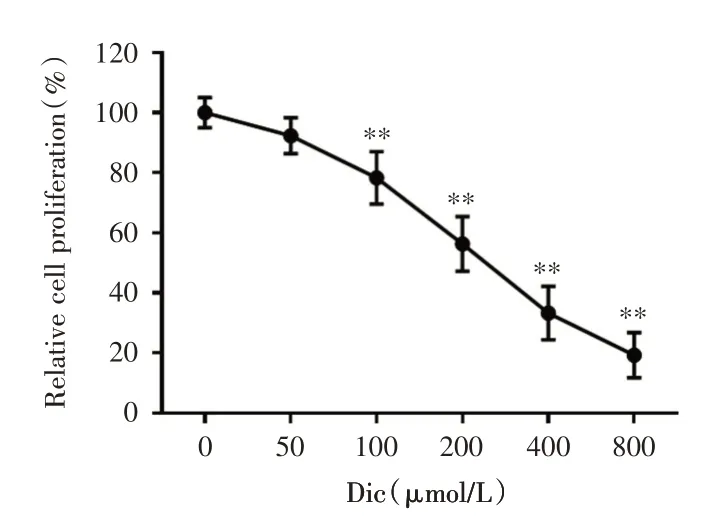
图1 不同浓度白鲜碱对PC-3 细胞增殖的影响Fig.1 Effect of Dic at different concentrations on the proliferation of PC-3 cells
2.2 白鲜碱不同时间处理对PC-3 细胞增殖的影响以特定浓度(200 μmol/L)的白鲜碱处理前列腺癌PC-3 细胞,同时设立空白对照组(无白鲜碱)。培养24、48、72 h 分别检测PC-3 细胞增殖率。通过结果分析,在相同的培养时间里,白鲜碱组的PC-3 细胞增殖比对照组的明显减少,随着时间的推移(48、72 h),两组间的差异越大,白鲜碱组的PC-3 细胞增殖受抑制更明显,且差异均有统计学意义(P<0.01),见图2。
2.3 白鲜碱抑制PC-3 细胞的迁移能力行Transwell 小室迁移实验后,切片染色后置于显微镜下可发现白鲜碱组的目标细胞数明显比对照组的少,且高剂量组比低剂量组的迁移细胞数更少(P<0.01)。证明白鲜碱可抑制PC-3 细胞的迁移能力(图3)。
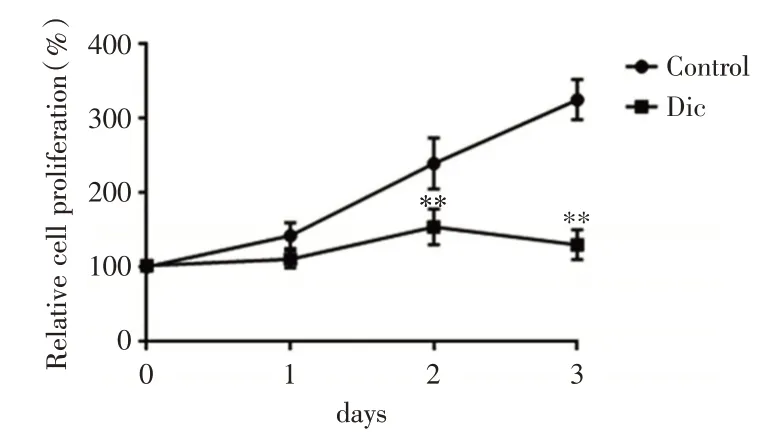
图2 白鲜碱不同时间处理对PC-3 细胞增殖的影响Fig.2 Effect of Dic at different times on the proliferation of PC-3 cells
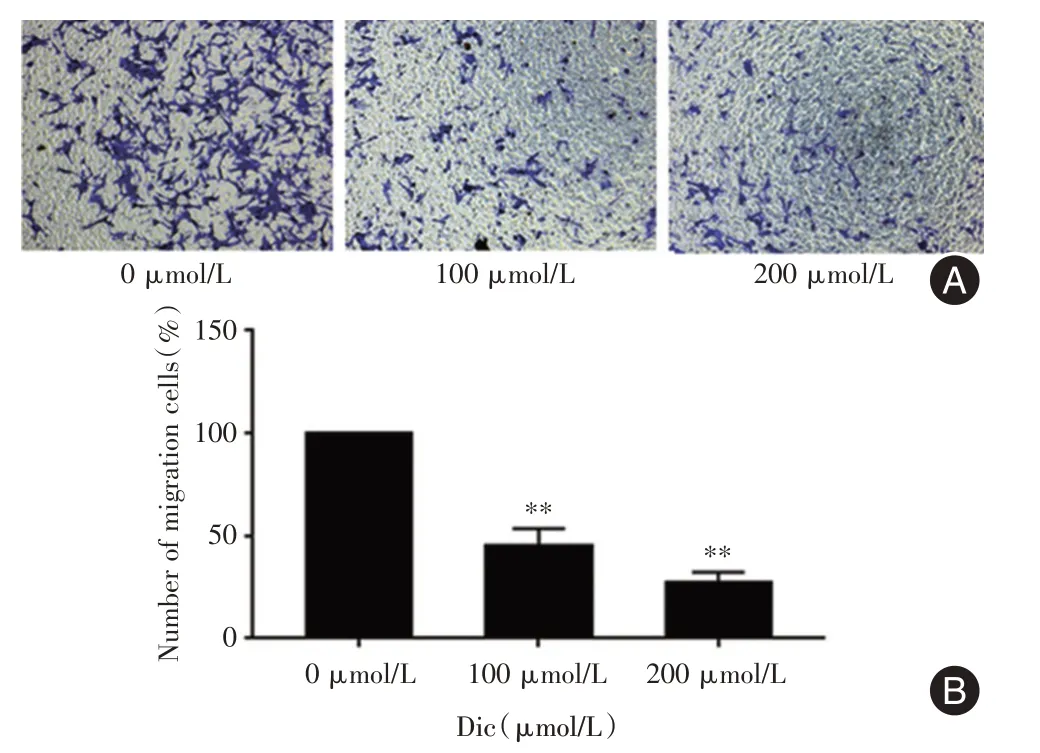
图3 白鲜碱对PC-3 细胞迁移能力的影响Fig.3 Effect of Dic on the migration in PC-3 cells
2.4 白鲜碱抑制PC-3 细胞的侵袭能力根据Transwell 小室实验结果,染色后置于显微镜下可发现白鲜碱组的目标细胞数明显比对照组的少,且高剂量组(200 μmol/L)比低剂量组(100 μmol/L)的侵袭细胞数更少(P<0.01)。证明白鲜碱可抑制PC-3 细胞的侵袭能力(图4)。
2.5 白鲜碱对PC-3 细胞形态影响白鲜碱处理PC-3 细胞后,PC-3 细胞从棒状或长纺锤形的间充质群体变化成短纺锤形或圆形的扁平上皮细胞形态(图5)。
2.6 白鲜碱抑制PC-3细胞EMT的作用为探究白鲜碱抑制PC-3 细胞EMT 作用,选择观察E-cadherin和vimentin 这两种EMT 标志物的表达。PCR 及Western blot 法检测结果表明,100、200 μmol/L 白鲜碱组的E-cadherin mRNA 及蛋白表达水平均比对照组水平高,且差异有统计学意义(P<0.05)。而高剂量组(200 μmol/L)的vimentin 的mRNA 及蛋白表达明显受抑制,与对照组的差异有统计学意义(P<0.01,图6)。可据此推测,白鲜碱具有逆转前列腺癌细胞EMT 作用。
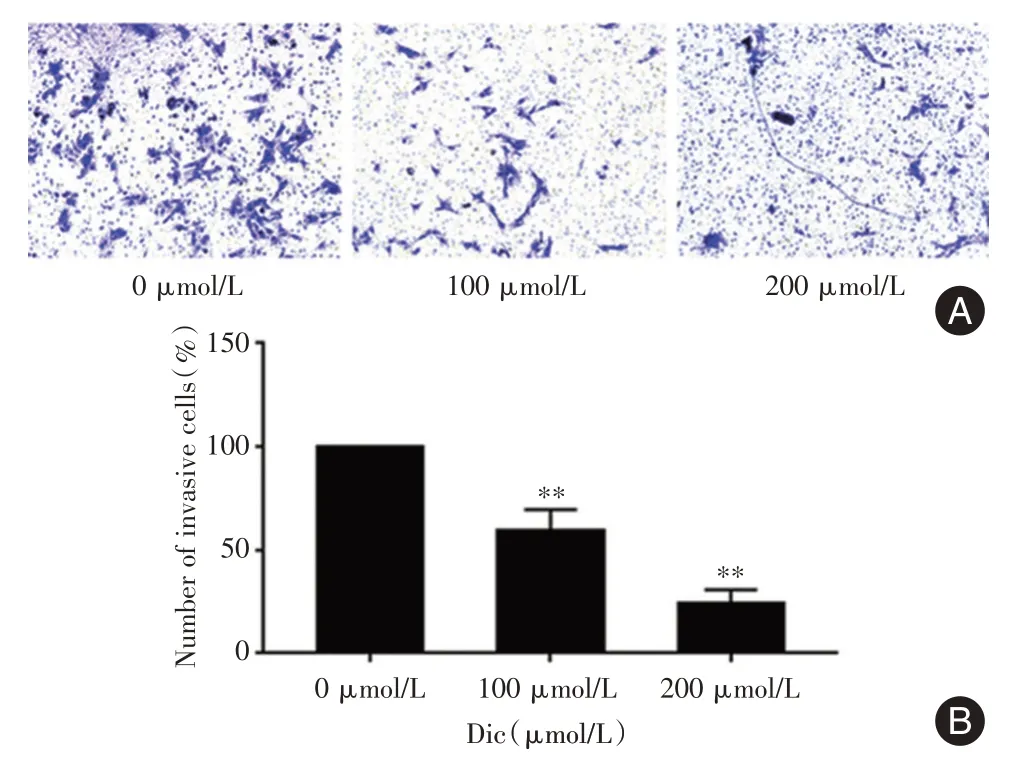
图4 白鲜碱对PC-3 细胞侵袭能力的影响Fig.4 Effect of Dic on the invasion in PC-3 cells

图5 白鲜碱对PC-3 细胞形态影响Fig.5 Influence of Dic on the morphology of PC-3 cells
2.7 白鲜碱抑制Wnt/β-catenin 信号途径与对照组比较,100、200 μmol/L 白鲜碱组β-catenin 和Snail 的mRNA及蛋白表达降低(P<0.05,图6)。与对照组比较,Wnt激活剂LiCl组β-catenin和Snail 的mRNA 及蛋白表达增强(P<0.05,图7)。
与200 μmol/L 白鲜碱组比较,Wnt 激活剂LiCl与白鲜碱联合应用会促进Snail 的mRNA 水平及蛋白的表达,抑制E-cadherin 的mRNA 及蛋白的表达(P<0.01,图8)。
3 讨论
肿瘤转移被认为是引起大多数肿瘤患者死亡的原因之一。肿瘤细胞的迁移、侵袭、抗凋亡和降解的能力有赖于EMT 过程[16-17]。EMT 是上皮细胞恶性肿瘤获得迁移和侵袭能力的重要生物学过程,细胞骨架会转化为以波形蛋白(vimentin)为主,在此过程中细胞黏附分子(如E-钙黏蛋白)会明显减少[18]。E-cadherin 可以阻止细胞侵袭和转移扩散,其表达的下降是EMT 发生的关键因素[19]。
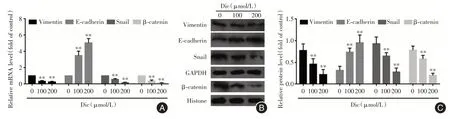
图6 白鲜碱对PC-3 细胞vimentin、E-cadherin、Snail 和β-catenin mRNA 及蛋白表达的影响Fig.6 Effects of Dic on the mRNA and protein expression of vimentin,E-cadherin,snail and β-Catenin in PC-3 cells
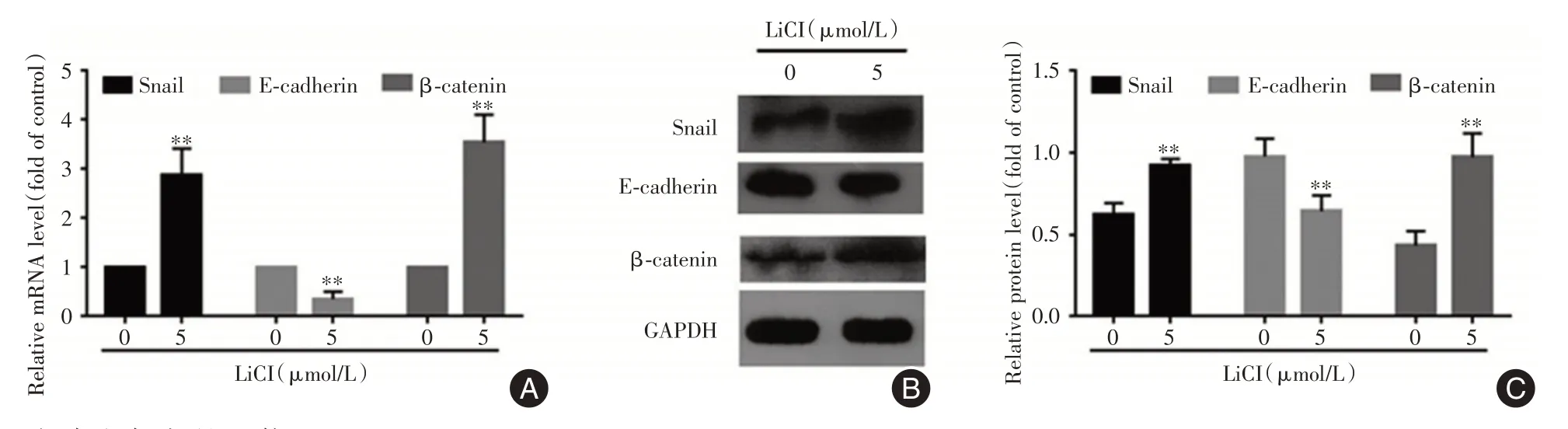
图7 100、200 μmol/L 白鲜碱组对PC-3 细胞Snail 和β-catenin mRNA 及蛋白表达的影响Fig.7 The effects of 100 and 200 μmol/L Dic groups on the mRNA and protein expression of snail and β-Catenin in PC-3 cells
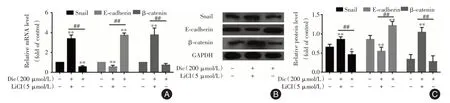
图8 白鲜碱与LiCl 联合作用对PC-3 细胞Snail 和E-cadherin mRNA 及蛋白表达的影响Fig.8 The combined effects of Dic and LiCl on the mRNA and protein expression of snail and E-cadherin in PC-3 cells
白鲜碱作为一种天然生物碱,其在抗肿瘤、抗炎等方面表现出巨大的潜力[20]。实验发现,使用白鲜碱可明显抑制vimentin 的表达,同时促进Ecadherin 的合成。通过模拟迁移及侵袭试验可见,使用白鲜碱的实验组其迁移、侵袭的细胞数较对照组明显减少。且使用白鲜碱的浓度越高,对PC-3 细胞迁移侵袭的能力抑制得更明显。可推断出,白鲜碱通过影响E-cadherin 和vimentin 的表达水平,从而抑制EMT 过程,导致人前列腺癌细胞的增殖及迁移受抑制。
本次研究中发现,在相同的处理时间(1、2、3 d),可发现各时间段的白鲜碱组与对照组相比,前列腺癌PC-3 细胞增殖明显受抑制,且白鲜碱的浓度越大,抑制前列腺癌PC-3 细胞增殖的作用越强,而且受抑制的程度与白鲜碱浓度呈正相关性。而对于同一浓度的白鲜碱组,增加其培养的时间,可发现PC-3 细胞增殖的细胞数上升不明显甚至下降,说明其受抑制的程度与处理时间呈正相关性。
通过观察细胞形态,发现使用白鲜碱处理的PC-3 细胞发生了从棒状或长纺锤形的间充质群体变化成短纺锤形或圆形的扁平上皮细胞形态。随着白鲜碱浓度的增加,其迁移能力及侵袭能力明显下降。因白鲜碱可改变细胞形态变化,且其改变与EMT 的形态改变相反,推断出白鲜碱可能可以抑制或逆转EMT 过程,从而抑制前列腺癌的转移和侵袭。
为探究在前列腺癌细胞中EMT 中信号通路的变化及分子调节,目前发现,最主要的信号通路为Wnt 信号通路[21-22],Wnt 通路的发现为研究EMT 分子变化机制提供了新的方向[23]。对于Wnt 通路的研究表明,β-catenin 是其中最关键的因素之一,该蛋白可与自身免疫细胞(如T 细胞)产生的因子相结合,从而激活Snail 蛋白的合成。而Snail 可在E-cadherin基因上游与之结合,从而抑制启动区域的激活,最终抑制E-cadherin 表达,促进EMT 的发生。本研究分别检测出β-catenin 和Snail 蛋白的表达来探究白鲜碱抑制PC-3 细胞EMT 的分子机制。结果表明,对照组PC-3 细胞的β-catenin 和Snail mRNA 及蛋白表达较高,而白鲜碱组的β-catenin和Snail mRNA 及蛋白表达水平明显下降,所以,可推断出白鲜碱可能通过抑制β-catenin 和Snail蛋白的表达从而控制Wnt 途径,进而抑制EMT 的发生,达到抑制前列腺癌PC-3 细胞的增殖及转移。
为更进一步研究白鲜碱对EMT 抑制作用的机制,采取Wnt 通路激活剂LiCl,研究LiCl 对PC-3 细胞Snail 及E-cadherin 影响,以及联合使用LiCl 与白鲜碱对PC-3 细胞Snail 及E-cadherin 影响。结果表明,通道激活剂LiCl 对Snail 蛋白的表达有着促进作用,从而可抑制E-cadherin 的表达。当使用白鲜碱与Wnt 通路激活剂LiCl 联合处理前列腺PC-3 细胞后,发现LiCl 能够拮抗白鲜碱诱导的Snail 蛋白的表达下调的能力,甚至可促进Snail 的表达,导致E-cadherin 表达下调。
综上所述,本研究发现白鲜碱可抑制人前列腺PC-3 细胞的增殖、迁移与侵袭。其中机制可能通过抑制前列腺癌细胞的EMT,而抑制EMT 的途径可能是通过阻止Wnt/β-catenin/Snail 信号通路。因此,利用白鲜碱这一特性,在此基础上进一步研究,为临床治疗前列腺癌及预防其远处转移开发出新的药物或新的治疗方案。
