基于网络药理学初探川续断皂苷乙的药理作用
2021-03-17霍艳杰何超平全文娟庹勤慧
霍艳杰, 何超平, 全文娟, 陈 煜, 庹勤慧
(湖南中医药大学 1.药学院,2.医学院,3.科技处,湖南省长沙市410208)
续断(DipsacusasperoidesC.Y.ChengetT.M.Ai)来源于川续断科植物川续断的根,具有补肝肾、强筋骨、续折伤、止崩漏等功效[1]。近些年来,川续断皂苷Ⅵ作为续断主要活性成分的研究较为广泛,其具有促进新血管生成[2]、抗炎[3]、抗骨质疏松[4]等作用。川续断皂苷Ⅵ是一类五环三萜齐墩果烷类皂苷化合物[5],与其基本结构母核相同的是川续断皂苷乙(dipsacoside B,DB),DB来源于续断与山银花,在山银花的含量较多,根据五环三萜类化合物具有抗炎、抗肿瘤、抗动脉粥样硬化等多种生物活性的特点[6],推测DB具有较好的药理活性,但其药理作用鲜有报道,探究DB药理作用对开发山银花新的药用价值具有重大意义。网路药理学近些年来发展迅速,可以对中药药物重定位,同时建立“疾病-基因-靶点-药物”相互作用网络分析中药作用机制[7]。在中药单体方面,人参皂苷传统用于心血管领域,在网络药理应用后逐渐向神经保护与抗癌方面发展[8]。对于中药复方的应用,网络药理学对中药的多成分与多靶点对接,符合中医对疾病治疗的整体性[9],在中药的靶点筛选以及作用方面网络的构建有较好的效果。本文采用网络药理学的方法对DB进行靶点的预测,预测靶标采用分子生物学方法验证。
1 材料和方法
1.1 试剂与仪器
血管平滑肌细胞(vascular smooth muscle cells,VSMCs)株(A7R5)购自长沙湘雅中心实验室;FBS(P30-3306)胎牛血清购自Pan公司;DMEM(12800017)购自Gibco公司;姜黄素由湖南中医药大学药学院提供,纯度为98%。血管紧张素Ⅱ(angiotensin Ⅱ,AngⅡ)(A9525-1 mg)、胰蛋白酶(T7409)、MTT(M-2128)购自Sigma公司,EDU细胞增殖检测试剂盒(C0078S)购自碧云天生物公司,DyLight 594红色荧光二抗(E032410)购自Jakson公司,Anti-拓扑异构酶2a(TOP2a)(ab52934)购自Abcam公司,GAPDH抗体(10494-1-AP)、山羊抗兔IgG(H+L)(SA00001-2)购自Proteintech公司,川续断皂苷乙购自南京春秋生物有限公司,纯度>98%。
1.2 DB靶标网络药理学预测
ChemMapper数据库是一个基于分子相似性的靶标预测软件[10],整合多种化合物与蛋白数据库,该数据库具有上万种化合物及生物活性、靶标注释,广泛用于新颖化合物靶点的预测,通过具有评分排序预测靶标。STRING是一个探究基因与基因、基因与蛋白、蛋白与蛋白之间相互作用的数据库。该数据库融合多种数据库信息,可应用于2 031个物种,包含960万种蛋白和1 380万种蛋白质之间的相互作用,可以构建相互作用的网络图,信息挖掘,同时可以作富集分析,对一个蛋白构建相关蛋白的网络,广泛应用于预测蛋白相互作用。
在Pubchem数据库下载DB的结构式,在ChemMapper数据库上以相似评分>0.8,结合DB生物活性库的条件预测DB的靶标,对预测的靶标进行下载。应用IGEMDOCK分子对接软件对DB与靶标进行对接,首先选择活性对接位点,输入化合物进行对接,分析评分确定后续研究对象。
1.3 细胞培养
用含10%FBS的高糖培养基培养VSMCs,置于37 ℃、5%CO2饱和湿度培养箱中培养。
1.4 MTT法检测VSMCs活性
采用MTT法检测细胞活性。取对数生长期的VSMCs,以8×103个/孔种板。同时周边孔加入等体积PBS,避免边缘化效应。培养箱放置24 h后,弃去原培养基,用培养基溶解DB,设置浓度梯度为1、3、10、30、100、300、1 000 μmol/L,同时加入1 μmol/L血管紧张素Ⅱ诱导增殖模型,每个孔加总溶液量100 μL,培养24 h,后弃去,每孔加MTT液100 μL,孵育4 h。随后吸出培养液,每个孔加入150 μL二甲亚砜(DMSO),摇床上避光震摇10 min,在酶标仪上570 nm波长处检测OD值。
1.5 EdU检测VSMCs增殖
采用EdU法检测细胞增殖。取对数生长期细胞,以1×104个/孔细胞接种于96孔板中,培养至正常生长阶段,分为6组(处理细胞24 h):对照组(高糖培养基)、AngⅡ组(1 μmol/L AngⅡ)、姜黄素(curcumin,Cur)+AngⅡ组(5 μmol/L Cur)、DB+AngⅡ组(分别用3、10、30 μmol/L DB处理)。加入100 μL/孔的50 μmol/L EdU标记细胞4 h。去除培养液,100 μL/孔的4%多聚甲醛细胞固定15 min。去除固定液,每孔用1 mL洗涤液洗涤细胞3次,每次3~5 min。去除洗涤液,每孔加100 μL通透液0.3% Triton X-100孵育10~15 min。去除通透液,每孔用100 μL洗涤液洗1~2次,每次3~5 min。每孔加入100 μL Click反应液,轻轻摇晃培养板。室温避光孵育30 min。吸除Click反应液,用洗涤液洗涤3次,每次3~5 min。吸除洗涤液后,每孔加Hoechst 33342溶液100 μL,室温避光孵育10 min。吸除Hoechst 33342溶液。用洗涤液洗涤3次,每次3~5 min。然后进行荧光检测,倒置荧光显微镜(Olympus)图像获取及分析。
1.6 免疫荧光检测蛋白表达
取对数生长期VSMCs,以1×104个/孔接种于24孔板,按相应分组(同1.5)处理24 h。细胞吸干液体,用4%甲醛固定细胞15 min。吸干固定液,用1×PBS漂洗3次,每次5 min。在封闭缓冲液中封闭60 min。在抗体稀释缓冲液中配制一抗TOP2a(1∶1 000)。吸去封闭缓冲液,加入稀释后的一抗,4 ℃孵育过夜。用抗体稀释缓冲液将荧光物质标记的二抗稀释(1∶500),室温下避光孵育1 h。使用DAPI染色10 min,用PBS漂洗3次,每次5 min。倒置荧光显微镜(Olympus)获取图像。
1.7 流式细胞术检测细胞周期
VSMCs以1×105个/孔接种于6孔板,待细胞融合度达到80%后,用含0.3%FBS的培养基同步化处理24 h。接着分为5组处理24 h:对照组(高糖培养基)、AngⅡ组(1 μmol/L AngⅡ处理)、DB+AngⅡ组(分别用3、10、30 μmol/L DB处理)。将无水乙醇-20 ℃预冷,然后用预冷的PBS配成75%乙醇固定液,分装于2 mL EP管,置冰上备用。将细胞中的培养基倒掉,用预冷的PBS洗3遍。用0.25%胰酶消化细胞。在6孔板中加入含10%FBS的培养基,吹打细胞,收集细胞悬液。900 r/min,离心5 min,弃上清,加入2 mL预冷的PBS重悬细胞,再次900 r/min,离心5 min,弃上清。用离心管残留的PBS吹打细胞成悬液,然后加入到预冷的75%乙醇固定液中,吹打均匀。用封口膜将EP管封口,置于4 ℃冰箱固定24 h。送至维尔生物科技公司做流式检测。
1.8 WB法检测蛋白的表达
将细胞以5×108个/L接种于培养皿中,待细胞融合度达到80%后,按相应分组(同1.5)处理24 h。裂解收集细胞蛋白,使用SDS-PAGE凝胶配制试剂盒配置10%SDS-聚丙烯酰胺凝胶;上样孔加样20 μL。电泳100 V、100 min,将PVDF膜置于胶上湿转法转膜,电流300 mA,时间2 h。PVDF置入含5%脱脂奶粉的TBS-T中,常温45 min;TBS-T洗涤5 min×3次,孵育一抗,一抗和一抗稀释液比例为1∶2 000,在4℃孵育12 h;利用TBS-T洗涤10 min×3次;二抗山羊抗兔IgG(H+L)与TBS-T比例为1∶5 000,室温孵育1 h;用TBS-T洗涤10 min×3次;显影液均匀滴加在PVDF膜上,曝光30 s、显影定影;采用Alpha Imager 2200灰度扫描软件进行密度分析。
1.9 统计学方法
2 结 果
2.1 ChemMapper数据库预测结果
在ChemMapper数据库中对DB的靶标蛋白预测评分>0.8,得到4个靶标,分别是兔来源的糖原磷酸化酶(glycogen phosphorylase,PYGM)、绵羊来源的环氧合酶1(cyclooxygenase 1,PTGS1),以及人来源的DNA拓扑异构酶2a(topoisomerase 2a,TOP2a)和凋亡调节蛋白Bcl-xL(apoptosis regulator Bcl-xL,BCL-xL)(表1)。

表1 ChemMapper数据库对DB靶标预测结果
2.2 iGEMDOCK分子对接结果
iGEMDOCK对接靶标蛋白与DB,其中TOP2a(图1A)、BCL-xL(图1B)、PYGM(图1C)、PTGS1(图1D)能量值分别为-84.7 kJ/mol、-70.9 kJ/mol、-63.6 kJ/mol、-79.5 kJ/mol。图1表示DB与相关蛋白氨基酸残基的连接位点,能量值越低表示对接越稳定,选取TOP2a作为后续研究靶点。
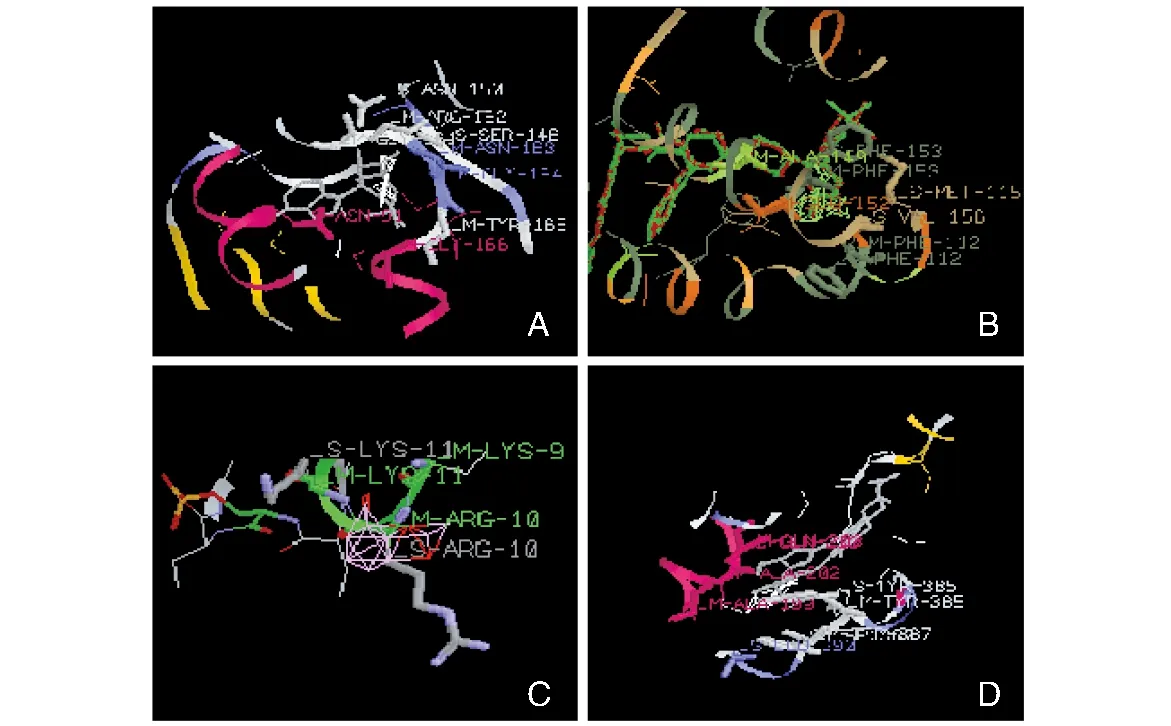
图1 4种靶标蛋白与DB分子对接结果A为DB与TOP2a对接图;B为DB与BCL-xL对接图;C为DB与PYGM对接图;D为DB与PTGS1对接图。
2.3 STRING数据库预测靶点蛋白结果
在STRING预测结果,TOP2a与10种蛋白之间存在相互作用,节点数为11,边数为47,平均节点数8.55,P<0.001。在Cytoscape中分析关键靶点,TOP2a在网络中为调控相关蛋白的关键靶点(图2A)。
TOP2a相关蛋白的靶基因GO分析,排名前5的生物过程分别为有丝分裂细胞周期、细胞分裂、有丝分裂细胞周期过程、核分裂、染色体分离。分子功能具有三磷酸腺苷结合、蛋白丝氨酸/苏氨酸激酶活性、DNA拓扑异构酶活性、作用于蛋白质的催化活性、细胞周期素依赖性蛋白丝氨酸/苏氨酸激酶活性。细胞中的定位在DNA拓扑异构酶复合物、核、细胞器、主轴、微管组织中心(图2B)。
TOP2a相关蛋白的靶基因在KEGG通路分析中作用在泛素介导的蛋白水解、p53信号传导途径、孕酮介导卵母细胞成熟、卵母细胞减数分裂、细胞周期(图2C)。
GO分析与KEGG通路分析显示,TOP2a作为关键靶点调控细胞周期与细胞分裂过程,因此,TOP2a参与细胞的周期与增殖。
2.4 DB对VSMCs活性和增殖率的影响
MTT结果显示,DB对VSMCs没有细胞毒性。与对照组比较,AngⅡ可以促进VSMCs活性(P<0.01)。与AngⅡ组比较,3~1 000 μmol/L DB+AngⅡ组VSMCs的活性均降低,可见DB对VSMCs的细胞活性具有明显抑制作用,并具有浓度依赖性(表2)。EdU结果显示,与对照组比较,AngⅡ可以提高VSMCs的增殖率(P<0.01)。与AngⅡ组比较,Cur与DB对VSMCs增殖率具有明显抑制作用(表2)。
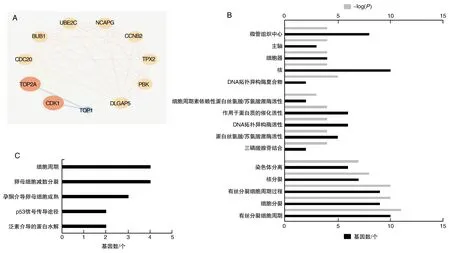
图2 TOP2a相关蛋白GO与KEGG分析A为TOP2a相关蛋白网络图;B为TOP2a相关蛋白GO富集分析图;C为TOP2a相关蛋白KEGG通路分析图。

表2 DB对VSMCs 活性和增殖率的影响(n=6)
2.5 DB对VSMCs周期的影响
与对照组比较,AngⅡ组VSMCs中G1期细胞明显降低,S期细胞明显升高(P<0.05)。与AngⅡ组比较,不同浓度(3、10、30 μmol/L)DB+AngⅡ组G1期细胞明显升高(P<0.05),S期细胞明显降低(P<0.05),DB可能阻滞VSMCs的G1期向S期合成,进而影响细胞增殖(图3,表3)。
2.6 DB对TOP2a蛋白表达的影响
与对照组比较,AngⅡ组VSMCs中TOP2a明显上调,与AngⅡ比较,Cur+AngⅡ组与不同浓度(3、10、30 μmol/L)DB+AngⅡ组下调VSMCs中TOP2a的表达(图4)。

图3 流式细胞术测DB对VSMCs周期的影响

表3 DB对VSMCs周期的影响(n=3)
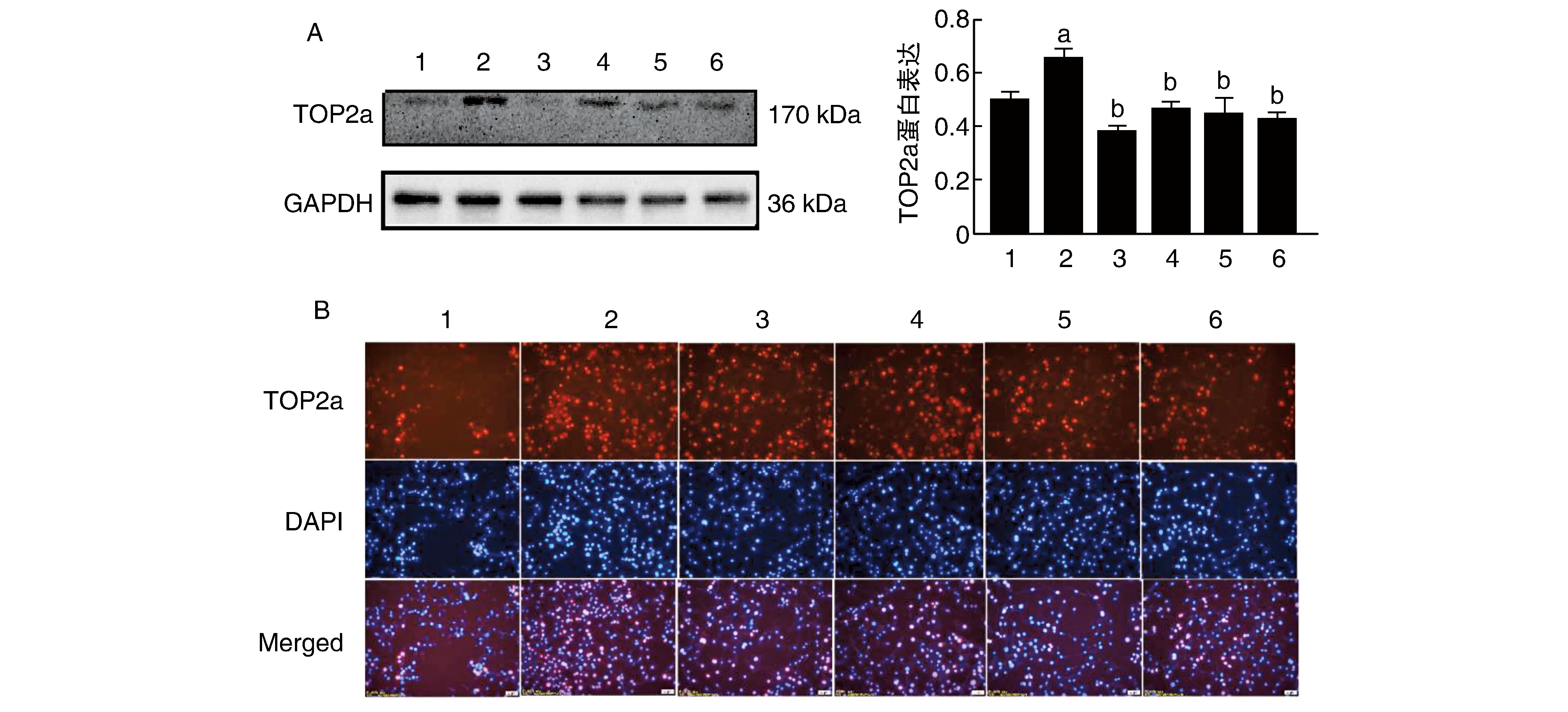
图4 DB对TOP2a蛋白表达的影响(n=3)A为Western blot法测TOP2a蛋白表达的变化;B为免疫荧光法测TOP2a蛋白表达的变化(200×)。1为对照组;2为AngⅡ组;3为Cur+AngⅡ组;4为DB(3 μmol/L)+AngⅡ组;5为DB(10 μmol/L)+AngⅡ组;6为DB(30 μmol/L)+AngⅡ组。a为P<0.05,与对照组比较;b为P<0.05,与AngⅡ组比较。
3 讨 论
本文尝试用网络药理学中靶点预测的方式来探究DB潜在的生物活性靶点。实验结果表明,DB具有抑制VSMCs增殖的作用。VSMCs在动脉粥样硬化形成中具有积极与消极的双重影响,VSMCs可以维持斑块的稳定性[11],同时当VSMCs表型转换为合成型时促进泡沫细胞的生成以及动脉壁的狭窄[12]。控制VSMCs的异常增殖对防治动脉粥样硬化具有积极的意义。
DB预测靶点中,TOP2a参与细胞DNA复制、转录和有丝分裂等重要的生命过程,根据iGEMDOCK分子对接结果,能量值越低表示对接越稳定,选择TOP2a作为后续研究对象。GO分析中,可见TOP2a相关蛋白在生物过程参与细胞分裂与细胞周期,KEGG分析中,TOP2a相关蛋白调控细胞周期与细胞分裂通路,结合关键靶点分析,推测TOP2a作为关键靶点调控细胞周期与细胞分裂过程,进而促进细胞增殖。
在脊椎动物中,TOP2a蛋白的产生和降解与细胞周期、增殖功能相关,尤其在快速增殖期细胞中含量较高[13]。TOP2a表达水平在有丝分裂中期增加,在有丝分裂完成后迅速下降[14]。在复制和转录等过程中,TOP2a改变DNA的超螺旋性和解开双链DNA片段,正螺旋的DNA具有较好的作用[15],通过识别DNA序列,以共价键的方式将酪氨酸(Tyr)与DNA 5′断端的磷酸基结合,改变DNA的拓扑结构,从而催化DNA分子链的连接[16]。
本文结果显示,DB抑制VSMCs增殖具有显著效果,Western blot结果表明DB下调蛋白TOP2a表达水平。流式结果显示,DB可能阻滞VSMCs的G1期向S期合成,进而影响细胞增殖。DB可能通过下调TOP2a表达调控细胞周期,抑制VSMCs的增殖。Wang等[17]发现,Hela细胞中过表达TOP2a,p-Akt表达升高,促进细胞的增殖与迁移。Zhang等[18]研究表明,结肠癌细胞中敲除TOP2a,Akt的磷酸化水平降低,显著抑制细胞的增殖与迁移。因此推测DB下调TOP2a表达并可能抑制Akt的磷酸化。
有研究显示,替尼泊甙作为TOP2a的抑制剂,可以激活巨噬细胞ATP结合盒转运子A1的表达和游离胆固醇流出,表明TOP2a抑制剂可能表现出抗动脉粥样硬化的特性[19]。Wang等[20]研究发现,替尼泊甙通过调节p53-骨形态发生蛋白2(bone morphogehetic protein 2,BMP2)信号通路而减少血管钙化,提示抑制TOP2a具有抗动脉粥样硬化性。但是,TOP2a抑制剂普遍具有一定的心脏毒性作用[21],那么筛选出抑制TOP2a的化合物并无心脏毒性,对TOP2a抑制剂在心血管与癌症应用中具有积极意义。目前,DB并无毒性作用的报道,其在体内体外实验中均无溶血现象[22],具有一定的安全性。
综上所述,DB可能抑制TOP2a表达,调控细胞周期,进而抑制VSMCs的增殖,DB在抗动脉粥样硬化应用中具有一定的潜力。
