miR-1290与RASAL2基因靶向关系的探索
2021-03-17杨晓燕雷小勇
谭 芳, 胡 娟, 李 擎, 杨晓燕, 雷小勇
(南华大学湖南省分子靶标新药研究协同创新中心 南华大学药物药理研究所,湖南省衡阳市421001)
RASAL2蛋白是由RASAL2基因编码的一种RAS-GTP酶活性蛋白(RAS GTPase activating protein, RASGAP)[1]。RASGAP主要负责促进RAS基因RASGTP酶的活性,既往研究发现人类20%~30%的肿瘤发生是由于RAS突变而导致的三磷酸鸟苷(guanosine triphosphate, GTP)水解发生障碍[2-4]。 而RASAL2作为RAS基因的一个重要的活性蛋白,主要作为一个抑癌因子参与肿瘤进展。然而,调控RASAL2表达的具体机制尚不清楚。
微小核糖核酸(microRNA, miRNA)作为一类单链非编码RNA,长度约为22个核苷酸,具有高度保守性。研究发现,miRNA主要通过与靶基因mRNA的3′-非翻译区(3′-untranslated region,3′-UTR)碱基互补配对,来阻碍靶基因mRNA翻译成蛋白质或导致其降解,这属于在转录后水平的一种调控基因表达的方式[5-8]。大量研究表明,miRNA 在肿瘤细胞增殖、凋亡、转移、耐药等各种生理病理过程中发挥关键作用[9-11]。本课题组通过在线数据库Targetscan发现,RASAL2 3′-UTR可能存在与miR-1290互补配对的结合序列。miR-1290在肿瘤细胞中表达异常,参与了多种恶性肿瘤的发生发展。研究发现,miR-1290能够与hMSH2、FOXA1、NFIX等多种基因3′-UTR区结合进而调控相关基因的表达[12-14]。然而,miR-1290与RASAL2之间是否存在靶向调控机制还不清楚。因此,本研究以miR-1290为研究对象,采用双荧光素酶报告基因系统来证实其与RASAL2基因的靶向关系,希望能为miR-1290在肿瘤中调控机制的研究工作奠定基础。
1 材料和方法
1.1 实验材料
人肾上皮细胞293T购自中国科学院典型培养物保藏委员会细胞库;引物合成委托上海捷瑞生物工程有限公司完成;TOP10感受态细胞、GV272载体及miR-1290质粒均购于上海吉凯基因。主要试剂:高糖培养基(dulbecco’s modified eagle medium,DMEM)(Corning cellgro)、胎牛血清和Opti-MEM培养基购自Gibco公司;X-tremeGENE HP DNA Transfection Reagent购自Roche公司;Trizol试剂购自Invitrogen公司;T4 DNA连接酶和限制性内切酶XbaI/XbaI均为New England Biolabs公司产品;荧光定量PCR试剂盒为TaKaRa公司产品;无内毒素质粒小提中量试剂盒购自天根生化科技有限公司;双荧光报告检测系统购自Promega公司。
1.2 仪器
CO2培养箱(cat.No: MCO-175,SANYO);荧光显微镜(cat.No: IX71,奥林帕斯);离心机(cat.No: Fresco 21,赛默飞世尔科技有限公司);酶标仪(cat.No: M2009PR,Tecan infinite);倒置显微镜(cat.No: XDS-100,上海蔡康光学仪器有限公司)。
1.3 生物信息学软件预测miR-1290的靶基因
利用Targetscan数据库搜索与miR-1290种子区匹配的保守位点,预测miR-1290的潜在靶基因。
1.4 野生型与突变型RASAL2双荧光素酶报告基因质粒的构建
利用NCBI数据库获取RASAL2基因3′-UTR碱基序列,交由上海捷瑞生物工程有限公司合成相应的扩增引物序列,RASAL2上游引物:5′-GAGGAGTTGTGTTTGTGGAC-3′,下游引物:5′-GACGATAGTCATGCCCCGCG-3′。提取293T细胞总RNA,反转录反应得到基因组DNA,进行PCR扩增反应最终合成3′-UTR序列片段,利用XbaI/XbaI内切酶在相应识别点进行酶切、纯化后,与GV272载体连接。然后重新将质粒转化至TOP10感受态细胞,鉴定阳性克隆转化子,并用含氨苄霉素的LB液体培养基在37 ℃培养箱中培养12~16 h,进行琼脂糖凝胶电泳纯化回收。取适量菌液进行测序鉴定。
1.5 双荧光素酶活性检测
将呈指数式生长的293T细胞消化并吹打成悬液,并接种于24孔培养板中,每孔接种细胞数为105个,置于37 ℃、5% CO2培养箱中至细胞融合度约60%~70%,参照X-tremegene HP转染试剂说明书进行转染操作:①将X-tremegene HP转染试剂和质粒按每孔1 μg∶2 μL的比例移至100 μL opti-MEM中,充分混匀,静置20 min;②弃掉培养板中旧培养基,将转染试剂X-tremegene HP混合液与质粒移至细胞培养板,孵育5~6 h后,每孔补加培养基(含10% FBS)200 μL。③48 h后,弃全部培养液,并加入1× Passive Lysis Buffer 300 μL,4 ℃条件放置20 min,使293T细胞裂解完全,轻轻地震荡3~5 min,混匀后,吸取40 μL细胞裂解液,加入20 μL Luciferase Assay Reagent,于检测板中再次震荡,上机检测荧光素酶活性;④检测完毕后,向每孔中加入20 μL Stop & Glo®Reagent,混匀后,静置3 min,检测海肾荧光酶活性,接着进行结果定量分析。
1.6 统计学分析
2 结 果
2.1 miR-1290与RASAL2 3′-UTR互补结合位点预测
通过在线数据库Targetscan预测RASAL2是否为miR-1290可能的靶基因,结果发现,miR-1290与RASAL2 3′-UTR存在碱基互补序列,是一个潜在结合位点(图1)。

图1 miR-1290与RASAL2互补结合的靶位点
2.2 PCR扩增与酶切产物鉴定
琼脂糖凝胶电泳实验表明,野生型GV272-RASAL2-wt 3′-UTR及突变型GV272-RASAL2-mut 3′-UTR双荧光素酶报告质粒PCR扩增产物片段大小一致,代表质粒构建成功(图2)。经XbaI/XbaI内切酶酶切后,载体片段和不同长度的启动子片段相对分子质量均一致,说明质粒被成功构建(图3)。

图2 RASAL2基因3′-UTR重组质粒PCR琼脂糖电泳结果M为DNA Marker;1为RASAL2-wt 3′-UTR PCR扩增物;2为RASAL2-mut 3′-UTR PCR扩增物。
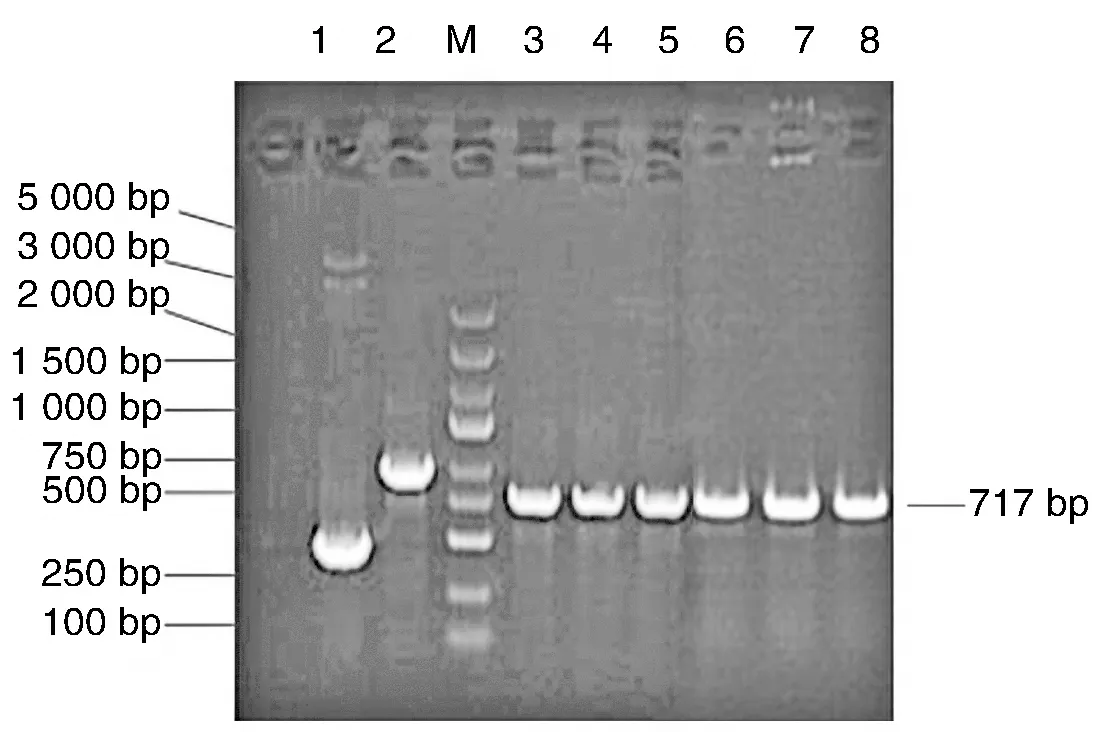
图3 荧光素酶报告基因质粒琼脂糖电泳结果1为空载体-阴性对照;2为GAPDH-阳性对照;M为Marker;3~5为RASAL2野生型重组质粒酶切产物;6~8为RASAL2突变型重组质粒酶切产物。
2.3 RASAL2基因野生型及突变型报告质粒测序结果
通过比较图4中的RASAL2基因3′-UTR野生型测序峰图和图5 RASAL2基因3′-UTR突变型部分测序峰图可知,已成功将靶序列AAAATCC(6245~6252)突变为CCCCGAA。说明两种质粒构建成功。
2.4 双荧光素酶活性验证
如图6所示,与野生型质粒(GV272-RASAL2-wt 3′-UTR)+miR-NC组相比,野生型质粒(GV272-RASAL2-wt 3′-UTR)+miR-1290组的相对荧光素酶活性差异无显著性(P=0.053),说明miR-1290不能与RASAL2基因3′-UTR结合,进而无法抑制其表达;而突变型质粒(GV272-RASAL2-mut-3′-UTR)+miR-1290组的相对荧光素酶活性相较于突变型质粒(GV272-RASAL2-mut 3′-UTR)+miR-NC组无显著变化。以上说明miR-1290与miR-NC均无法抑制突变型质粒荧光素酶活性。

图4 RASAL2基因3′UTR野生型部分测序图
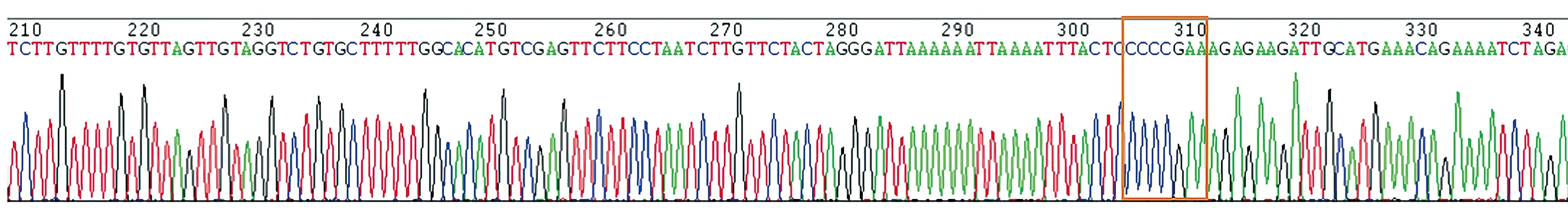
图5 RASAL2基因3′UTR突变型部分测序图
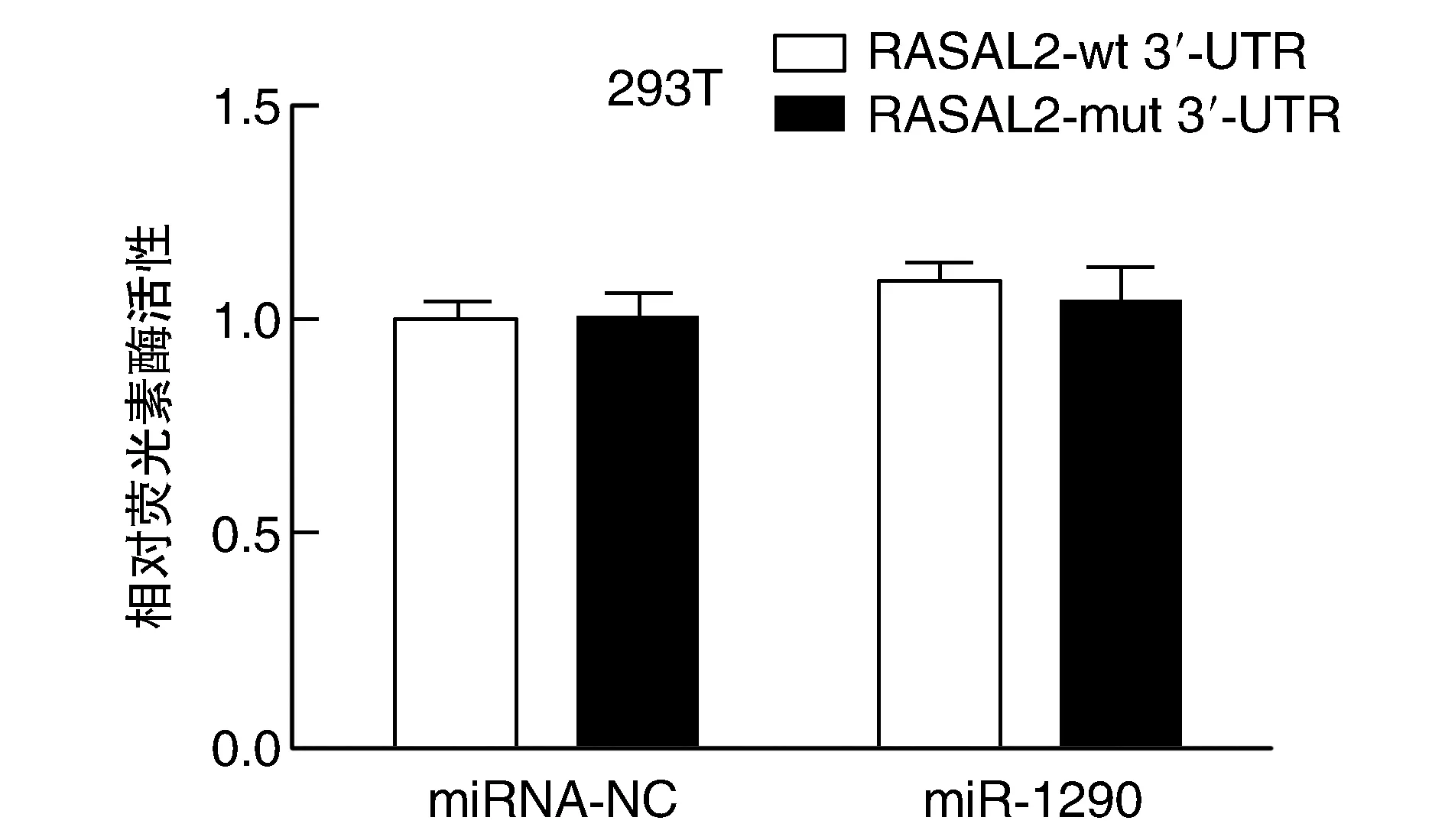
图6 miR-1290对RASAL2基因3′-UTR相对荧光素酶活性的影响
3 讨 论
RASAL2蛋白在肿瘤发生发展中通常作为一种抑癌因子发挥作用。然而,调控RASAL2表达的机制尚不清楚。因此,本研究借助在线预测数据库寻找到一些对RASAL2基因具有靶向调控作用的miRNA。近年来,随着测序技术的发展,更多的miRNAs被发现,但对于它在疾病中的调控机制和生物学功能仍值得深究[15]。一些研究证实,一个miRNA 可与多种mRNA结合,而不同miRNA也可能竞争同个mRNA结合位点。近年来, miRNA在肿瘤发展中的关键作用得到重视。miR-1290在急性淋巴细胞白血病、肺癌及胃癌等多种恶性肿瘤中均发挥抑制作用[13,16-17]。因此,成功预测并验证调控RASAL2基因表达水平的miRNAs,进一步阐明其在胃癌中调控机制及对胃癌细胞的表型影响,这将有利于胃癌的临床治疗,并为发现新的肿瘤标志物及分子靶点提供思路。
双荧光素酶报告基因检测和蛋白免疫印迹是目前较常用于miRNA靶基因验证的方法[18-19]。本研究采用生物信息学预测方法,结合荧光素酶报告基因实验验证,通过将目的基因RASAL2 3′-UTR序列插入GV272载体,利用miRNA阴性对照及靶基因RASAL2 3′-UTR结合位点定点突变,通过检测荧光素酶活性来验证miR-1290与RASAL2 3′-UTR结合情况。结果表明:miR-1290对RASAL2基因 3′-UTR荧光素酶活性无明显抑制,初步证实了RASAL2与miR-1290不存在靶向关系。因此,RASAL2的抑癌作用可能是通过其他调控机制或受miR-1290的间接调控,而并非靶向调控。
本研究成功构建了RASAL2基因3′-UTR的双荧光素酶报告载体,并确证了miR-1290与RASAL2基因不存在直接靶向关系。
