LRP11在宫颈癌中表达及其与HPV感染和肿瘤进展的关系
2021-03-17曹晓丽苏世文
曹晓丽, 苏世文, 贾 英
(1.重庆市壁山区中医院, 重庆市402760;2.重庆医科大学附属第一医院,重庆市 400042)
宫颈癌是临床最常见的妇科恶性肿瘤,其发病率和病死率位居中国女性恶性肿瘤第2位,仅次于乳腺癌,30~35岁为原位癌的高发年龄,45~55岁为浸润癌的高发年龄[1]。随着人们生活和饮食习惯的改变,宫颈癌年轻化趋势日渐明显[2]。据调查显示,全球每年宫颈癌新发病例数约52.9万,死亡病例数约20.0万,而中国每年宫颈癌新发病例数约13.2万,死亡病例数约3.0万[3]。目前临床采用手术结合放化疗的综合治疗方案,能够缩小肿瘤病灶,改善临床症状,延长患者生存时间,但仍有部分患者因远处转移或者局部复发导致治疗失败,预后结局差[4-5]。因此研究宫颈癌的发病机制对于寻找新的诊治靶点有着重要意义。人乳头瘤病毒(human papilloma virus,HPV)已被证实是宫颈癌的首要致病因素,与宫颈癌发生及进展关系十分密切[6]。低密度脂蛋白受体相关蛋白11(low density lipoprotein receptor-related protein 11,LRP11)是一种跨膜蛋白,可通过内吞脂蛋白颗粒调控脂质稳态,还可参与血管通透性调节、细胞增殖、细胞侵袭等生命活动[7]。以往研究显示,LRP11在乳腺癌、尿路上皮癌、结肠癌、甲状腺癌等肿瘤发生和发展中发挥重要作用[8],但它是否参与宫颈癌的发生及进展尚不清楚。因此,本研究分析了LRP11在宫颈癌中的表达及其与HPV感染和肿瘤进展的关系,以期为宫颈癌的防治提供新的思路。
1 材料和方法
1.1 仪器与试剂
EMS5000系列振动组织切片机(湖南远湘生物科技有限公司);CKX31倒置显微镜(北京埃克森科技有限公司);CytoFLEX S流式细胞仪(北京普瑞麦迪实验室技术有限公司);BIOTEK全自动酶标仪(上海必优生物科技有限公司);MiniChemiⅡ凝胶成像仪(北京赛智创业科技有限公司);兔抗人LRP11单克隆抗体(北京诺博莱德科技有限公司);羊抗鼠IgG(广州硕恒生物科技有限公司);DAB显色试剂盒(上海觅拓生物科技有限公司);BCA试剂盒(北京绿百草科技发展有限公司);一抗LRP11(上海武昊生物科技有限公司);一抗β-actin(上海妍琦生物科技有限公司);HRP标记的山羊抗兔IgG二抗(杭州联科生物技术股份有限公司);超敏型ECL化学发光液(上海晶抗生物工程有限公司);pEGFP-N1质粒、pEGFP-N1-LRP11质粒(湖南丰晖生物科技有限公司);CCK-8增强型溶液(深圳市纽邦生物技术有限公司);Annexin V-FITC(上海三抒生物科技有限公司);PI染液(上海三抒生物科技有限公司)。
1.2 组织标本收集
收集2017年1月—2020年1月本院123例宫颈癌手术患者的癌组织及癌旁正常组织,其中HPV阴性25例,HPV阳性98例。入组标准:未经过放疗或化疗等抗癌治疗;未合并其他恶性肿瘤或影响生存期的全身性疾病;具有完整的病例资料和随访资料。其中癌组织中HPV阴性或HPV阳性通过PCR-DNA反向杂交实验证实,操作如下:取石蜡包埋癌组织标本依据试剂盒说明书进行HPV-DNA提取、PCR扩增、杂交、洗膜、显色。结果判读阳性质控品杂交膜条出现在HPV基因型位点或IC位点呈现蓝色,其余位点都不显色;阴性结果:IC位点和其余位点均不显色。HPV检测分型为高危型。
1.3 细胞培养及分组
HPV阳性人宫颈癌细胞系Hela,购于上海北诺生物科技有限公司;HPV阴性人宫颈癌细胞系C33A,购于上海澳音生物科技有限公司;人正常宫颈上皮细胞系HUCECs,购于上海雅吉生物科技有限公司。3种细胞用含0.1 mmol/L胎牛血清的DMEM培养基,在37 ℃、5% CO2饱和湿度温箱中培养传代,取对数生长期的细胞用于各实验。
将Hela细胞分为对照组、空质粒组、LRP11质粒组,参照LipofectamineTM2000转染说明书,空质粒组转染8 μg pEGFP-N1质粒,LRP11质粒组转染8 μg pEGFP-N1-LRP11质粒,对照组不进行任何转染处理,完成上述操作后继续培养48 h。
1.4 免疫组织化学染色
采用免疫组织化学染色法检测癌旁正常组织、HPV阴性宫颈癌组织、HPV阳性宫颈癌组织中LRP11蛋白表达水平。将各组织用EMS5000系列振动组织切片机4 μm连续切片,二甲苯脱蜡,柠檬酸钠缓冲液抗原修复,PBS缓冲液漂洗,内源性过氧化物酶灭活,加山羊血清封闭,滴加稀释比例为1∶200的兔抗人LRP11单克隆抗体,4 ℃孵育过夜,PBS漂洗,滴加稀释比例为1∶400的羊抗鼠IgG,37 ℃孵育20 min,PBS漂洗,使用DAB显色试剂盒进行显色5 min,PBS终止反应,苏木精复染,梯度乙醇脱水,中性树脂固封剂封固,由两位经验丰富的病理科医生在双盲情况下应用显微镜观察阳性细胞率和着色程度。参照董頔等[9]免疫组化评分标准,取两项得分之积,最终得分0~3分判定为阴性,最终得分>3分判定为阳性。
1.5 Western blot法
采用Western blot法检测HUCECs细胞、C33A细胞、Hela细胞中LRP11蛋白表达量。取培养的HUCECs细胞、C33A细胞、Hela细胞,用细胞裂解液裂解,抽提蛋白,采用BCA试剂盒检测蛋白水平,蛋白经10%SDS-PAGE分离后,转移至PVDF膜上,用5%脱脂奶粉溶液在摇床上室温封闭2 h,加入一抗LRP11(1∶500)、一抗β-actin(1∶400),4 ℃孵育过夜,用PBST洗涤3次,再加入HRP标记的山羊抗兔IgG二抗(1∶4 000),室温孵育2 h,用PBST洗涤3次,用超敏型ECL化学发光液检测蛋白条带,用MiniChemiⅡ凝胶成像仪采集图像,用Image J软件扫描灰度值,分析结果。
采用Western blot法检测各组Hela细胞中LRP11蛋白表达量,取转染后的各组Hela细胞,操作方法同上。
1.6 CCK8法
采用CCK8法检测各组Hela细胞增殖率。取转染后的各组Hela细胞,接种于96孔培养板(每孔100 μL培养基),5×103个/孔细胞培养48 h,加入CCK8增强型溶液(每孔10 μL),避光孵育2 h,在BIOTEK全自动酶标仪450 nm处测定吸光度值,计算Hela细胞增殖率,Hela细胞增殖率(%)=(吸光度值处理组/吸光度值对照组)×100%。
1.7 Transwell小室侵袭实验
采用Transwell小室侵袭实验检测各组Hela细胞的侵袭能力。取转染后的各组Hela细胞,制成细胞悬液,在Transwell小室的上室铺入基质胶(每孔60 μL,37 ℃成胶),加入细胞悬液(1×103个/孔),在Transwell小室的下室中加入600 μL含10%胎牛血清的DMEM培养基,37 ℃培养24 h,取出Transwell小室,弃掉上室液体,90%乙醇常温固定30 min,风干之后用0.1%结晶紫常温染色10 min,用PBS漂洗3次,在CKX31倒置显微镜下随机选取4个视野进行拍照,并计算穿过小室膜的Hela细胞数。
1.8 流式细胞术
采用流式细胞术检测各组Hela细胞的凋亡率。取转染后的各组Hela细胞,用4℃预冷PBS溶液洗涤细胞3次,用1×Tris Buffer缓冲液(250 μL)重新悬浮细胞至1×109个/L,然后加入Annexin V-FITC(3 μL)、PI染液(10 μL),充分混匀,避光反应15 min,用CytoFLEX S流式细胞仪检测Hela细胞的凋亡率。
1.9 统计学方法
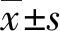
2 结 果
2.1 癌旁正常组织、HPV阴性宫颈癌组织、HPV阳性宫颈癌组织中LRP11蛋白表达水平的比较
LRP11蛋白主要表达于细胞质。LRP11在癌旁正常组织、HPV阴性宫颈癌组织、HPV阳性宫颈癌组织中阳性表达率分别为10.57%(13/123)、52.00%(13/25)、75.51%(74/98),3组之间LRP11阳性表达率比较差异有统计学意义(χ2=96.830,P<0.001),其中HPV阴性宫颈癌组织中LRP11阳性表达率高于癌旁正常组织(χ2=24.628,P<0.001),HPV阳性宫颈癌组织LRP11阳性表达率高于癌旁正常组织(χ2=96.369,P<0.001),HPV阳性宫颈癌组织LRP11阳性表达率高于HPV阴性宫颈癌组织(χ2=5.318,P=0.02;图1)。

图1 癌旁正常组织、HPV阴性宫颈癌组织、HPV阳性宫颈癌组织中LRP11蛋白表达水平的比较(免疫组化染色,400×)
2.2 HUCECs细胞、C33A细胞、Hela细胞中LRP11蛋白表达量的比较
HUCECs细胞、C33A细胞、Hela细胞中LRP11蛋白表达量比较,差异有统计学意义(F=22.810,P=0.002),其中C33A细胞LRP11蛋白表达量高于HUCECs细胞(Q=4.033,P<0.01),Hela细胞LRP11蛋白表达量高于HUCECs细胞(Q=9.514,P<0.01),Hela细胞LRP11蛋白表达量高于C33A细胞(Q=5.481,P<0.01;图2)。
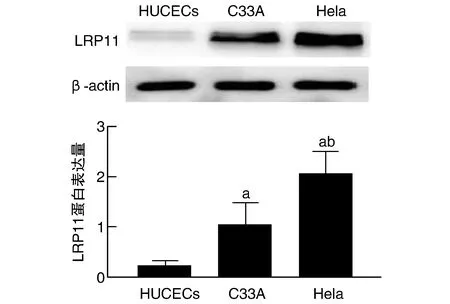
图2 HUCECs细胞、C33A细胞、Hela细胞中LRP11蛋白表达量的比较a为P<0.01,与HUCECs细胞比较;b为P<0.01,与C33A细胞比较。
2.3 各组Hela细胞中LRP11蛋白表达量的比较
LRP11质粒组Hela细胞中的LRP11蛋白表达量较对照组和空质粒组高,差异具有统计学意义(Q=6.992、6.912,P均<0.01);空质粒组Hela细胞中的LRP11蛋白表达量较对照组差异无统计学意义(Q=0.080,P>0.05;图3)。
图3 各组Hela细胞中LRP11蛋白表达量的比较a为P<0.05,与对照组和空质粒组比较。
2.4 各组Hela细胞增殖率和凋亡率的比较
LRP11质粒组Hela细胞增殖率较对照组和空质粒组高,差异具有统计学意义(Q=43.075、42.568,P均<0.01)。LRP11质粒组Hela细胞凋亡率较对照组和空质粒组低,差异具有统计学意义(Q=9.868、10.541,P均<0.05),空质粒组Hela细胞增殖率和凋亡率较对照组差异无统计学意义(Q=0.507、0.672,P均>0.05;表1、图4)。

表1 各组Hela细胞增殖率和凋亡率的比较 单位:%

图4 各组Hela细胞凋亡情况的比较横坐标为Annexin V/FITC染色;纵坐标为PI染色。Q1象限为机械性死亡细胞;Q2象限为凋亡晚期的细胞;Q3象限为正常活细胞;Q4象限为凋亡早期的细胞。
2.5 各组Hela细胞侵袭能力的比较
LRP11质粒组穿过小室膜的Hela细胞数较对照组和空质粒组高,差异具有统计学意义(Q=18.075、17.724,P均<0.01);空质粒组穿过小室膜的Hela细胞数较对照组差异无统计学意义(Q=0.351,P>0.05;表2、图5)。

表2 各组Hela细胞侵袭能力的比较

图5 各组Hela细胞侵袭能力的比较(结晶紫染色,100×)
3 讨 论
早期宫颈癌通常无明显症状和体征,随着病情进展,根据癌灶累及范围可出现阴道流血、下肢肿痛、肾盂积水、贫血、输尿管梗阻等继发性症状。据报道,晚期宫颈癌术后5年总生存率仅10%~20%[10],故早发现、早诊断、早治疗是提升宫颈癌患者预后的关键。
HPV是一种球形DNA病毒,属乳多空病毒科,感染途径包括性传播、医源性感染、母婴传播等,可引起人体皮肤或黏膜的鳞状上皮增殖,引发上皮良、恶性肿瘤,如尖锐湿疣、肛门癌、宫颈癌等,其中以宫颈癌为常见。报道显示,HPV在14~59岁人群中的总感染率为26.8%[11],HPV感染是导致宫颈癌的主要生物学因素,HPV的癌基因整合宫颈上皮细胞后,可产生大量E7癌蛋白,E7与抑癌基因Rb结合后可引起细胞增殖调控障碍,诱发宫颈癌细胞异常增殖。在本研究中,免疫组织化学染色实验和Western blot实验均提示LRP11在宫颈癌中呈高表达,且LRP11表达与HPV感染有一定相关性,表明LRP11和HPV可能共同参与了宫颈癌的发病。LRP11为LRP家族中的重要一员,是一种细胞表面蛋白,可通过与溶酶体结合而促进溶酶体降解,调控多个分子表达水平,还可参与多个细胞生理事件,如细胞增殖、细胞迁移、血管生成调节、凋亡细胞信号调节、血脂动态平衡调节等。此外,LRP11可通过内化某些基质蛋白和生长因子而调节肿瘤微环境,进而参与调节与肿瘤细胞增殖、转移有关的信号转导。LRP11也是上皮-间质转化(epithelial mesenchymal transition,EMT)的重要因素之一,可通过调节细胞骨架组织、控制局灶性黏附成分、调节整合素内吞循环,强化恶性细胞侵袭性表型,促进恶性肿瘤进展[12]。本研究Western blot实验显示,LRP11质粒组LRP11蛋白表达量较对照组和空质粒组高,而对照组和空质粒组之间的LRP11蛋白表达量无明显差异,提示LRP11过表达载体构建成功。接下来通过CCK8实验、Transwell小室侵袭实验、流式细胞术实验发现,LRP11质粒组Hela细胞增殖率、穿过小室膜的Hela细胞数、LRP11蛋白表达量较对照组和空质粒组高,LRP11质粒组Hela细胞凋亡率较对照组和空质粒组低,提示LRP11过表达可促进宫颈癌细胞增殖和侵袭,抑制其凋亡,以加速癌细胞进展,这与以下研究报道有相似之处。研究发现,LRP11可通过激活Janus激酶2(janus kinase 2,JAK2)/信号转导因子和转录活化因子3(Signal transduction factor and activator of transcription 3,STAT3)通路而强化纤溶酶原激活物抑制因子1(Plasminogen activator inhibitor 1,PAI-1)的促细胞迁移活性[13]。研究提示,LRP11可通过调节基质金属蛋白酶(matrix metallo protease,MMP)和血管内皮生长因子(vascular endothelial growth factor,VEGF)表达水平而促进癌细胞侵袭和迁移[14]。报道指出,LRP11可通过激活无翅型MMTV整合位点家族成员蛋白(Wnt)/β-连环蛋白(β-catenin)通路,加速细胞周期进程,促进肿瘤发展[15]。学者发现,LRP11在乳腺癌中呈高水平且与癌细胞浸润和转移密切相关[16]。研究显示,LRP11与甲状腺癌患者癌组织中的细胞增殖抗原Ki-67具有很强的正相关性,LRP11和Ki-67表达水平联合检测对甲状腺癌的临床诊疗有重要意义[17]。临床资料显示,LRP11在宫颈癌患者中的表达水平明显上调,其表达水平与宫颈癌患者总生存时间呈负相关[18]。由此表明LRP11在包括宫颈癌在内的多种恶性肿瘤发病过程中具有重要作用,临床应加以关注,以探索出新的宫颈癌预防及治疗靶点。
综上所述,LRP11在宫颈癌中呈高表达,宫颈癌中LRP11表达与HPV感染有一定相关性;LRP11过表达可促进宫颈癌细胞增殖和侵袭,抑制其凋亡,以加速肿瘤进展。但其机制尚不清楚,有待进一步研究。
