脑梗死合并阻塞性睡眠呼吸暂停综合征患者血栓形成的相关因素分析
2021-03-17汪光荣
汪光荣
(福建医科大学附属三明第一医院,三明,365000)
脑梗死(Cerebral Infarction,CI)是临床常见的脑血管疾病,病因多为脑部血液供应受限、缺氧等,高血压、心律失常等发生与其密切相关。临床有半身不遂、智力障碍等表现,不仅对患者健康有严重威胁,也会给家庭带来巨大负担与痛苦[1]。阻塞性睡眠呼吸暂停综合征(Obstructive Sleep Apnea Syndrome,OSAS)是存在潜在危险的临床常见疾病,有调查表示,该疾病高发于老年群体,属于诱发高血压、脑卒中等疾病的独立危险因素,且OSAS容易致死,对其进行研究对临床治疗、预防具有重要价值[2]。CI合并OSAS患者机体内各项指标存在变化,对其进行观察有助于治疗疾病。本研究选取CI合并OSAS患者37例、同期OSAS患者37例排除CI患者以及37例CI患者排除OSAS患者为样本,检测患者血清内皮素、血流动力学指标等,探究CI合并OSAS患者血栓发生的相关因素,现将结果报道如下。
1 资料与方法
1.1 一般资料 选取2018年11月至2019年11月福建医科大学附属三明第一医院收治的CI合并OSAS患者37例纳入观察组。选择同期福建医科大学附属三明第一医院收治的37例OSAS患者排除CI患者纳入对照A组以及37例CI患者排除OSAS患者纳入对照B组。观察组中男21例,女16例;年龄62~83岁,平均年龄(71.25±8.43)岁。对照A组中男20例,女17例;年龄63~84岁,平均年龄(72.04±8.22)岁。对照B组中男19例,女18例;年龄63~83岁,平均年龄(71.82±8.36)岁。3组患者一般资料经比较,差异无统计学意义(P>0.05),具有可比性。
1.2 纳入标准 1)观察组:采用多导睡眠监测(Polysomnography,PSG)以及头颅MRI确诊为CI合并OSAS。2)对照A组:采用PSG确诊为OSAS。3)对照B组:采用头颅MRI确诊为CI。4)CI符合《脑梗死影像学诊断规范》(2013年03版)相关标准。
1.3 排除标准 检测前14 d,服用过对凝血功能存在影响的药物。
1.4 研究方法 1)对研究对象姓名、性别、疾病史、身高、体质量、家族史等临床基础资料进行采集与记录。利用体质量指数公式(体质量/身高2)计算患者体质量指数。2)研究对象入院后,利用PSG检查,要求患者检查前禁烟禁酒,不服用催眠药物,在检查过程中保证夜间睡眠监测超过7 h。由系统自动分析生成PSG指标,包括呼吸暂停低通气指数(Apnea Hypopnea Index,AHI),呼吸最长暂停时间(Longest Apnea Time,LAT),最低脉氧饱和度(Lowest Pulse Oxygen Saturation,LSpO2)等。3)在空腹情况下,由专人按照静脉采血规范采集研究对象静脉血样,由检验科专业技术人员,严格遵循实验室检验规范,利用全自动血细胞分析系统及其配套设备完成内皮素(Endothelin,ET)、全血黏滞度(Whole Blood Viscosity,WBV)、纤维蛋白原(Fibrinogen,FIB)、血浆凝血酶原时间(Plasma Prothrombin Time,PT)等指标检测。
1.5 观察指标 体质量指数;ET指数;PSG指标;血液流变学指标。

2 结果
2.1 体质量指数 对照A组、对照B组与观察组体质量指数比较,差异均无统计学意义(P>0.05)。见表1。
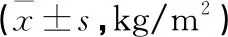
表1 3组体质量指数
2.2 ET指数 观察组ET指数远高于对照A组和对照B组,差异均有统计学意义(均P<0.05)。见表2。
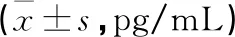
表2 3组ET指数
2.3 PSG指标 观察组AHI、LAT明显高于对照A组与对照B组,LSpO2明显低于对照A组与对照B组,差异均有统计学意义(均P<0.05)。见表3。

表3 3组PSG指标
2.4 血液流变学指标 观察组WBV、FIB高于对照A组和对照B组,PT明显低于对照A组和对照B组,差异均有统计学意义(均P<0.05)。见表4。

表4 3组血液流变学指标
3 讨论
OSAS又被称为阻塞性睡眠呼吸暂停低通气综合征(Obstructive Sleep Apnea Hypopnea Syndrome,OSAHS),是临床常见的睡眠呼吸疾病,以睡眠中间断性上呼吸道梗阻为主要特征,临床表现为白天嗜睡、夜间睡眠打鼾、睡眠中呼吸暂停,部分患者伴有头痛、夜尿多、脾气暴躁、记忆力减退等症状,严重影响患者睡眠质量、生命质量。研究发现OSAS的发生与发展容易累及患者心血管系统,导致心脑血管疾病发生,提高患者血栓形成的风险[3]。
分析原因为OSAS患者睡眠时会发生重复性间断低氧血症以及二次氧合,该情况类似于缺血损伤以及再灌注损伤,进而发生氧化应激,导致内皮细胞受损,打破血管内环境平衡[4]。本研究中,观察组与对照组A组血清ET指标均相对较高。血清ET指标可提示内皮功能变化。OSAS患者血清ET指标增高的原因推断为睡眠期间重复性间断诱发的低氧血症导致多种活性物质出现,例如,血栓素B2,这些活性物质会促进血清ET指标进一步上升,提高其基因表达[5]。OSAS患者呼吸暂停期间,胸腔负压上升,会导致回心血量上升,提高前负荷。在化学作用、机械作用下提升交感神经活性、儿茶酚胺等,导致小血管收缩,血压提升、血流速度变慢。低氧血症还会作用于血小板,损伤血管内皮,引发功能障碍,损伤内膜,继而提高血栓发生率。重复缺氧会损伤血管内皮,致使脂质在内膜下沉积,形成动脉硬化,降低血黏度增加速度,导致脑组织严重缺氧、缺血,提高血栓发生风险。OSAS患者FIB上升主要是患者体内生化神经体液作用、代谢紊乱等所致。FIB在CI以及OSAS患者体内均明显升高。有研究显示,FIB与OSAS严重度、患者凝血功能具有相关性,会影响血液流变学,伤害内皮细胞,导致血栓发生风险提高[6]。
OSAS在老年群体中高发,且患者多肥胖,容易使患者出现瘦素、脂联素分泌异常现象,导致脂质在血管内膜中聚积,引发缺血性脑卒中,增加脑梗死发病风险。而脑梗死作为缺血性脑血管疾病,随病情进展容易出现局部脑组织坏死,改变患者ET、AHI、LAT等指数。当梗死合并OSAS时,患者更容易形成血栓,致残率、病死率更高。本研究中,除体质量指数3组差异无统计学意义(P>0.05)外,其他与血栓形成的相关指标水平经比较,均具有统计学意义(P<0.05)。
总而言之,睡眠呼吸暂停长期存在,患者睡眠时脑组织缺氧以及高碳酸血症属于OSAS的重要病理变化与生理变化,病情严重情况下不仅会导致患者多器官功能损害,还是诱发血栓的主因。因此,必须重视OSAS的诊断与治疗。
