甘草增强免疫的物质基础及其作用机制研究进展
2021-03-16王钧楠周永峰崔园园马艳芹华国栋
王钧楠,周永峰,崔园园,马艳芹,张 萍*,华国栋
甘草增强免疫的物质基础及其作用机制研究进展
王钧楠1, 2,周永峰1, 3,崔园园1,马艳芹1,张 萍1*,华国栋4*
1. 解放军总医院 第五医学中心,北京 100039 2. 北京中医药大学中药学院,北京 102488 3. 成都中医药大学药学院,四川 成都 611137 4. 北京中医药大学东直门医院,北京 100700
人体的免疫功能是维持身体健康的重要生理性功能,在免疫系统的功能受损或低下时,会对人的身体健康产生严重影响。甘草作为一种补益类中药,有补脾益气之功,对人体的免疫功能具有增强作用,在开发成免疫增强新药方面具有独特优势和发展潜力。通过对近期国内外甘草免疫增强作用的相关文献进行收集和整理,从所含化合物的结构特点、分类及药理作用等方面阐述了甘草增强免疫的物质基础,并以甘草的药效成分为基础综述了甘草促进免疫细胞增殖、影响体内细胞因子和抗体水平以及调控相关酶表达等增强免疫的分子机制,以期为免疫增强药物的研发提供新的思路,为甘草免疫作用的进一步研究提供参考。
甘草;增强免疫;物质基础;分子机制;细胞因子
免疫是人体的一种生理性功能,清除入侵人体的抗原性物质,并对体内的衰老细胞、凋亡细胞以及异常突变细胞进行及时的识别、杀灭和清除,从而保障机体健康[1]。免疫系统的功能受损或低下会使机体防御力减低,更易受到病原体侵袭,并使病毒感染率升高,进而导致各种疾病发生,影响机体健康。一般有体虚易感、精神不振、营养不良、饮食不思、睡眠状况不佳等表现。目前临床上用于增强免疫的药物主要有胸腺五肽、乌苯美司、胸腺肽α1等[2],虽然能够增强机体的免疫力,但是存在恶心、呕吐、肝功能损伤等不良反应[3],影响患者的身体健康。
甘草是豆科植物甘草Fisch.、胀果甘草Bat.或光果甘草L.的干燥根和根茎[4],具有多种药效活性成分,是目前最常用的中药之一,素有“十方九草”之说。现代研究发现,甘草具有抗癌、抗病毒、抗炎、抑菌、抗肿瘤以及免疫调节等多种药理作用[5]。近年来,随着甘草在治疗银屑病、过敏性紫癜等自身免疫性疾病方面的应用,人们逐渐开始关注其在机体免疫方面的作用,现代研究表明甘草具有增强机体免疫的作用。本文对近几年国内外关于甘草免疫作用的物质基础及作用机制研究进行了初步梳理,以期为其更好的临床应用提供一定的借鉴和参考。
1 甘草增强免疫药效物质基础
甘草具有多种药理作用,同时含有多种活性成分,主要通过三萜类、多糖类和黄酮类物质来发挥其增强免疫的功能。
1.1 三萜类
三萜类化合物是甘草根及根茎中主要的生理活性成分,具有抗癌、抗病毒、免疫调节等药理作用。目前,甘草属植物中已发现61种三萜类化合物,多具有羧基、11位酮基、12位双键等官能团,其中所包含的45种苷元在结构上均为3β-羟基齐墩果烷型化合物的衍生物。
甘草酸、甘草次酸(图1)是甘草三萜类化合物中最主要的药效物质。其中,甘草酸是由1分子的18β-甘草次酸和2分子的葡萄糖醛酸组成的五环三萜类化合物,有α和β 2种异构体,水解后,可脱去糖酸链,形成苷元甘草次酸,亦同属于五环三萜[6]。自1979年,石田发现甘草酸可诱生具有高免疫活性的γ-干扰素以来,大量研究表明甘草酸具有复杂的免疫调节功能,既能提高免疫细胞的增殖能力和活性,促进相关细胞因子的分泌,提高机体免疫力,亦可产生抑制促炎因子、补体活化等效应;甘草次酸在一定条件下,也证实具有免疫增强功能[7-8]。

图1 甘草酸及甘草次酸的结构
1.2 黄酮类
黄酮类化合物种类丰富,是甘草中所含有的主要活性成分之一。目前,甘草属植物中已发现300种黄酮及其衍生物,这类化合物在结构上具有C6-C3-C6基本母核,主要包括黄酮、二氢黄酮、查耳酮、异黄酮、二氢异黄酮、黄酮醇、异黄烷等结构类型[9]。在黄酮类化合物基本母核上带有异戊烯基侧链的一类黄酮被称为异戊烯基黄酮,是一类特殊的黄酮类化合物。现代研究发现这类化合物上的异戊烯基与其生物活性有着密切联系,随着异戊烯基的结合位点、数量以及结构不同,其生理功能也会发生变化[10]。甘草中的黄酮类化合物药效作用复杂,对机体的炎症、过敏反应、氧化作用以及肿瘤的生长均具有显著的抑制作用,且与免疫调节有着密切联系[11]。甘草中影响机体免疫功能的主要黄酮类化合物见表1和图2。

表1 甘草中影响机体免疫功能的主要黄酮类化合物

图2 甘草中影响机体免疫的主要黄酮类化合物结构
1.3 多糖类
多糖是机体的主要供能物质,它广泛参与机体各项生理活动,如识别、细胞生长与癌变、胚胎发育、机体能量与物质代谢、感染、免疫反应等,因此又称为活性多糖,受到了现代医学以及食品功能化学等领域学者的高度关注。化合物结构与其生理功能联系紧密,因此甘草多糖很可能也具有相似的生物活性。据报道,甘草多糖不仅能够显著增强淋巴细胞介导的体液免疫和细胞免疫等多种免疫应答[15],并且没有细胞毒性,作为免疫调节剂具有良好的应用前景。结构方面,甘草多糖是甘草中的一类α--吡喃多糖,属于均质多糖,具有三螺旋构象,通过扫描电镜观察其微观结构多数呈片状。目前研究发现,甘草多糖多由葡萄糖、半乳糖、鼠李糖、阿拉伯糖和甘露糖组成,葡萄糖是主要的组成部分[17-19]。
2 甘草增强免疫的分子机制
2.1 对免疫细胞的影响
免疫系统在维持机体健康过程中会产生大量的免疫细胞,主要包括吞噬细胞、NK细胞、脾淋巴细胞等,这些细胞是免疫系统成功运行的基础,因而甘草对机体免疫的影响有很大一部分是通过影响相关的免疫细胞及其功能状态实现的。吞噬细胞及树突状细胞主要影响机体的非特异性免疫,而淋巴细胞,如T、B淋巴细胞则主要参与细胞免疫、体液免疫等特异性免疫应答。本文将从这2类免疫细胞方面对甘草的免疫增强作用机制进行综述。
2.1.1 对吞噬细胞、树突状细胞的影响 吞噬细胞分为单核细胞、巨噬细胞2种,其中,巨噬细胞具有细胞吞噬、抗原提呈等功能,可以影响免疫反应的激活以及调节过程,在免疫系统中具有重要作用[20]。树突状细胞也有抗原提呈功能,与一般的抗原提呈细胞不同,这类细胞是联系先天性免疫反应和过继性免疫反应的枢纽,对诱导有效的细胞和体液免疫起着关键性作用[21]。张梦欣等[22]检测对照组和甘草酸组小鼠脾脏中树突状、巨噬细胞及其3种细胞因子表达的水平,结果发现甘草酸可以增加小鼠脾脏巨噬细胞的数量,并干预其与树突状细胞表面的细胞因子表达水平,对白细胞介素-10(interleukin-10,IL-10)的表达有促进作用,而对γ干扰素(interferon- γ,IFN-γ)、IL-12的表达则表现出抑制作用,对机体的固有免疫有一定的增强效果。Bordbar等[23]研究发现甘草酸还对树突状细胞的成熟及功能有明显影响,用甘草酸处理树突状细胞能够促进树突状细胞上白细胞分化抗原40(clusters of differentiation 40,CD40)、CD86和II类组织相容性复合体(MHC-II)成熟标志物的表达,同时树突状细胞对同种异体T细胞的刺激作用也会随之增强。此外,Aipire等[24]研究显示甘草水提物可干扰Toll样受体4(Toll-like receptors 4,TLR4)信号途径,影响下游丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和核因子-κB(nuclear factor-κB,NF-κB)信号通路,进而促进树突状细胞的成熟,提高对脾细胞增殖的刺激和细胞因子的分泌能力,尤其是IL-12的产生,且该作用随剂量增加而增强。甘草酸可能通过阻断NF-κB/单核细胞趋化蛋白1(monocytechemoattractant- protein-1,MCP-1)和MAPK/细胞外调节蛋白激酶/髓细胞白血病-1(extracellular regulated protein kinases/ myeloid cell leukemia-1,ERK/Mcl-1)信号通路,来抑制单核细胞的迁移并诱导细胞凋亡,进而减少炎症发生[25]。研究表明,甘草及其有效成分可能通过靶向吞噬细胞和树突状细胞来调节免疫应答,保障免疫系统功能正常运行,进而增强机体免疫功能,主要影响巨噬细胞和树突状细胞的自身增殖能力和功能状态,对两者刺激免疫因子分泌以及树突状细胞促进脾细胞增殖有显著增强作用,并能促进树突状细胞的成熟,如图3所示。
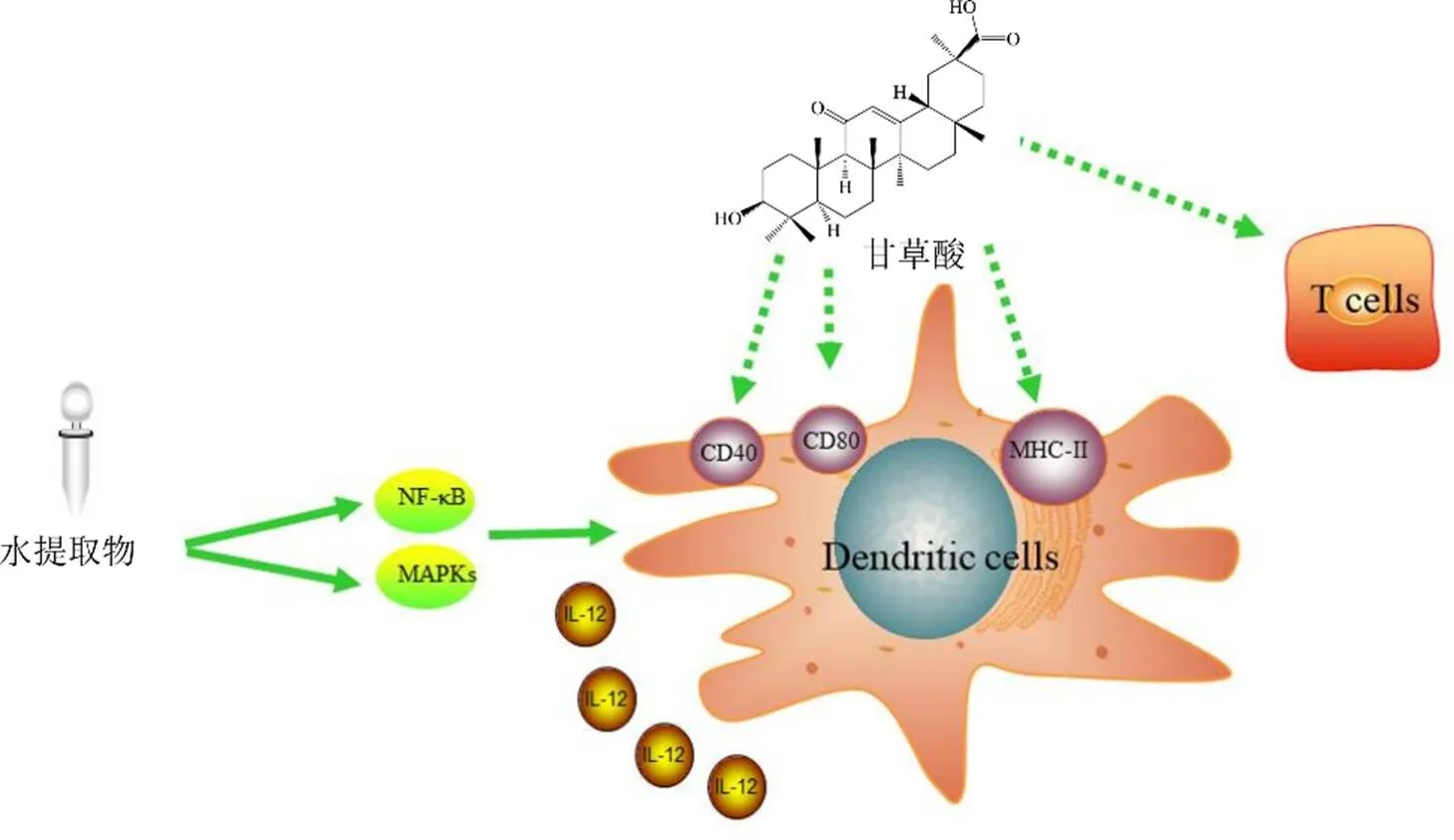
图3 甘草影响机体免疫细胞的机制
2.1.2 对淋巴细胞的影响 淋巴细胞是一类具有免疫识别功能的细胞,是非特异性免疫的主体免疫细胞。研究显示,用质量浓度为100 μg/mL的甘草提取物处理小鼠脾脏T、B淋巴细胞,其增殖率可大大提升,而甘草中的乌拉尔多糖则对脂多糖介导的淋巴细胞有增殖作用[26]。杨青等[27]对不同规格的甘草进行研究,发现生、制甘草对小鼠脾淋巴细胞的增殖均具有显著促进作用,并与刀豆蛋白A(concanavalin A,Con A)、脂多糖对T、B淋巴细胞的增殖存在协同刺激作用。史珅等[28]比较甘草多糖和Con A对T、B淋巴细胞增殖率的影响,发现相比两者单用,甘草多糖与Con A同时作用于T细胞对其增殖效果更差,且多糖浓度越高,增殖率越低。推测两者可能作用靶点相同,竞争同类受体。甘草酸苷可显著降低乙型肝炎模型大鼠血液中CD4+及CD8+T淋巴细胞亚群水平,有效减少炎症细胞浸润,降低肝细胞坏死率[29]。Guo等[30]研究表明甘草提取物及其活性成分异甘草素和柚皮素可以针对性地促进Treg细胞的诱导功能,另外,还观察到异甘草素对蛋白激酶B/哺乳动物雷帕霉素靶蛋白(protein kinase B/mammalian target of rapamycin, Akt/mTOR)信号通路有抑制作用,甘草提取物及其活性成分显示出降低AKT活性的作用,这提示甘草可通过抑制Akt-mTOR信号通路促进Treg细胞诱导和抑制炎症反应[30]。此外,近几年研究发现甘草提取物中存在微小核糖核酸(micro ribonucleic acid,miRNA),其是一类负调控基因表达的非编码小RNA,通过抑制DNA的翻译过程或促进mRNA降解来调节蛋白质编码基因的表达。体外培养实验表明,甘草miRNAs处理的外周血单核细胞(peripheral blood mononuclear cell,PBMC)较甘草水提取物、甘草酸等处理的对照组有更明显的细胞聚集现象,细胞数量和人类白细胞DR抗原细胞比例也显著增加[31]。Xiang等[31]进一步研究发现,甘草miRNA可通过抑制某些基因的表达,如与T细胞分化、炎症和细胞凋亡的相关基因,来干预PBMC的数量及状态,进而影响机体免疫应答的强度。
2.2 对细胞因子的作用
许多研究表明甘草能够上调免疫相关细胞因子的水平,从而维持免疫微环境稳定,为更好地激活和发挥免疫功能提供良好基础,最终起到增强免疫力的作用。研究结果显示,甘草酸和甘草黄酮可调节巨噬细胞分泌的多种细胞因子[32]。甘草多糖能够促进某些细胞因子的产生,如IL-7。IL-7是淋巴细胞生成中的一种重要细胞因子,对促进免疫细胞的刺激、活化、存活和内稳态均具有重要作用[33]。Aipire等[34]采用ELISA法分别检测不同浓度乌拉尔多糖(GUPS)处理过的人单核细胞源性树突状细胞和小鼠骨髓源性树突状细胞所产生的细胞因子水平,建立环磷酰胺诱导的免疫抑制小鼠模型,以此评估GUPS的免疫刺激效应,结果表明GUPS增加了血清中IL-12的水平,从而增强了免疫抑制小鼠的免疫力。刘钊等[32]研究表明甘草酸对脂多糖刺激的RAW264.7细胞分泌IL-1β、IL-3、IL-5、IL-6、IL-10、IL-12(p40)、IL-12(p70)、IL-13、嗜酸细胞活化趋化因子(Eotaxin)和肿瘤坏死因子-α(Tumor necrosis factor-α, TNF-α)多种细胞因子均有显著抑制作用。这些因子既调控免疫应答也参与炎症反应,是甘草发挥抗炎作用和免疫调节作用的交叉区域,而TNF-α能直接杀伤肿瘤细胞,是重要的抗肿瘤活性因子。可见,甘草的免疫增强作用与其抗炎、抗肿瘤是密不可分的。
此外,Wu等[35]报道从甘草中提取的甘草香豆素可剂量相关性地下调诱导型一氧化氮合酶(nducible nitric oxide synthase,iNOS)的表达,从而减少脂多糖诱导的NO的产生,并抑制脂多糖诱导的IL-10、IL-6等细胞因子在mRNA和蛋白水平上的表达;同时,与全身性免疫抑制剂的抑制方式不同,甘草香豆素通过干扰NF-κB、MAPKs和信号传导与转录激活因子3(sgnal transducer and activator of transcription 3,STAT3)信号通路减弱脂多糖诱导的RAW264.7巨噬细胞中细胞因子的基因表达,调节机体免疫应答强度。另有文献报道甘草酸可抑制脂多糖诱导的环氧化酶-2(cyclooxygenase-2,COX-2)的表达,显著降低脂多糖诱导小鼠子宫内膜上皮细胞中TLR4的表达,有作为子宫内膜异位症治疗药物的潜力[36]。作用机制见图4。
2.3 影响抗体的生成
徐海星等[37]对实验小鼠进行免疫学检测,经甘草浸膏处理后,小鼠的抗体水平明显上调。Sun等[38]实验证明甘草总皂苷对ICR小鼠卵清蛋白细胞的特异性免疫球蛋白G(immunoglobulin G,IgG)、IgG1和IgG2b抗体应答有促进作用,能够辅助、增强B细胞介导的体液免疫应答,提示甘草总皂苷可作为免疫佐剂进行更深入的探索。此外,甘草对机体总抗体的水平也有显著升高作用,如甘草酸能使血液中总IgA、IgG以及IgM的水平明显上调[39]。IgM是体液免疫应答过程中出现最早的抗体,具有与抗原的强结合能力,可以保证机体功能正常发挥;IgA依靠抗原结合能力可防止病原体对机体细胞的黏附;IgG则是机体免疫的主要抗体,能与吞噬细胞表面Fc受体(Fc receptors,FcR)结合,调理其吞噬功能,并能产生抗体依赖性细胞介导的细胞毒作用[40]。促进抗体的产生可能是甘草及其活性成分增强免疫功能的作用机制之一。

图4 甘草影响相关细胞因子增强机体免疫机制
2.4 对相关酶类的影响
Jiang等[41]报道甘草黄酮能抑制脂多糖/IFN-γ诱导的RAW264.7巨噬细胞iNOS的表达,这可能与干扰NF-κB信号通路以及对ERK信号通路的特异性抑制有关。研究表明,甘草黄酮类成分甘草苷和异甘草苷也有类似作用,可抑制重组Kelch样ECH关联蛋白1蛋白(recombinant Kelch Like ECH Associated Protein 1,Keap1)表达并能够增加核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)易位,进而加速激活Nrf2信号通路,使抗氧化酶的表达增加,最终导致iNOS、COX-2蛋白及mRNA的表达减少,抑制脂多糖诱导的小鼠巨噬细胞炎症反应[42]。另外,Gao等[43]发现甘草苷能调节IL-1β诱导的人滑膜细胞c-Jun N末端激酶(c-Jun-terminal kinase JNK)、p38蛋白和磷酸腺苷活化蛋白激酶(adenosine monophosphate activated protein kinase AMPK),通过抑制3者的磷酸化,阻滞磷酸化c-Jun蛋白活化,降低IL-1β诱导的p65蛋白向细胞核的转运率,最终发挥抗炎作用。JNK、p38蛋白均为应激激活的蛋白激酶,能够影响细胞凋亡和细胞应激,与肿瘤以及炎症的发生、发展有着密切联系,而AMPK则与葡萄糖代谢平衡相关。干扰该类酶的表达可阻滞相关炎症通路,进而起到增强人体对抗炎症和肿瘤的免疫功能。
3 结语与展望
甘草增强机体免疫的物质基础主要包括三萜类、黄酮类和多糖。同时,甘草因其活性成分的多样性可多靶点、多途径作用于机体进而提高免疫力,通过激活和抑制免疫细胞,干预多种免疫应答相关因子,如细胞因子、抗体蛋白、炎症通路调节因子等,最终改善免疫反应和防御系统。这些作用机制复杂且相互关联,与抗炎、抗肿瘤等药理作用也多有交集。目前,甘草增强免疫功能的机制尚未清晰,且研究多偏向免疫抑制,而甘草作为补益类中药,不良反应少,使其在作为增强免疫药物的开发中具有优势。因此,仍需加强对甘草免疫增强作用的探索,进一步阐明其作用机制,以期更好地服务于临床应用。
利益冲突 所有作者均声明不存在利益冲突
[1] Bergthaler A, Menche J. The immune system as a social network [J]., 2017, 18(5): 481-482.
[2] 陈尚瑜, 杨建锋, 费燕. 我院2011年至2013年免疫增强药物利用分析 [J]. 中国药业, 2016, 25(1): 72-74.
[3] 李洁, 王晓杰, 邹素兰. 胸腺肽的临床应用与研究进展 [J]. 中国药房, 2008, 19(14): 1108-1109.
[4] 中国药典 [S]. 一部. 2015: 86.
[5] 马鸿雁, 邓雨娇, 马倩, 等. 甘草的研究概况 [J]. 中药与临床, 2018, 9(1): 59-62.
[6] 蒲洁莹, 何莉, 吴思宇, 等. 甘草属植物中三萜类化合物的抗病毒作用研究进展 [J]. 病毒学报, 2013, 29(6): 673-679.
[7] 刘丽萍, 任翠爱, 赵宏艳. 甘草酸的免疫调节作用研究进展 [J]. 中国实验方剂学杂志, 2010, 16(6): 272-276.
[8] Wang C Y, Kao T C, Lo W H,. Glycyrrhizic acid and 18β-glycyrrhetinic acid modulate lipopolysaccharide- induced inflammatory response by suppression of NF-κB through PI3K p110δ and p110γ inhibitions [J]., 2011, 59(14): 7726-7733.
[9] 段志涛, 高英, 李卫民, 等. 甘草中黄酮类成分的研究 [J]. 北方药学, 2013, 10(7): 6-11.
[10] 党延启, 段菊, 倪荣镇, 等. 异戊烯基黄酮的生物活性及构效关系 [J]. 中国实验方剂学杂志, 2015, 21(17): 213-218.
[11] 王新绘, 李金耀, 刘晓颖, 等. 甘草及其有效成分对免疫系统调节作用研究进展 [J]. 中成药, 2016, 38(2): 392-395.
[12] Yu J Y, Ha J Y, Kim K M,. Anti-inflammatory activities of licorice extract and its active compounds, glycyrrhizic acid, liquiritin and liquiritigenin, in BV2cells and mice liver [J]., 2015, 20(7): 13041-13054.
[13] Lee J Y, Lee J H, Park J H,. Liquiritigenin, a licorice flavonoid, helps mice resist disseminated candidiasis due toby Th1 immune response, whereas liquiritin, its glycoside form, does not [J]., 2009, 9(5): 632-638.
[14] Gao Y, Lv X, Yang H H,. Isoliquiritigenin exerts antioxidative and anti-inflammatory effects via activating the KEAP-1/Nrf2 pathway and inhibiting the NF-κB and NLRP3 pathways in carrageenan-induced pleurisy [J]., 2020, 11(3): 2522-2534.
[15] 王晓利, 廖成水, 程源斌, 等. 甘草甜素甘草多糖和光甘草定对小鼠巨噬细胞的毒性与免疫功能的调节 [J]. 中国兽医科学, 2014, 44(3): 320-325.
[16] Fontes L B, Dos Santos Dias D, de Carvalho L S,. Immunomodulatory effects of licochalcone A on experimental autoimmune encephalomyelitis [J]., 2014, 66(6): 886-894.
[17] 陈橙, 帕丽达·阿不力孜, 米仁沙·牙库甫, 等. 胀果甘草酸性多糖的分离纯化、结构分析及免疫活性测定 [J]. 食品安全质量检测学报, 2017, 8(12): 4651-4658.
[18] Wang Y G, Li Y L, Ma X Q,. Extraction, purification, and bioactivities analyses of polysaccharides from[J]., 2018, 122: 596-608.
[19] Pan L C, Zhu Y M, Zhu Z Y,. Chemical structure and effects of antioxidation and against α-glucosidase of natural polysaccharide fromBatalin [J]., 2020, 155: 560-571.
[20] Shao H W, He M, Chen J S,. Extraction of miRNA fromdecoction and its effect on immune cells [J]., 2015, 38(7): 1449-1453.
[21] Galluzzi L, Senovilla L, Vacchelli E,. Trial watch: Dendritic cell-based interventions for cancer therapy [J]., 2012, 1(7): 1111-1134.
[22] 张梦欣, 张杰森, 李勇森, 等. 甘草甜素对C57BL/6小鼠脾脏中DC和巨噬细胞及其细胞因子分泌的影响 [J]. 现代免疫学, 2019, 39(5): 397-401.
[23] Bordbar N, Karimi M H, Amirghofran Z. The effect of glycyrrhizin on maturation and T cell stimulating activity of dendritic cells [J]., 2012, 280(1): 44-49.
[24] Aipire A, Li J Y, Yuan P F,.water extract enhances dendritic cell maturation and antitumor efficacy of HPV dendritic cell-based vaccine [J]., 2017, 7: 43796.
[25] Aipire A, Yuan P F, Aimaier A,. Preparation, characterization, and immuno-enhancing activity of polysaccharides from[J]., 2020, 10(1): 159.
[26] 朱雪峰, 谢鲲鹏, 霍洪楠, 等. 甘草提取物的抑菌作用及其对小鼠免疫功能的影响 [J]. 中国微生态学杂志, 2013, 25(3): 254-257.
[27] 杨青, 周倩. 甘草蜜炙前后对小鼠脾淋巴细胞增殖的影响 [J]. 时珍国医国药, 2017, 28(12): 2907-2909.
[28] 史珅, 张泽生, 王玉本, 等. 甘草多糖的体外免疫调节作用 [J]. 食品科技, 2008, 33(5): 267-269.
[29] 陈应强, 庄海, 吴维巍, 等. 复方甘草酸苷对乙型肝炎模型大鼠血清中肝炎相关因子的影响 [J]. 中国临床药理学杂志, 2015, 31(16): 1626-1628.
[30] Guo A, He D M, Xu H B,. Promotion of regulatory T cell induction by immunomodulatory herbal medicine licorice and its two constituents [J]., 2015, 5: 14046.
[31] Xiang J, Huang J C, Xu C,. Effect of miRNA fromdecoction on gene expression of human immune cells [J]., 2017, 42(9): 1752-1756.
[32] 刘钊, 钟菊迎, 高尔宁, 等. 基于液相蛋白芯片的甘草有效成分抑制巨噬细胞细胞因子谱表达的研究[J]. 中国中药杂志, 2014, 39(19): 3841-3845.
[33] Ayeka P A, Bian Y, Githaiga P M,. The immunomodulatory activities of licorice polysaccharides (Fisch.) in CT 26 tumor-bearing mice [J]., 2017, 17(1): 536.
[34] Aipire A, Mahabati M, Cai S,. The immunostimulatory activity of polysaccharides from[J]., 2020, 8: e8294.
[35] Wu L H, Fan Y P, Fan C,. Licocoumarone isolated fromselectively alters LPS-induced inflammatory responses in RAW 264.7 macrophages [J]., 2017, 801: 46-53.
[36] Wang X R, Hao H G, Chu L. Glycyrrhizin inhibits LPS-induced inflammatory mediator production in endometrial epithelial cells [J]., 2017, 109: 110-113.
[37] 徐海星, 胡伟. 甘草浸膏对小鼠免疫功能的影响研究 [J]. 中国药业, 2018, 27(4): 3-5.
[38] Sun H X, Pan H J. Immunological adjuvant effect ofsaponins on the immune responses to ovalbumin in mice [J]., 2006, 24(11): 1914-1920.
[39] Li X L, Zhou A G. Evaluation of the immunity activity of glycyrrhizin in AR mice [J]., 2012, 17(1): 716-727.
[40] 于爱莲, 王月丹. 病原生物与免疫学[M]. 北京: 北京大学医学出版社, 2015: 362.
[41] Jiang Y X, Dai Y Y, Pan Y F,. Total flavonoids fromexert anti-inflammatory and antitumorigenic effects by inactivating iNOS signaling pathways [J]., 2018, 2018: 6714282.
[42] Wang R, Zhang C Y, Bai L P,. Flavonoids derived from liquorice suppress murine macrophage activation by up-regulating heme oxygenase-1 independent of Nrf2 activation [J]., 2015, 28(2): 917-924.
[43] Gao Y X, Cheng B F, Lian J J,. Liquiritin, a flavone compound from licorice, inhibits IL-1β-induced inflammatory responses in SW982 human synovial cells [J]., 2017, 33: 142-148.
Research progress on material basis and mechanism ofetenhancing immunity
WANG Jun-nan1, 2, ZHOU Yong-feng1, 3, CUI Yuan-yuan1, MA Yan-qin1, ZHANG Ping1, HUA Guo-dong4
1. The Fifth Medical Center of PLA General Hospital, Beijing 100039, China 2. School of Chinese Materia Medica, Beijing University of Chinese Medicine, Beijing 102488, China 3. School of Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China 4. Dongzhimen Hospital, Beijing University of Traditional Chinese Medicine, Beijing 100700, China
The immune function of human body is an important physiological function to maintain health. Impaired or poor immune system function have a serious impact on human health. As a kind of tonic traditional Chinese medicine, gancao (et) has the function of tonifying spleen and replenishingand enhancing the immune function of human body, which shows unique advantages and development potential in the development of immunopotentiators. In this paper, through the collection and collation of the recent domestic and foreign literatures on the immune enhancement of, the material basis of the function to enhance immunity ofwas elaborated from the structural characteristics and classification of compounds and pharmacological effects of. Based on the effective components of, the molecular mechanisms were summarized, expected to provide new ideas for the research and development of immune enhancing drugs, and provide reference for further research and discussion of the immune effect of. The molecular mechanisms include promoting the proliferation of immune cells and improving the biological activity, influencing the levels of cytokines and antibodies in the body, and regulating the expression of related enzymes.
et; immunity enhancement; material basis; molecular mechanism; cytokines
R284;R285
A
0253 - 2670(2021)06 - 1844 - 07
10.7501/j.issn.0253-2670.2021.06.034
2020-09-13
国家重点研发计划(2018YFC1706502)
王钧楠(1996—),硕士研究生,主要从事中药质量评价研究。E-mail: wjn2019q@163.com
张 萍,副主任药师,主要从事中药质量评价研究。Tel: (010)63912999 E-mail: zhp1231@126.com
华国栋,主任药师,主要从事临床中药和中药质量研究。Tel: (010)84013381 E-mail: zhaojhuagd@126.com
[责任编辑 潘明佳]
