星状神经节阻滞术前处理减轻脑缺血再灌注大鼠的脑梗死
2021-03-16常新会司海超徐宏超
常新会,司海超,徐宏超
(1南阳市中心医院重症医学科,南阳 473000;2南阳市中心医院麻醉科,南阳 473000)
缺血性脑血管疾病是脑血管疾病的主要类型,占脑血管疾病患者总数的60%~80%[1]。缺血性脑血管病的发病机制主要包括脑损伤以及脑神经元变性和死亡,其中自噬作用在这此过程中起到重要作用[2,3]。自噬是缺血和缺氧条件下机体的应激反应[4],因此,局灶性脑缺血/再灌注(ischemia reperfusion,I/R)可以激活自噬。自噬是细胞成分通过囊泡转运至溶酶体进行降解的过程。在真核生物中,自噬不仅涉及如生长、发育、代谢和免疫等生理过程,而且还涉及如脑缺血、心肌缺血和肾缺血等病理过程[5]。另外,温和的自噬具有神经保护作用,而过激的自噬则能促进神经细胞的死亡[6,7]。因此,研究自噬在脑I/R中的作用非常重要。
星状神经节阻滞(stellate ganglion block,SGB)已被广泛应用于临床镇痛。先前的研究[8]表明SGB能减轻失血性休克后的损伤,并改善动物的生存条件。此外,SGB模拟的交感神经切断术能降低脓毒症大鼠的器官损伤[9]。然而,SGB对脑I/R损伤的机制仍不清楚。研究[2,3]表明,自噬和凋亡参与了I/R后神经元细胞损伤的过程,提示自噬和凋亡可能是神经元损伤的重要贡献者。然而,SGB对I/R引起的脑神经元损伤抑制作用是否与抑制自噬和凋亡有关仍不清楚。我们假设SGB对I/R引起的脑神经元损伤的有益作用是通过抑制自噬和凋亡而实现的,为验证这一假设,我们检测了SGB对脑I/R大鼠的影响,并探索了与凋亡和自噬通路相关的蛋白表达。
材料和方法
1 实验动物、试剂(盒)和抗体
36只SPF级7~8周龄雄性SD大鼠(290~310g)购自河南省实验动物中心(SCXK(豫)2017-0001)。2,3,5氯化三苯基四氮唑(2,3,5‐Triphen‐yltetrazolium chloride,TTC)染液和HE染色试剂盒(北京索莱宝科技有限公司),TUNEL染色试剂盒和组织蛋白提取试剂盒(中国北京中山金桥生物技术有限公司),ECL发光底物和BCA蛋白定量试剂盒(上海碧云天生物技术有限公司)。兔抗Cleaved Caspase‐3抗体、兔抗GAPDH抗体以及辣根过氧化物酶标记山羊抗兔IgG(H+L)二抗(武汉博士德生物工程有限公司),兔抗LC3抗体和兔抗beclin1抗体(美国Cell Signaling Technology公司)。
2 实验造模及处理
将大鼠饲养在屏障环境的动物房中,并使其自由饮食物和水。所有大鼠饲养性饲养3 d后,按照随机数字法分为3组:假手术(Sham)组,I/R组和I/R+SGB组,每组12只。I/R组大鼠在术前先将大鼠禁食10 h,然后用10%水合氯醛(380 mg/kg)麻醉后,沿颈部正中线切开一个切口,并通过钝器分离使肌肉和筋膜沿着胸锁乳突肌分开,暴露右颈总动脉、颈外动脉和颈内动脉,随后,斜切颈外动脉,小心地将氨纶细丝尼龙缝线(直径0.2 mm)远端插入约18 mm并打一活结,以阻塞大脑中动脉,在脑缺血2 h后,将缝线活结缓慢松开以实现再灌注。Sham组大鼠仅分离动脉,不予I/R操作;I/R+SGB组大鼠在水合氯醛麻醉后,先在左侧颈静脉切口入路阻断星状神经节1 h后,再做I/R手术。I/R术后4 h,待大鼠苏醒后,将发生抽搐和持续意识障碍的大鼠剔除实验,最终,Sham组纳入12只大鼠,I/R组和I/R+SGB组均纳入11只大鼠。
3 局部脑血流量测量
I/R术后7 d,腹腔注射水合氯醛使大鼠深度麻醉,将大鼠仰卧位固定,并用加热垫使其体温维持在37~38℃。沿颅骨中线切开头皮,用骨水泥激光多普勒血流仪探头固定在颅骨矢状缝右2 mm,管状缝前1 mm处。测量右半球的区域局部脑血流量(regional cerebral blood flow,rCBF),并用moorLDIMeasV60数据采集和分析系统对rCBF进行量化。
4 脑梗死体积的测量
rCBF测量后,每组任选5只大鼠麻醉后处死,迅速取出大脑并在‐40°C下冷冻20 min。然后用切片机制备2 mm厚度连续冠状切片,并用4%多聚甲醛固定,随后在37%的条件下用0.5%TTC染色30 min。梗死的组织呈苍白色,而正常组织则染红色。对切片拍照,并用Image J软件计算梗塞面积。梗死体积=脑片厚度(2 mm)×梗塞面积。根据以下公式将梗塞区域标准化至对侧半球以消除局部缺血造成水肿干扰:校正后的梗死区域=测量的梗死区域+对侧对应结构的区域‐同侧对应结构的区域。结果以半球总体积的百分比表示。
5 HE染色
剩余的大鼠处死后,取脑并固定在4%多聚甲醛溶液中。将脑组织用石蜡包埋并切成4 μm厚度的冠状切片。脑片经常规程序的脱蜡至水后,用苏木素将脑组织切片染色15 min,用自来水冲洗。用0.1%盐酸乙醇分化切片30 s,在自来水中浸泡15 min,然后用伊红染色5 min。常规脱水、透明和封片后,用BX51显微镜(Olympus,日本)白光视野下观察。
6 TUNEL染色
将大鼠缺血半影区或Sham组同位置的脑组织切片(4 μm)经常规程序的脱蜡至水后,按照试剂盒方法,滴加20 μg/mL不含DNase的蛋白酶K,37℃作用20 min,PBS洗3次;滴加50 μL FITC标记的TdT酶试剂,37℃作用45 min,PBS洗3遍;随后使用5 mg/mL DAPI试剂在室温复染细胞核3 min。在BX51荧光显微镜(Olympus,日本)×20物镜视野下观察,并随机选择5个视野,计数TUNEL阳性染色的细胞数量,并将阳性细胞数/细胞总数的比率记为凋亡率。
7 透射电子显微镜观察
将分离的缺血半影区或Sham组同位置的脑组织固定在2.5%戊二醛溶液中。丙酮脱水后,将样品用金相热埋树脂包埋,制备1 μm厚度的切片。然后在体视光学显微镜下用EM UC7超薄切片机(Lecia,奥地利)制成厚度为60 nm的超薄切片。将超薄切片用柠檬酸铅染色10 min,用不含CO2的双蒸馏水清洗。样品用醋酸铀染色30 min,用双蒸馏水洗涤并干燥。使用JEM‐1400透射电镜(JEOL,日本)观察海马CA1区神经元的超微结构并拍照。
8 Western blot检测
将缺血半影区或Sham组同位置的脑组织切碎并在冰冷的RIPA裂解缓冲液中匀浆。收集溶解的蛋白质,并在4℃下以12000 r/min离心5min以除去碎片。用BCA蛋白测定试剂定量总蛋白浓度。将等量蛋白上样并行SDS‐聚丙烯酰胺凝胶电泳,然后将电泳的蛋白电转到聚偏二氟乙烯膜上。用5%脱脂牛奶封闭膜40 min后,使用针对LC3、beclin1和cleaved caspase 3和GAPDH的特异性抗体在4°C下孵育过夜。用TBST洗涤3次后,将其与相应的第二抗体在室温下孵育1 h。用ECL试剂和凝胶成像系统(上海天能科技有限公司)对膜条带显像,并用Image J软件计算蛋白相对表达量。
9 统计学方法
数据表示为平均值±标准差,用SPSS 19.0统计软件采用单因素方差分析法对数据进行统计分析。P<0.05则认为差异具备统计学意义。
结 果
1 星状神经节阻滞术前处理减轻I/R引起的病理性脑损伤
在实施SGB术后7 d,对大鼠脑冠状切片进行TTC染色以评估I/R损伤后脑梗死的程度。如图1A和1B所示,假手术组没有脑梗死,而I/R组呈现明显的梗死区域;与I/R组相比,I/R+SGB组大鼠脑梗死体积显著降低。随后通过HE染色检测梗塞区域的边界,以观察缺血半影区中的神经元形态。如图1C所示,假手术组中的神经元没有明显的病理学改变,而I/R组的缺血性半影区神经元出现松散和萎缩结构,以及缩突核深染,SGB前处理可逆转I/R诱导的这一现象;此外,I/R组中的许多神经元失去了结构完整性,并显示出明显的核仁分解;与I/R组相比,SGB前处理可显著减少神经元损伤,抑制神经元肿胀并恢复缺血半影区神经元的排列。

图1 星状神经节阻滞术前处理对I/R诱导的脑损伤的影响。A,TTC染色的大脑冠状切片。B,由TTC染色的切片厚度和梗塞面积计算的梗塞体积统计学分析;与Sham组相比,###P<0.001;与I/R组相比,**P<0.01;n=5。C,缺血半影区的代表性HE染色图像;比例尺,150μmFig. 1 Effect of stellate ganglion block pretreatment on I/R‐induced brain injury. A, TTC stained coronal sections of the rat cerebrum; B, statistical anal‐ysis of infarct volume calculation from thickness and infarct area of TTC stained slices; ###P<0.001, compared with Sham group; **P<0.01, compared with I/R group; n=5; C, representative HE staining images of ischemic penumbra; scale bar, 150μm
2 星状神经节阻滞术前处理抑制I/R后大鼠局部脑血流量降低
通过激光多普勒血流仪系统对大鼠rCBF进行测定(rCBF的大小以不同的颜色显示,蓝色到红色表示从低到高),结果显示,与Sham组比较,I/R组rCBF明显降低;与I/R组相比,SGB前处理可使rCBF显著增加(图2),说明SGB前处理可恢复I/R后大鼠的rCBF。

图2 星状神经节阻滞术前处理对脑I/R大鼠rCBF的影响。A,同侧皮质rCBF代表性结果;B,rCBF统计学分析;与Sham组相比,###P<0.001;与I/R组相比,**P<0.01;n=11或12Fig. 2 Effect of stellate ganglion block pretreatment on rCBF in rats with cerebral I/R. A, representative results of rCBF in the ipsilateral cortex; B,statistical analysis of rCBF; ###P<0.001, compared with Sham group; **P<0.01, compared with I/R group; n=11 or 12
3 SGB前处理可降低I/R后大鼠缺血半影区神经元凋亡
采用TUNEL法评估大鼠缺血半影区神经元凋亡。如图3所示,Sham组同位置脑切片中TUNEL阳性染色细胞数量极少,细胞排列整齐;与Sham组相比,I/R组缺血半影区的TUNEL阳性染色细胞数目显著增加;与I/R组相比,I/R+SGB组缺血半影区的TUNEL阳性染色细胞数目显著减少,染色度降低。
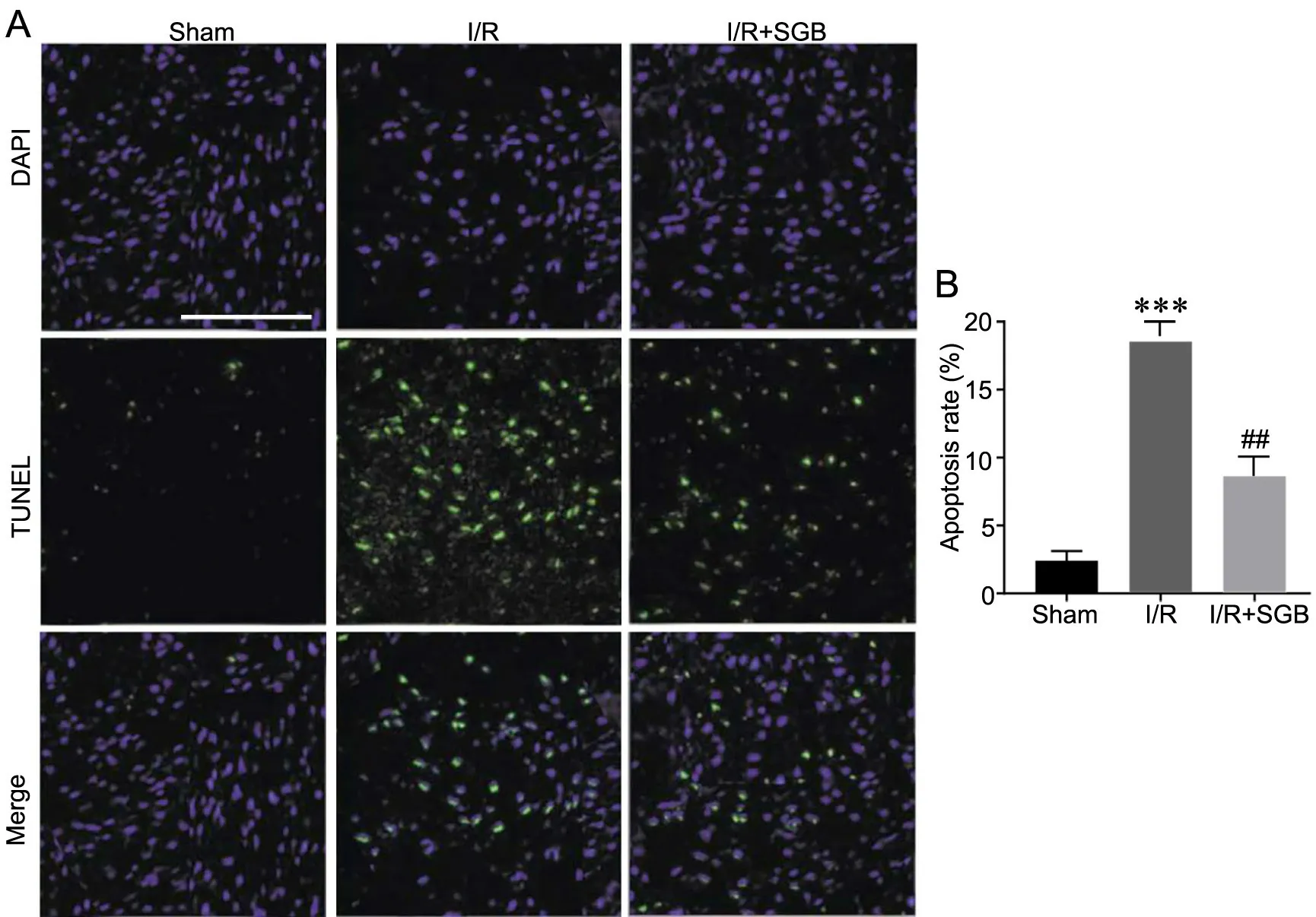
图3 星状神经节阻滞术前处理对大鼠I/R后缺血半影区中细胞凋亡的影响。A,缺血半影区的TUNEL染色的代表性图像;比例尺,150μm。B,凋亡率的统计结果。与Sham组相比,###P<0.001;与I/R组相比,**P<0.01;n=6或7Fig. 3 Effect of stellate ganglion block pretreatment on apoptosis of ischemic penumbra in rats after I/R. A, representative TUNEL staining images of ischemic penumbra; scale bar, 100μm; B, statistical analysis of apoptosis rate; ###P<0.001, compared with Sham group; **P<0.01, compared with I/R group; n=6 or 7
4 SGB前处理可降低I/R后大鼠缺血半影区神经元自噬和凋亡水平
采用透射电镜观察缺血半影区神经元自噬。如图4A所示,Sham组缺血半影区的细胞结构清晰,胞质内细胞器正常,线粒体的结构正常,而没有溶酶体或双层膜结构;I/R组缺血半影区神经元周围明显水肿,线粒体嵴断裂,并产生严重空泡结构,同时,I/R组中观察到了双层或单层膜的自噬体,并且溶酶体的数量增加;与I/R组相比,I/R+SGB组的自噬程度有所降低,水肿和空化的程度有所降低。Western blot检测显示,I/R后脑缺血半影区中Cleaved Caspase‐3和beclin1水平以及LC3Ⅱ/LC3I的比值均显著升高,而SGB前处理能显著降低I/R诱导的上述蛋白水平的升高。

图4 星状神经节阻滞术前处理对I/R后缺血半影区自噬和凋亡的影响。A,神经元自噬的透射电镜观察;比例尺,10μm。B,Cleaved Caspase‐3、beclin1和LC3水平的代表性Western blot检测结果;C,Cleaved Caspase‐3水平的统计学分析;D,beclin 1水平的统计学分析;E. LC3Ⅱ/LC3Ⅰ比值的统计学分析;与Sham组相比:###P<0.001;与I/R组相比:**P<0.01;n=6Fig. 4 Effect of stellate ganglion block pretreatment on autophagy and apoptosis in ischemic penumbra after I/R. A, transmission electron microscopic observation on autophagy of neurons; scale bar, 10μm; B, representative results of Western blotting detection for the levels of Cleaved Caspase‐3, be‐clin1 and LC3; C, statistical analysis for the relative levels of Cleaved Caspase‐3; D, statistical analysis for the relative levels of beclin1; E, statistical analysis for the ratio of LC3Ⅱ/LC3 I; ###P<0.001, compared with Sham group; **P<0.01, ***P<0.001, compared with I/R group; n=6
讨 论
中风是世界上第三大死亡原因,也是成人神经系统残疾的主要原因[10]。 此外,约有80%的中风病例归因于原发性脑缺血[11]。中断大脑的血供会诱发包括兴奋性毒性、酸毒性、离子失衡、氧化应激、线粒体功能障碍和炎症等一系列分子事件,最终导致神经元凋亡和脑组织损伤[12]。因此,开发有效的治疗脑缺血的方法具有重要意义。星状神经节为头部、颈部、颈胸区和上肢的交感神经支配的神经节。星状神经节的阻塞或切除会引发这些区域的血管扩张,进而增强这些区域的血供[8,9]。本实验结果显示,SGB前处理可增强脑I/R大鼠的血供,降低脑梗死,并减少缺血半影区神经元形态改变和凋亡的病理变化,说明SGB前处理是潜在的用于局灶性脑缺血的保护策略,此技术可能适用于如溶栓和取栓等脑I/R损伤的高发病风险疾病的术前处理。
近年来研究发现,自噬广泛参与脑缺血损伤后的一系列反应[2,3,7]。但目前对于自噬在缺血性脑损伤中的作用尚存在争议,如有些研究[7,13]认为自噬能促进缺血性脑损伤后神经元的存活,而有些研究[14,15]认为脑损伤后的神经元自噬能诱导细胞凋亡并进一步加剧认知功能障碍。造成这些矛盾的因素主要包含诱导自噬信号的强度、损伤的脑组织取材部位、以及脑缺血后的取材时间不同以及不同部位神经元自噬阈值的不同等。本研究显示,SGB能减少脑I/R大鼠缺血半影区中自噬体以及Beclin‐1表达和LC3Ⅱ/LC3Ⅰ比值,提示SGB能降低脑I/R后缺血半影区中自噬水平;造成这一现象的原因可能是本研究在I/R术前已经进行SGB术,造成脑血供增强而降低I/R诱导的自噬。另外,本研究是在I/R术后7d取材,此阶段属于神经损伤急性期的末端,缺血半影区中继发性损伤神经元均处于恢复状态,自噬降低使得神经元多处于“健康”状态。因此,若细致研究SGB对局灶性脑缺血的自噬的影响,应细致SGB前处理和后处理,I/R术后不同时间以及不同脑部位中自噬水平。
总之,就目前结果而言,本研究结果显示SGB前处理能增加大鼠脑I/R损伤后脑血供、改善脑梗死和降低缺血半影区神经元凋亡和自噬。
