熊果酸通过调节miR-148a-3p/孕烷X受体轴抑制肝细胞肝癌细胞增殖、迁移与侵袭
2021-03-16谭昊曲王劲柏白薇彭洪薇胡锦芳
谭昊曲,王劲柏,白薇,彭洪薇,胡锦芳*
(1南昌大学第一附属医院药剂科 南昌 330006;2南昌大学第一附属医院,江西省转化医学研究院南昌 330006)
目前,我国每年新增肝细胞肝癌(hepatocellular carcinoma,HCC)病例约占全球总新增HCC病例的45%,是全球HCC发病率最高的国家[1]。尽管早期HCC患者根治性肝切除术或肝移植后,5年生存率可达80%以上[2];但HCC早期并没有明显症状,仅少数早期患者能通过影像学检测其他疾病时发现病变,而绝大多数HCC患者确诊时已经达到中晚期。对于中期有手术机会的HCC患者,采取手术切除联合化疗、介入、无水酒精灌注和射频等为辅的综合治疗,但据流行病学数据统计,其术后5年生存率仍不足5%[3]。造成HCC术后预后不良的主要因素为复发和肝内或远端转移,但术后的化疗、介入、无水酒精灌注和射频等手段的全身毒副作用较大且疗效不尽人意,因此,寻找能抑制HCC术后复发和转移且毒副作用较低的治疗策略刻不容缓。
熊果酸(ursolic acid,UA)是一种五环三萜类化合物,其对包含HCC细胞在内的多种肿瘤细胞均有抑制增殖作用[4,5]。但以往关于UA对HCC细胞的研究,并未指明其抑制HCC细胞的剂量是否具有对正常细胞的毒性,且其在低毒或无毒剂量下的UA对HCC的增殖和迁移以及侵袭的影响和机制并不完全清楚。因此,本研究首先采取不同剂量的UA刺激HCC细胞并观察此剂量下UA对肝正常细胞的毒性,筛选无毒的UA剂量;继而选取无毒的UA剂量研究对HCC细胞侵袭与迁移的影响,并分析其机制。
材料与方法
1 主要试剂
DMEM培养基和胎牛血清购自美国Gibco公司;Lipofectamine 2000购自美国Invitrogen公司;BCA试剂盒、ECL化学发光试剂盒、CCK‐8试剂盒和双荧光素酶报告基因检测试剂盒购自上海碧云天生物技术有限公司;Trizol试剂、逆转录试剂盒和端粒酶活性荧光实时定量PCR法检测试剂盒购自江苏凯基生物技术股份有限公司;miR‐148a‐3p抑制剂(miR‐148a‐3p inhibitor)、miR‐148a‐3p模拟物(miR‐148a‐3p mimic)、miR阴性对照(miR‐NC)、孕烷X受体(pregnane X receptor,PXR)shRNA载体(sh‐PXR)、sh‐NC、PXR过表达载体(pcDNA‐PXR)和空载体(pcDNA)购自生工生物工程(上海)股份有限公司;RIPA试剂盒、兔抗GAPDH抗体与HRP或DyLight 488标记山羊抗兔IgG二抗购自武汉博士德生物工程公司;兔抗PXR抗体购自英国Abcam公司。
2 细胞培养与UA剂量筛选
正常肝细胞系(HL‐7702和HHL‐5)和HCC细胞系(BEL‐7404、Huh7、SMMC‐7721和HepG2)购自武汉普诺赛生命科技有限公司,均培养在含10%胎牛血清的DMEM培养基中,每2~3 d换液一次。取生长期的上述细胞分别用0、5、10、20、40和80 μmol/L的UA刺激48 h,用CCK‐8法筛选对正常肝细胞系无毒且能抑制HCC细胞系细胞活性的剂量浓度。
3 Transwell小室法检测细胞侵袭与迁移
取HepG2细胞,用已筛选的UA剂量处理48h后,然后用无血清的DMEM培养基制作细胞悬液。将100 μL细胞悬液分别加入测定细胞侵袭(铺基质胶)与迁移(未铺基质胶)的Transwell小室的上室中,下室加入600 μL含10%胎牛血清的DMEM培养基,继续培养24 h。用无水甲醇固定已穿至Transwell小室底膜下表面上的细胞,并用结晶紫染色,显微镜下对细胞计数。
4 RT-qPCR检测miR-148a-3p表达水平
取HepG2细胞,用已筛选的UA剂量处理48h后,收集细胞。用Trizol试剂提取RNA,并经逆转录试剂盒转为cDNA。取引物和cDNA,用端粒酶活性荧光实时定量PCR法检测试剂盒在ABI7400荧光实时定量PCR系统中进行RT‐qPCR反应。并以U6为内参,用2‐△△CT法计算miR‐148a‐3p相对表达水平。
5 免疫荧光法观察PXR的表达
收集UA处理48 h的HepG2细胞,用4%多聚甲醛固定后,用0.5%Triton X‐100室温通透5 min,用PBS洗涤后加入兔源PXR抗体(1:1500)室温孵育1 h,再次用PBS洗涤后加入DyLight 488标记山羊抗兔IgG(1:1000)室温避光孵育40min,滴加DAPI染核后,激光共聚焦显微镜下观察。
6 细胞转染与功能分析
收集HepG2细胞,根据转染试剂盒说明书步骤,用Lipofectamine 2000对细胞分别转染miR‐NC、
miR‐148a‐3p inhibitor、miR‐148a‐3p mimic、sh‐NC、sh‐PXR、pcDNA或pcDNA‐PXR,转染48h后,收集细胞,然后再用或不用40 μmol/L的UA刺激48h。用CCK‐8法检测细胞活性,用Tranwell小室法检测细胞侵袭与迁移,用RT‐qPCR检测检测PXR mRNA的相对表达量(GAPDH mRNA为内参,检测步骤同4)。
7 Western blot检测PXR的表达
收集已处理的HepG2细胞,用RIPA提取蛋白后,用BCA法对蛋白定量后,每样品取等量(40μg)蛋白进行电泳。将电泳后的蛋白转移到PVDF膜上并用5%脱脂乳封闭。封闭后,将膜转移至抗体孵育盒,并用兔抗PXR抗体(1:1000)和兔GAPDH抗体(1:5000)在室温下孵育2 h,用含0.05%吐温‐20的PBS溶液洗涤3次后,用HRP标记山羊抗兔IgG(1:1000)室温孵育1 h,再次用含0.05%吐温‐20的PBS溶液洗涤3次。用ECL化学发光试剂使得蛋白条带发光显色,并用eBlot接触式化学发光成像系统(上海易孛特光电技术有限公司)采集蛋白条带图像。用Image‐pro Plus软件定量PXR相对于GAPDH条带的光密度值。
8 双荧光素酶报告基因分析miR-148a-3p与PXR的靶向关系
将StarBase 3.0数据库预测的与miR‐148a‐3p具有结合的PXR靶序列3’UTR‐PXR进行点突变。分别用PCR将野生型(WT)和突变型(MUT)的PXR扩增,然后构建WT和MUT的PXR的荧光素酶表达载体(PXR WT和PXR MUT)。用Lipofectamine 2000分别将miR‐NC+PXR WT、miR‐148a‐3p mim‐ic+PXR WT、miR‐NC+PXR MUT和miR‐148a‐3p mimic+PXR MUT转入HepG2细胞,继续培养48h。收集细胞,根据双荧光素酶报告基因检测试剂盒步骤,用荧光化学发光分析仪(Fluoroskan FL;美国Thermo Scientific公司)检测萤火虫荧光素酶的活性与海肾荧光素酶的活性,细胞的相对荧光活性以二者比值表示。
9 统计学分析
数据表示为均数±标准差(x±s),用GraphPad Prism 7.02软件对数据进行统计学分析。多组均数间的两两比较采用方差分析事后SNK-q法检验,以P<0.05表示差异具有统计学意义。
结 果
1 40μmol/L熊果酸对正常肝细胞系无毒且能抑制HCC细胞活性
CCK‐8检测显示:在0~80 μmol/L的浓度范围内,UA浓度依赖性地抑制HCC细胞系(BEL‐7404、Huh7、SMMC‐7721和HepG2)的细胞活性;而在80 μmol/L时,UA对正常肝细胞系(HL‐7702和HHL‐5)也具有细胞毒性(图1),因此,后续实验选择0~40 μmol/L的UA。

图1 适宜熊果酸浓度的筛选。A,不同浓度熊果酸下的HCC细胞系的细胞活性。B,不同浓度熊果酸下的正常肝细胞系的细胞活性。与0μmol/L组比较:*P<0.05,**P<0.01,***P<0.001;n=3Fig. 1 Screening for suitable ursolic acid concentration. A, cell viability of HCC cell lines treated with different concentrations of ursolic acid; B, cell viability of normal liver cell lines treated with different concentrations of ursolic acid. Compared with group 0 μmol/L: *P<0.05, **, P<0.01, ***,P<0.001; n=3
2 熊果酸抑制HepG2细胞的活性、迁移与侵袭
CCK‐8法和Transwell小室法检测显示:0~40 μmol/L的UA能浓度依赖性抑制HepG2细胞的细胞活性、迁移与侵袭(图2)。

图2 熊果酸对HepG2细胞活性、迁移与侵袭的影响。A,熊果酸对HepG2细胞活性影响的CCK‐8法检测。B,熊果酸对HepG2细胞迁移与侵袭影响的Transwell法分析;B1,细胞迁移与侵袭力代表性Transwell分析结果(比例尺,50 μm);B2和B3,细胞迁移(B2)与侵袭力(B3)统计学分析。与0 μmol/L组比较:*P<0.05,**P<0.01,***P<0.001;n=3Fig. 2 Effect of ursolic acid on the viability, migration and invasion of HepG2 cells. A, statisctical analysis of CCK‐8 assay for the effect of ursolic acid on the viabilities of HepG2 cells; B, Transwell analysis for the effect of ursolic acid on migration and invasion of HepG2 cells; B1, representative results of migration and invasion of HepG2 cells (scale bar, 50 μm); B2 and B3, statistical analysis of migration (B2) and invasion (B3) of HepG2 cells.*P<0.05, **P<0.01, ***P<0.001, compared with 0 μmol/L group; n=3
3 熊果酸上调HepG2细胞中miR-148a-3p的表达
qRT‐PCR检测显示:0~40 μmol/L的UA能浓度依赖性地上调HepG2细胞中miR‐148a‐3p的表达水平(图3)。

图3 熊果酸对HepG2细胞中miR‐148a‐3p表达的影响。与0 μmol/L组比较:*P<0.05,**P<0.01, ***P<0.001;n=3Fig. 3 Effect of ursolic acid on the expression of miR‐148a‐3p in HepG2 cells. Compared with 0 μmol/L group: *P<0.05, **P<0.01, ***P<0.001;n=3
4 miR-148a-3p inhibitor部分逆转熊果酸对HepG2细胞活性、迁移与侵袭的抑制作用
CCK‐8法和Transwell小室法检测显示:与miR‐NC组比较,UA+miR‐NC组HepG2细胞的活性、迁移与侵袭均明显降低;与UA+miR‐NC组比较,UA+miR‐148a‐3p inhibitor组HepG2细胞的细胞活性、迁移与侵袭均明显增加(图4)。
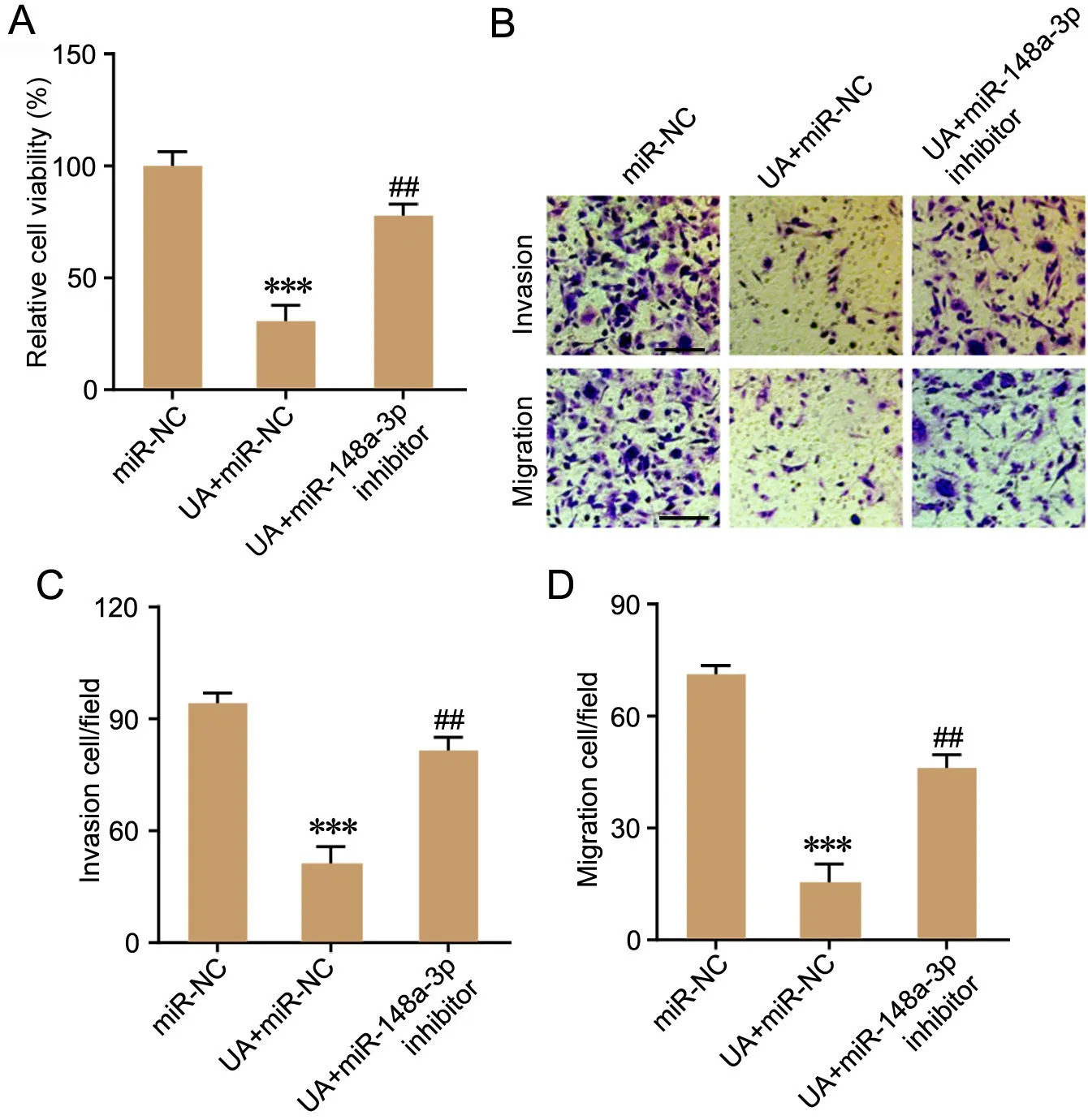
图4 miR‐148a‐3p 抑制剂对熊果酸抑制HepG2细胞活性、迁移与侵袭作用的影响。A,各组HepG2细胞活性。B—D,HepG2细胞的迁移与侵袭;比例尺,50μm。与miR‐NC组比较:***P<0.01;与UA+miR‐NC组比较:##P<0.01;n=3。Fig. 4 Effect of miR‐148a‐5p inhibitor on the inhibitory effects of ursolic acid on cell viability, migration and invasion of HepG2 cells. A, statisctical analysis of HepG2 cells viability; B to D, migration and invasion of HepG2 cells; scale bar, 50 μm. ***P<0.001 vs miR+NC group; ##P<0.01 vs UA+miR‐NC group; n=3
5 熊果酸和miR-148a-3p抑制孕烷X受体表达
免疫荧光染色显示,在UA处理的HepG2细胞中,PXR免疫反应性明显减弱,其中40μmol/L的UA较10 μmol/L的UA作用更明显(图5A)。进一步Western blot分析验证UA可降低PXR蛋白的表达(图5B)。双荧光素酶报告基因分析显示:过表达miR‐148a‐3p显著抑制PXR转录活性,PXR是miR‐148a‐3p的靶基因(图5C)。RT‐qPCR和Western blot显示:过表达miR‐148a‐3p能显著降低HepG2细胞中PXR水平(图5D、E)。
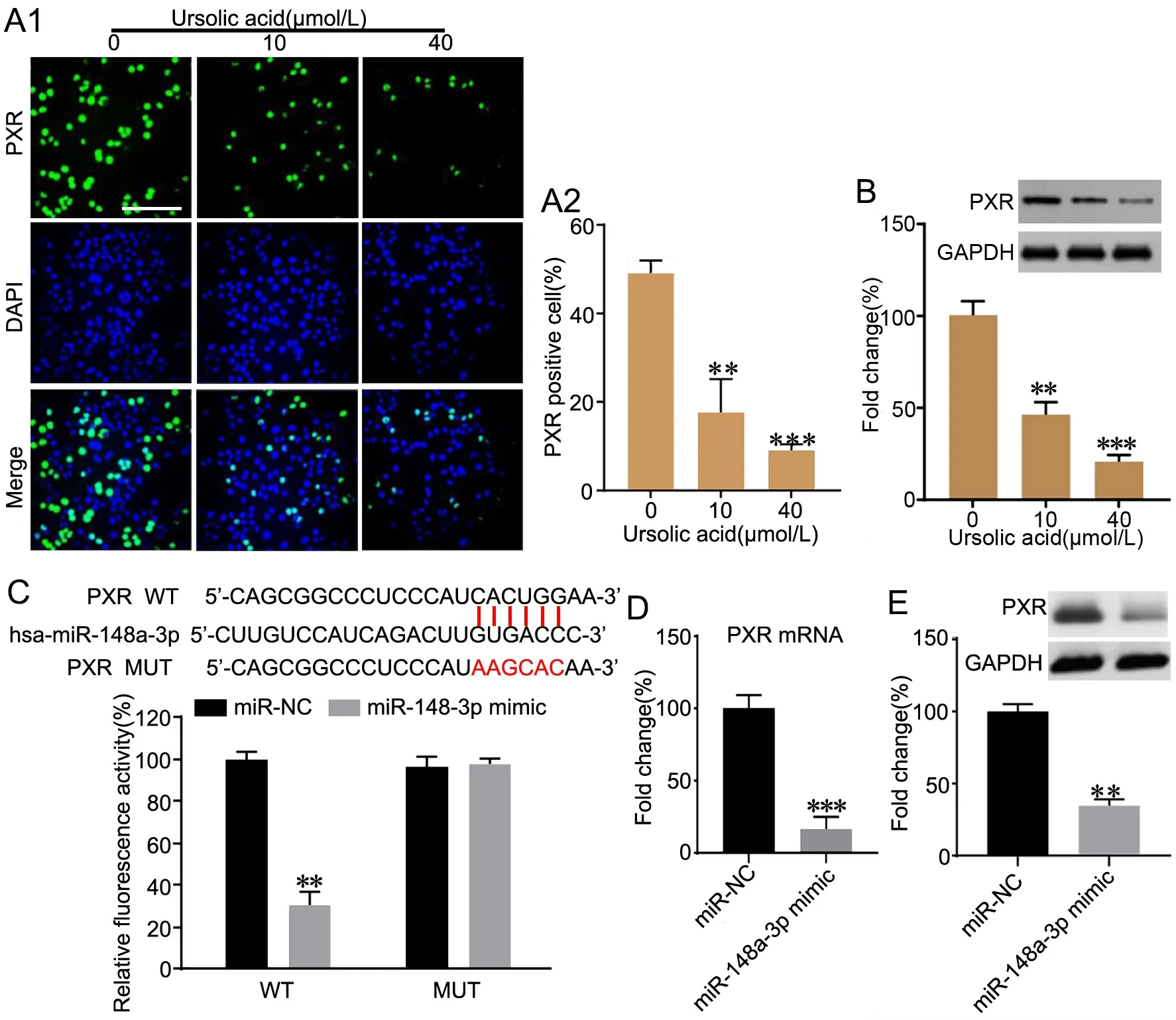
图5 熊果酸和miR‐148a‐3p对PXR表达的影响。A,熊果酸对HepG2细胞PXR免疫反应性影响的免疫荧光分析;A1,代表性免疫荧光检测结果(比例尺,100μm);A2, PXR免疫反应性的统计学分析。B,熊果酸对HepG2细胞PXR水平影响的Western blot分析;C,miR‐148a‐3p靶向的双荧光素酶报告基因分析。D和E,miR‐148a‐3p对PXR表达影响的RT‐qPCR(D)和Western blot检测(E)。与0 μmol/L组或miR‐NC组比较:**P<0.01,***P<0.01;n=3Fig. 5 Effects of ursolic acid and miR‐148a‐3p on PXR expression. A, immunofluorescence analysis of the effect of ursolic acid on PXR expression in HepG2 cells; A, representative results of immunofluorescence examination (scale bar, 100 μm); B, Western blot analysis of the effect of UA on PXR expression in HepG2 cells; C, analysis by duel‐luciferase reporter gene for mir‐148a‐3p targeting; D and E, detection by RT‐qPCR (E) and Western blot(F) for effect of miR‐148a‐3p on PRX expression. **P<0.01, ***P<0.001, compared with 0 μmol/L group or miR‐NC group; n=3
6 沉默PXR抑制HepG2细胞的活性、迁移与侵袭
通过转染sh‐PXR沉默细胞中PXR表达(图6A),CCK‐8和Transwell小室法分析表明:沉默PXR能抑制HepG2细胞的活性、迁移与侵袭(图6B、C)。

图6 沉默PXR对HepG2细胞活性、迁移与侵袭的影响。A,沉默效果验证;A1,代表性Western blot检测结果;A2,PXR水平的统计学分析。B,CCK‐8法检测转染sh‐PXR对HepG2细胞活性影响的统计学分析。C,转染sh‐PXR对HepG2细胞迁移与侵袭影响的Transwell法分析;C1, 转染sh‐PXR对HepG2细胞迁移与侵袭影响的代表性Transwell检测结果(比例尺,100μm);C2和C3,转染sh‐PXR对HepG2细胞迁移(C2)与侵袭(C3)影响的统计学分析。与对照组比较:***P<0.001;n=3Fig. 6 Effect of PXR silencing on the viability, migration and invasion of HepG2 cells. A, verification of silence effect; A1, representative Western blot test results; A2, statistical analysis of PXR level; B, CCK‐8 analysis for the effect of sh‐PXR transfection on the viability of HepG2 cells; C, Transwell analysis for the effect of sh‐PXR transfection on the migration and invasion of HepG2 cells; C1, representative Transwell test results of the effect of sh‐PXR transfection on the migration and invasion of HepG2 cells (scale bar, 100μm); C2 and C3, statistical analysis of the effects of sh‐PXR transfection on migration (C1) and invasion (C2) of HepG2 cells. ***P<0.001, compared with control group; n=3
7 过表达PXR减轻熊果酸对HepG2细胞活性、迁移和侵袭的抑制作用
为明确UA是否通过抑制PXR的表达而抑制HepG2细胞的增殖、侵袭和迁移,进一步检测了过表达PXR的HepG2细胞其在UA处理后活力、侵袭和迁移的变化。Western blot检测显示,过表达PXR能抑制UA所致的HepG2细胞PXR水平降低(图7A);CCK ‐8和Transwell分析显示,过表达PXR能显著减轻UA所致的HepG2细胞活力、侵袭力和迁移能力的下降(图7B、C)。

图7 过表达PXR对熊果酸抑制HepG2细胞活力、迁移和侵袭作用的影响抑制作用。A,过表达PXR 对UA处理HepG2细胞内PXR水平的影响;A1,PXR水平的代表性Western blot检测结果;PXR水平的统计学分析。B,过表达PXR对UA处理HepG2细胞活力影响的CCK‐8法检测。C,过表达PXR对UA处理HepG2细胞侵袭和迁移影响的Transwell法分析;C1,代表性Transwell检测结果(比例尺,100μm);C2,侵袭力统计学分析;C3,迁移力统计学分析。与pcDNA组比较: ***P<0.01;与UA+pcDNAr组比较:###P<0.01;n=3Fig. 7 Effects of PXR overexpression on the inhibitory effects of ursolic acid on the viability, migration and invasion of HepG2. A, effect of PXR overexpression on PXR level in UA treated HepG2 cells; A1, representative Western blot results of PXR level; A2, statistical analysis of PXR level;B, the effect of PXR overexpression on the viability of UA treated HepG2 cells detected by CCK‐8 method; C, Transwell analysis of the effect of PXR overexpression on the invasion and migration of UA treated HepG2 cells; C1, representative Transwell test results (scale bar, 100 μm); C2, statistical analysis of cell invasivon; C3, statistical analysis of cell migration. ***P<0.01, **P<0.01, compared with pcDNA vector group; ###P<0.01, compared with UA + pcDNA group; n=3
讨 论
目前,肝癌切除术后辅以的综合治疗策略存在毒副作用大且疗效不尽人意的缺点[3],因此,寻找毒副作用小且能具有防止HCC再次复发与转移的治疗策略尤为迫切。以往研究[4,5]报道,UA能抑制包含HCC细胞在内的多种肿瘤细胞的增殖,但其剂量范围并未做到精确分析。本研究发现,无正常肝细胞毒性剂量的UA能抑制HepG2细胞增殖、迁移与侵袭,提示UA是潜在的可用于肝癌切除术后综合治疗的替代药物。
本研究进一步对UA抑制HCC细胞增殖、迁移与侵袭的作用机制进行了探索。已有研究[6‐8]表明,miR‐148a‐3p在胃癌、食管癌和HCC等多种恶性肿瘤中低表达,过表达miR‐148a‐3p能抑制上述肿瘤细胞的增殖、迁移与侵袭。本研究结果显示,UA能浓度依赖性上调HepG2细胞中miR‐148a‐3p的表达水平,且miR‐148a‐3p inhibitor转染能部分逆转UA的治疗作用,说明UA能通过上调miR‐148a‐3p来发挥抑制HCC细胞增殖、迁移与侵袭的作用。众所周知,miRNAs是通过调控靶基因来发挥生物学功能。本研究进一步对miR‐148a‐3p的靶基因进行了探索,结果显示PXR是其靶基因。已有研究[9,10]明确显示,上调PXR能促进HCC细胞增殖、迁移与侵袭,且下调PXR能抑制肝癌的发生与进展。本研究结果显示,UA能抑制HepG2细胞中PXR的表达,且沉默PXR具有UA类似的效果,另外,过表达PXR后能消除UA处理对HepG2细胞的抑制作用,以上表明UA可通过上调miR‐148a‐3p表达及由此抑制PXR的表达而抑制肝癌细胞的增殖、侵袭和迁移。这初步揭示了熊果酸对肝癌细胞抑制作用的分子机制。
综上所述,无正常肝细胞毒性剂量的UA能抑制HepG2细胞增殖、迁移与侵袭,且这些作用可能与其调节miR‐148a‐3p/PXR轴相关。本研究还提示,UA可能是肝癌术后综合治疗的替代药剂,但具体作用仍需进一步探索。
