氮磷和盐度对杜氏盐藻生产性能的正交优化试验
2021-03-16郁彬琦靳翠丽周晓见
郁彬琦 靳翠丽,2 刘 青,2 周晓见,2*
(1.扬州大学环境科学与工程学院,江苏扬州225127;2.扬州大学海洋科学与技术研究所,江苏扬州225127)
杜氏盐藻(Dunaliella salina)属于绿藻门、绿藻纲、团藻目、盐藻科、盐藻属,是一种没有细胞壁的单细胞嗜盐性真核藻类[1]。杜氏盐藻光合自养,生长速度快,细胞物质组成丰富;不仅含有丰富的油脂、β-胡萝卜素、蛋白质、多糖、甘油,以及较高的Ca、P、Zn 等矿物质,而且还含有包括必需氨基酸在内的18 种氨基酸。杜氏盐藻作为重要的水产开口饵料和常规生物饵料在鱼、虾、贝类育苗和养殖中得到了广泛应用,是重要的饲料添加剂,也是保健食品、精细化工、生物质能源开发等众多行业的重要原料生物[2-4]。
杜氏盐藻的生物量产出及营养组成直接影响其培养的经济效益[5]。其中,杜氏盐藻的生物量产出受多种生长条件影响,包括营养盐、光照、温度、盐度、pH 值等[6-10]。而在不同培养条件下生长的细胞的物质组成,如糖类、蛋白质、脂肪、色素的含量,也会有显著差异。因此,通过优化盐藻的培养条件可能获得更高生物量和更高品质的目标产品[5]。在杜氏盐藻生长过程中,氮和磷是影响其生物量和物质组成的主要营养盐[11-12]。另外,由于杜氏盐藻是嗜盐性单胞藻,盐度也是杜氏盐藻至关重要的生长条件之一,会影响细胞的渗透压和比重,进而影响生长和细胞物质组成[13-14]。
所以,本文以杜氏盐藻为对象,研究不同氮、磷的供给水平及不同盐度对其生长及物质产量的影响,通过正交试验,探寻不同培养目标的最佳培养条件,为杜氏盐藻的规模化培养与开发提供试验依据。
1 材料与方法
1.1 藻种来源
试验藻种为杜氏盐藻(D.salina,UTEX-LB-1644),由中国海洋大学水产学院藻种室提供。
1.2 培养条件和试验设计
杜氏盐藻采用一次性培养方式,250 mL 三角瓶中装有150 mL 培养液,取对数生长期藻种进行接种,接种后的初始密度为0.050×106个∕mL。三角瓶置于光照培养箱培养,光暗比12 h∶12 h,光照强度4 000 Lux,温度25 ℃,每天摇两次。
预试验:杜氏盐藻的培养采用人工海水(盐度30‰)配置的f∕2 培养基。其中氮源为NaNO3(终浓度为75 mg∕L),磷源为NaH2PO4·H2O(终浓度为5 mg∕L),氮和磷浓度在f∕2 配方标准浓度基础上设置1∕8、1∕4、1∕2、1、3倍共5个浓度梯度,盐度在20‰~90‰之间设置20‰、30‰、60‰、90‰共4 个梯度,以确定后期正交试验测试的浓度或盐度范围,三个重复,培养12 d。
正交试验:根据预试验结果确定氮的三个水平设置为NaNO3浓度分别为9.375、18.75、75.00 mg∕L,磷源三个水平设置为NaH2PO4·H2O 浓度分别为1.25、2.50、5.00 mg∕L,盐度三个水平设置为20‰、30‰、60‰,形成三因素三水平的正交试验。选择L9(34)正交表安排试验,试验设置见表1,共有9 组试验,每组试验重复2 次,培养时间14 d。其中试验9(75.00 mg∕L NaNO3,5.00 mg∕L NaH2PO4·H2O 和盐度30‰)为正常f∕2培养条件,作为正交试验优化的对照。
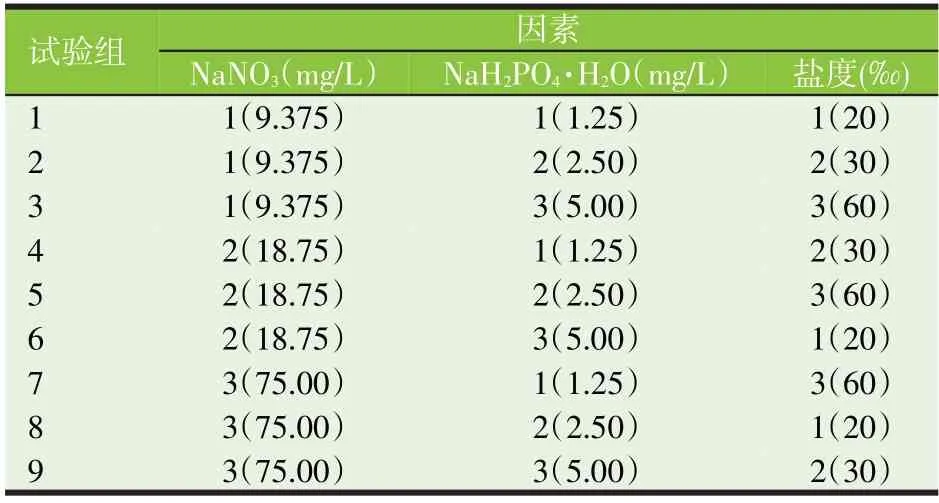
表1 正交试验方案
1.3 测定方法
1.3.1 杜氏盐藻的生长情况测定
用血球计数板计数杜氏盐藻细胞数量,再用酶标仪测定相应的OD660值,绘制吸光度与藻细胞密度的标准曲线。每24 h 测定藻液的OD660值,根据标准曲线计算相应的细胞密度,计算比生长速率,其公式为:
μ=(lnN-lnN0)∕T
式中:μ——比生长速率(d-1);
N0——起始细胞密度(×106个∕mL);
N——经过T时间后的细胞密度(×106个∕mL);
T——生长时间(d)。
1.3.2 杜氏盐藻的物质产量测定
培养14 d 后收获杜氏盐藻,测定藻粉干重、总脂含量、蛋白质含量和总糖含量,计算各处理的物质产量。
藻粉干重和总脂含量测定:取藻液110 mL 于4 000 r∕min离心10 min,沉淀用蒸馏水洗涤1次,转移至小玻璃瓶中,放入-80 ℃冰箱中预冻,再于冻干机中冻干成藻粉后,放入真空干燥箱中干燥至恒重,得干藻粉,称重记录。采用氯仿∕甲醇抽提法测定杜氏盐藻细胞内总脂含量[15]:精确称取10~50 mg干藻粉于离心管中,加入0.8 mL蒸馏水,使其充分混匀后,加入1 mL氯仿、2 mL甲醇,冰浴超声波破碎(700 W,超声5 s,间隔3 s)10 min,继续加1 mL 氯仿充分振荡混匀,再加1 mL 蒸馏水振荡混匀,4 000 r∕min离心10 min,除去水层及藻细胞碎片层,保留氯仿层,蒸馏水洗涤两次,吸取下层氯仿层于已经烘干称重好的试管中,常温下蒸发溶剂后,放置50 ℃烘箱中烘30 min,称重记录。
蛋白质和总糖含量测定:采用考马斯亮蓝染色法测定蛋白质含量[16],苯酚-硫酸法测定总糖含量[17]。具体方法:取10 mL 藻液于4 000 r∕min 离心10 min,去上清,用去离子水定容至10 mL,摇匀。冰浴超声破碎(700 W,超声3 s,间隔3 s)10 min。再次离心,取上清液1 mL。加入5 mL 考马斯亮蓝染色液,摇匀静置反应5 min,在595 nm 处测定吸光度,根据用已知浓度的牛血清蛋白溶液测定的标准曲线计算蛋白质含量。另取上清液1 mL,加入0.5 mL 6%苯酚溶液摇匀,用移液管迅速垂直滴入2.5 mL 浓硫酸,摇匀静置反应30 min,在490 nm下测定吸光度,根据用已知浓度葡萄糖溶液测定的标准曲线计算总糖含量。
1.4 数据处理
试验所获得的数据利用IBM SPSS 22 软件分析。正交试验组别间差异选择单因素ANOVA 方差分析,利用最小显著差数法(LSD 法)进行多重比较。正交试验方差分析选择一般线性模型对氮、磷浓度和盐度的效应进行分析。各分析指标差异显著性以P=0.05 或0.01 作为标准[18]。绘图采用Microsoft Excel软件。
2 结果
2.1 杜氏盐藻培养的盐度、氮和磷浓度预试验结果
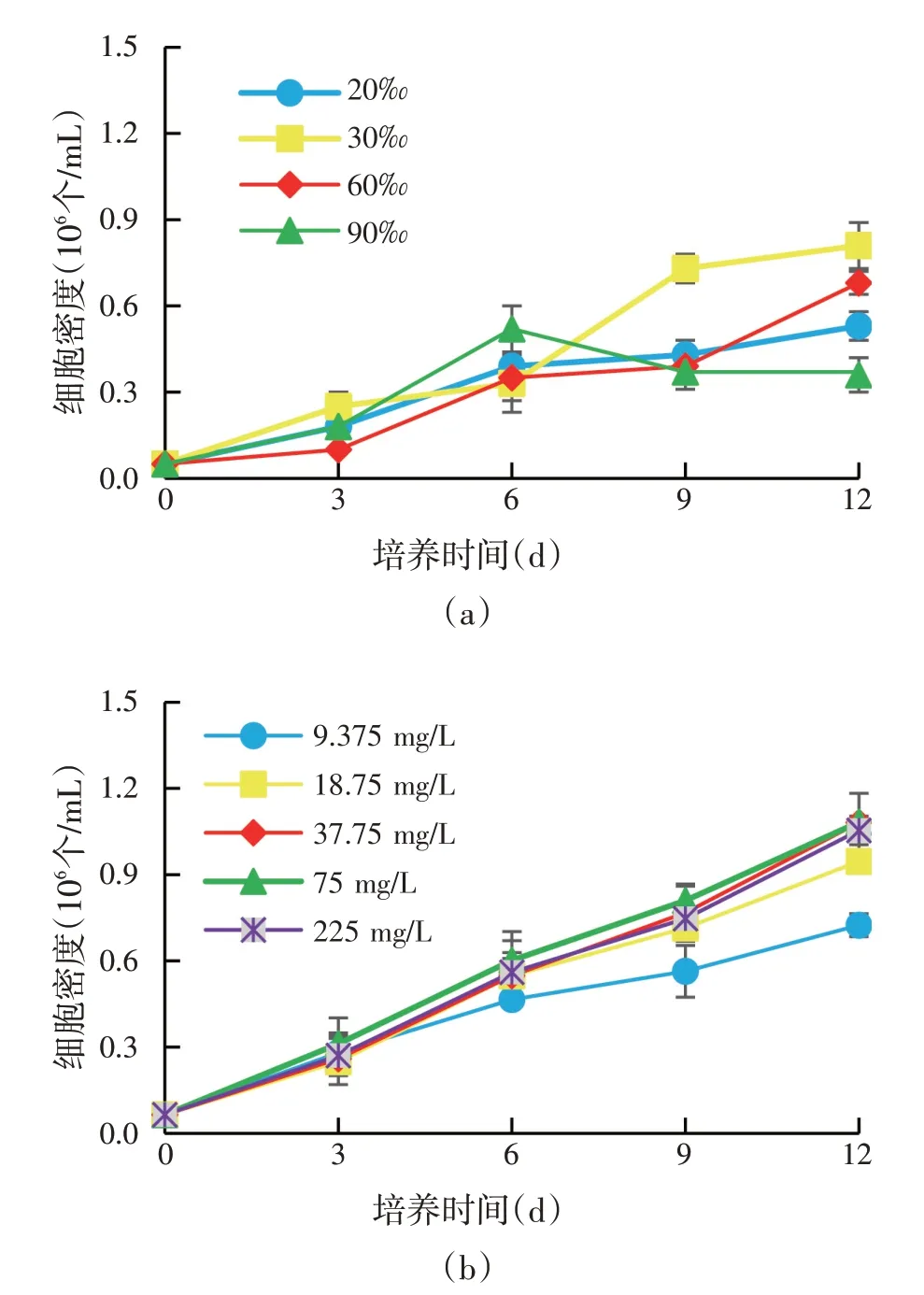
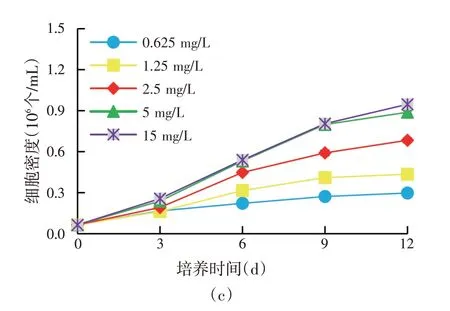
图1 不同盐度(a)和氮(b)、磷(c)浓度下杜氏盐藻的生长情况
杜氏盐藻在盐度20‰~90‰之间都能生长[图1(a)]。其中盐度90‰时生长较差,培养12 d 后细胞密度远低于其他盐度。因此,将进一步优化的盐度范围确定为20‰~60‰。杜氏盐藻在氮源(NaNO3)浓度9.375 mg∕L 到75 mg∕L 之间都能正常生长[图1(b)],且继续升高至225 mg∕L时相对于75 mg∕L未体现出明显优势。9.375 mg∕L浓度下仍能表现为明显的细胞密度增长。因此,将进一步优化的氮源(NaNO3)浓度确定为9.375~75 mg∕L。杜氏盐藻在磷源(NaH2PO4·H2O)浓度为0.625 mg∕L 到15 mg∕L 之间生长情况差异较大[图1(c)],0.625 mg∕L的低浓度磷源(NaH2PO4·H2O)浓度严重抑制杜氏盐藻的生长,而15 mg∕L相对于5 mg∕L处理的优势也并不明显。因此,将进一步优化的磷源(NaH2PO4·H2O)浓度确定为1.25~5 mg∕L。
2.2 正交试验不同组别杜氏盐藻的生长情况
根据上述预试验结果,设计并进行了杜氏盐藻在不同氮和磷浓度、盐度组合的正交试验。在不同的试验条件下,培养14 d后的细胞密度范围为0.489×106~0.806×106个∕mL 之间,比生长速率为0.162~0.198 d-1(表2)。对照组9细胞密度为0.670×106个∕mL,试验组5、7均超过对照组,尤其试验组5在正交试验9个组中杜氏盐藻生长最优,最终细胞密度和比生长速率分别达到最低组(试验组6)的1.6倍和1.2倍。
2.3 正交试验不同组别杜氏盐藻的物质产量
从收获的杜氏盐藻藻粉干重结果来看[图2(a)],杜氏盐藻在试验组5的条件下得到的藻粉干重最大,显著高于其他试验组包括对照组,其次是试验组7,而藻粉干重最低的是试验组1,只有试验组5 的1∕2。从蛋白质产量看[图2(b)],试验组7、8、9的蛋白质含量显著高于其他试验组,最高值是试验组8,产量是最低试验组3 的2.3 倍。各试验组的糖产量也有显著差异[图2(c)],试验组1、2、6和9组的糖产量最高,而试验组5和7的糖产量最低,最高值试验组1的糖产量是最低值试验组5的3.2倍。各试验组的脂肪产量也有显著差异[图2(d)],试验组5、6和7组的杜氏盐藻细胞内脂肪含量显著高于其他组,其余试验组包括对照组杜氏盐藻的脂肪含量较低且无显著差异,脂肪产量最高(第7组)可达22.783 mg∕L,是试验组8的5.8倍。
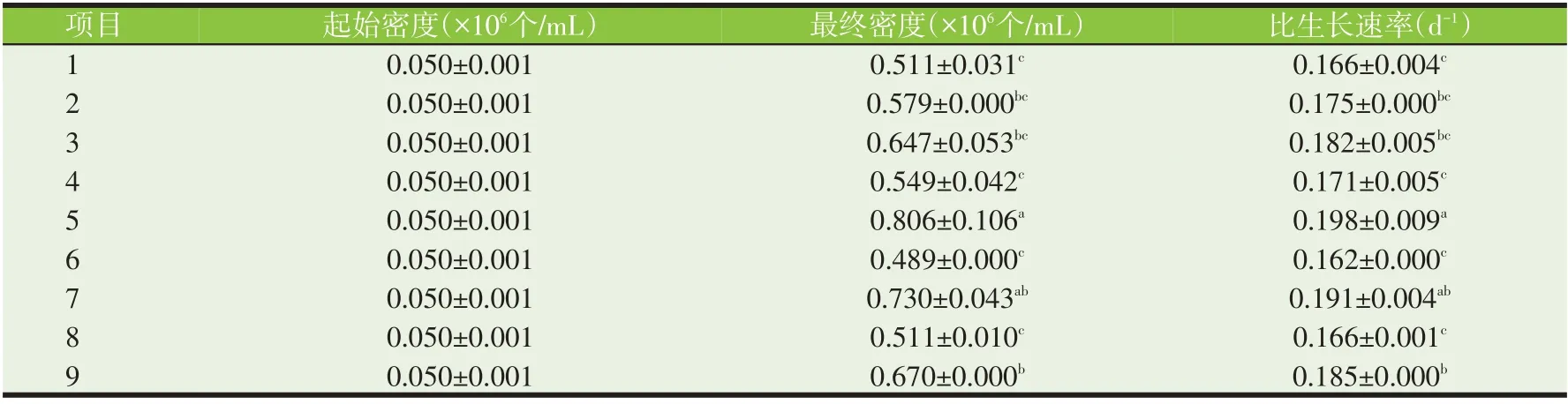
表2 各试验组杜氏盐藻的生长情况
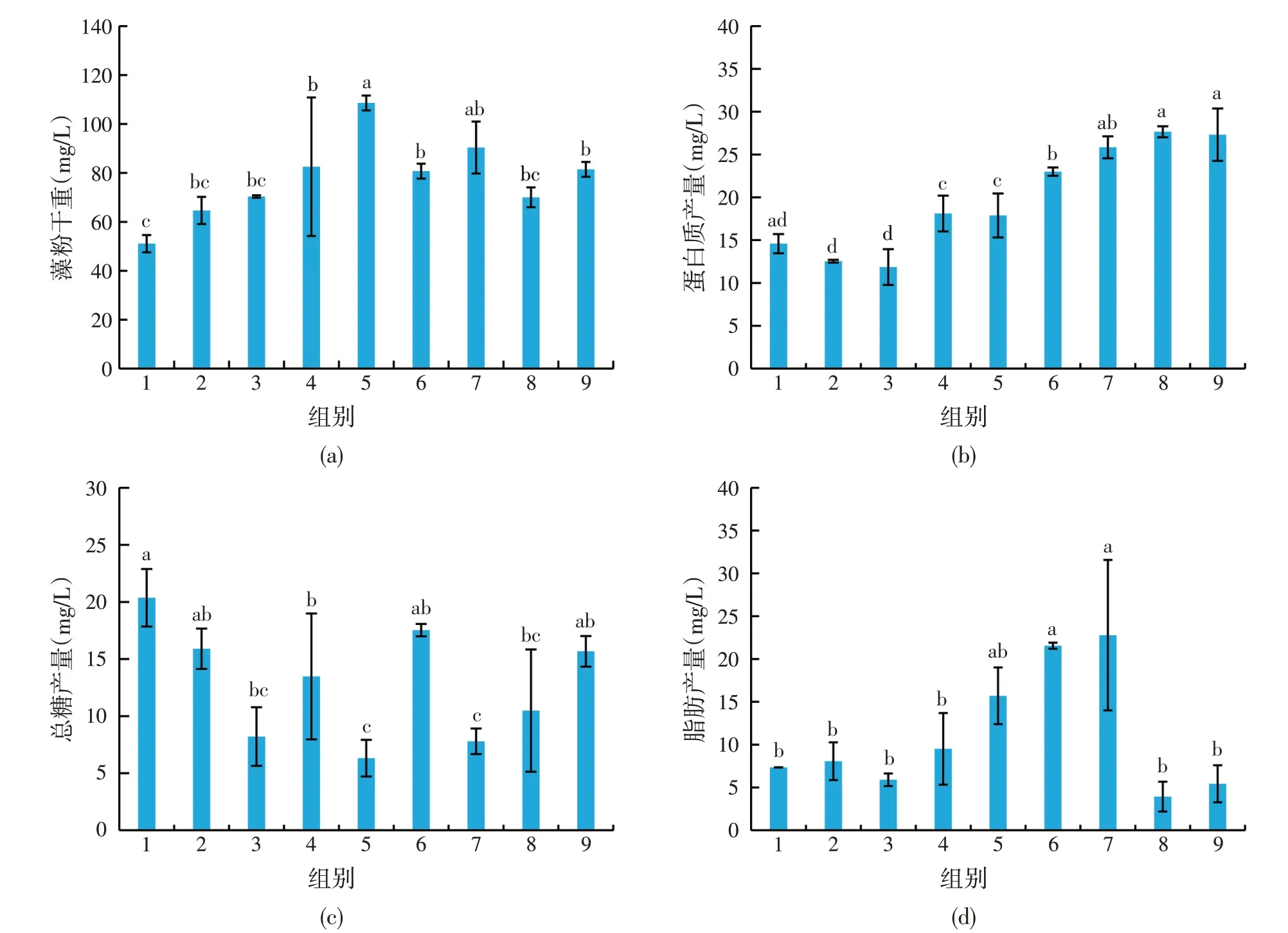
图2 各试验组杜氏盐藻的物质产量
2.4 正交试验对杜氏盐藻产量有显著性影响的因素分析
对正交试验所得的试验结果进行直观分析,发现试验的三个因素对杜氏盐藻收获时得到的藻粉干重和蛋白质产量的影响相似,由大到小依次均为:氮源(NaNO3)浓度>盐度>磷源(NaH2PO4·H2O)浓度。而对总糖产量和脂肪产量的影响也相似,由大到小依次均为:盐度>氮源(NaNO3)浓度>磷源(NaH2PO4·H2O)浓度。三个因素中,对杜氏盐藻四类物质产量的综合影响最小的是磷源(NaH2PO4·H2O)。
对正交试验的三个因素进行方差分析,结果见表3。三个因素中,氮源(NaNO3)浓度对藻粉干重、蛋白质产量均有极显著影响(P<0.01)。盐度对藻粉干重、总糖产量也都有极显著影响(P<0.01),且对蛋白质产量有显著性影响(P<0.05)。而磷源(NaH2PO4·H2O)对所有产量影响都不显著(P>0.05)。
将有显著性影响的因素对物质产量作图得到图3。从图3(a)可以发现,藻粉干重在氮源(NaNO3)浓度为18.75 mg∕L 时达到最大值,氮源(NaNO3)浓度为75 mg∕L 的藻粉干重高于9.38 mg∕L 时的藻粉干重。从图3(b)可以发现,藻粉干重随盐度升高而升高,在60‰最高。从图3(c)可以发现,蛋白质产量随氮源(NaNO3)浓度增大而增大,在75 mg∕L 时最高。从图3(d)可以发现,蛋白质产量随盐度升高而降低,盐度20‰时蛋白质产量最高。从图3(e)可以发现,总糖产量随盐度升高而降低,在盐度20‰时总糖产量最高。由于各因素对总脂产量的影响、磷源(NaH2PO4·H2O)浓度对各物质产量的影响、以及氮源(NaNO3)浓度对总糖产量的影响未达到显著水平,未做分析。
综合来看,氮和盐度对杜氏盐藻的产量影响显著,以藻粉干重为目标的生产,可以选用氮源(Na⁃NO3)浓度和盐度为18.75 mg∕L 和60‰ 的组合,以蛋白质产量为目标的生产,可以选择氮源(NaNO3)浓度75 mg∕L和盐度20‰ 的组合,以总糖产量为目标的生产则以盐度20‰为最优条件。
3 讨论
杜氏盐藻是优质的水产动物着色剂,能够改善养殖动物的体色,还可以提高动物的生长速度和饲料转化率,并减少疾病[19-21]。因此,杜氏盐藻藻粉的添加对于提高饲料质量和饲养的动物产品质量均具有重要意义。正交试验结果表明,试验组5 的培养条件对藻粉干重的获取最为有利,其具体条件为NaNO318.75 mg∕L、NaH2PO4·H2O 2.50 mg∕L、盐度为60‰,属于中等浓度的氮磷供应、高盐度条件。当培养目的为饲料添加藻粉时,该条件可显著提高藻粉产量,从而提高培养的经济效益。
杜氏盐藻作为水产养殖中的优质饵料,是优质的饲料蛋白质来源[22-23]。本正交试验结果表明,随着氮源浓度升高,蛋白质产量持续上升。另外,低盐也有利于蛋白质生产。所以,当培养目的对产出的藻粉蛋白质含量要求较高时,杜氏盐藻的培养应在保证氮源供给充足的情况下,适当降低培养体系的盐度,可达到提升杜氏盐藻细胞蛋白质含量的目的。杜氏盐藻多糖具有抗氧化、抑菌、消炎、增强肌体免疫等多种生物活性和功能,还能显著降低贮藏后期对虾的硬度[24-26]。本试验研究的因素中,盐度对总糖的产量有极显著的影响,低盐有利于杜氏盐藻细胞的总糖的积累,高盐度对总糖积累的抑制较为强烈[图3(e)]。另外,考虑到低盐也有利于蛋白质的积累,所以,目标为高总糖和蛋白质含量的杜氏盐藻培养,推荐低盐培养条件。
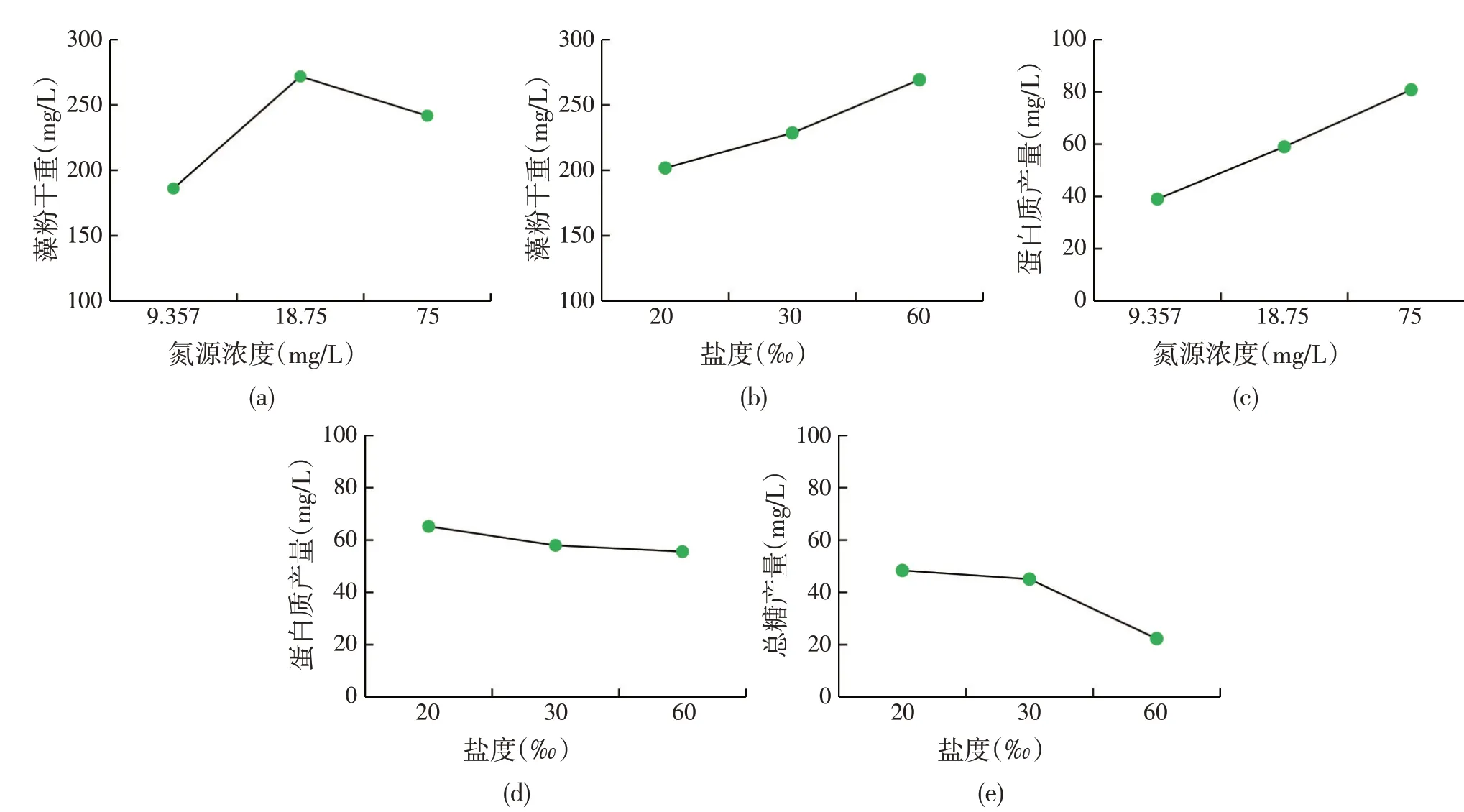
图3 氮源(NaNO3)浓度和盐度对杜氏盐藻物质产量的影响
4 结论
综上所述,盐度和培养基的氮源浓度,对于提高杜氏盐藻的物质生产有显著效果,磷源浓度对各物质生产的影响不显著。其中,氮源供应充足有利于蛋白质的生产,低盐度(20‰)有利于蛋白质和总糖的生产,中等浓度的氮源(NaNO318.75 mg∕L)和高盐度(60‰)有利于藻粉干重的生产。根据杜氏盐藻的不同培养目的,对盐度和氮源浓度进行合理的组合,能够使杜氏盐藻的培养效益进一步提高。
