蒙古栎体细胞胚胎发生技术研究
2021-03-16李美莹金子涵刘春萍陆秀君
李美莹,李 前,金子涵,刘春萍,陆秀君
(沈阳农业大学 林学院,辽宁 沈阳 110866)
蒙古栎Quercusmongolica是壳斗科Fagaceae栎属Quercus落叶乔木,广泛分布于寒温带、温带和暖温带[1]。蒙古栎是国家二级珍贵树种,同时也是我国东北地区主要的次生林树种[2]。蒙古栎具有很高的应用价值,是我国主要的用材树种之一;也可作为经济林树种,木材可用来制作精美的葡萄酒桶[3];同时蒙古栎种实可提取单宁,具有良好的清热解毒功效,药用和食用价值较高[4]。
蒙古栎生长周期长,结实晚,产量低,种子有大小年,良种匮乏。此外种子贮藏困难,容易受到多种昆虫侵害,因此蒙古栎种子园建立较为困难[5]。体细胞胚胎发生是木本植物大规模繁殖的重要方式之一[6],具有繁殖速度快、数量多、能形成完整植株和再生率高等优点[7]。近年来,关于栎属植株体细胞胚胎发生的报道有很多,Kim等[8]于1997年首次以生长在韩国的栓皮栎Quercusvariabilis合子胚为外植体,成功诱导出体细胞胚。张存旭[9]在2003年以陕西省栓皮栎天然林中的未成熟合子胚为外植体成功诱导出体细胞胚。2009年魏爽[10]以采集于沈阳农业大学天柱山的辽东栎Q.liaotungensis未成熟合子胚为外植体成功诱导出体胚。廖婧[11]以麻栎成熟合子胚为外植体成功诱导出体细胞胚。张翠叶[12]以川滇高山栎Q.aquifolioides未成熟合子胚为外植体成功进行体胚诱导。但目前没有关于蒙古栎体细胞胚胎发生形成再生植株及体细胞胚胎发生最佳培养条件的研究报道。
本文对蒙古栎体细胞胚胎发生进行了初步研究,探究胚性愈伤组织的最佳诱导条件,旨在建立蒙古栎体细胞胚胎发生体系,获得蒙古栎再生植株,为工厂化育苗等提供技术支持和理论基础。
1 材料与方法
1.1 材 料
2017年、2018年的6月25日至9月10日,分别在沈阳农业大学校园内、辽宁省实验林场(抚顺清原湾甸子镇)地车沟工区采集优良蒙古栎植株的未成熟种子。采集的种子放入4 ℃冰箱备用。
1.2 方 法
1.2.1 初代培养
1.2.1.1 最佳取材时间的确定
2018年6月25日至9月10日,每15 d在同一株母树采集未成熟种子,设置6种取材时间。采集的未成熟种子在流水下冲洗1 h后移至超净台。用75%酒精消毒30 s,无菌水冲洗3~5次,然后用0.1%升汞消毒12 min,并不断地摇动瓶身,使外植体与消毒液充分接触,最后用无菌水冲洗3~5次,用解剖刀切开种子,将下胚轴及胚根紧贴培养基的方式进行接种。启动培养基选用MS+琼脂6 g·L-1+蔗糖30 g·L-1+水解酪蛋白0.5 g·L-1,添加激素2,4-D(0.1、0.5、1 mg·L-1)和6-BA(0、0.5、1、2 mg·L-1)。
1.2.1.2 适宜光照条件的筛选
将上述启动培养材料分别设置光照培养16 h·d-1(光照强度2 000~3 000 lx)和全程暗培养。
1.2.1.3 种源对体胚诱导的影响
将8月下旬在沈阳农业大学校园内、辽宁省实验林场(抚顺清原湾甸子镇)地车沟工区采集未成熟蒙古栎种子,分别标记为种源1、种源2,培养基和培养条件同上。
每种处理接种30个外植体,重复3次。观察愈伤组织形态并统计胚性愈伤组织的诱导率。
1.2.2 继代培养
初代培养30 d后,选择生长旺盛、颜色为乳黄色或乳白色的胚性愈伤组织,进行继代培养的培养基配比筛选。以MS为基本培养基,添加琼脂6 g·L-1、蔗糖30 g·L-1、水解酪蛋白0.5 g·L-1,添加NAA (0.1、0.5、1 mg·L-1)和6-BA(0、0.5、1、2 mg·L-1)。每种处理接种30个外植体,重复3次。30 d后观察胚性愈伤组织增殖情况。
愈伤组织诱导率=(诱导出愈伤组织的外植体数量/接种的外植体总数)×100%
体胚诱导率=(诱导出体胚的外植体数量/接种的外植体总数)×100%
1.2.3 培养条件
培养室温度(23±2)℃,光照强度2 000~3 000 lx,光照时间16 h·d-1,培养基pH值调至5.8。
1.3 数据处理
使用Excel对所获得数据进行记录、统计,使用SPSS Statistics 17.0对数据进行处理,采用Duncan多重比较法进行差异显著性分析。
2 结果与分析
2.1 取材时间对初代培养的影响
不同取材时间对胚性愈伤组织的诱导存在显著影响(表1)。总体来看,以7月上旬采集的种子(合子胚大小约10 mm)为外植体,体胚诱导率最高85.7%。7月下旬到9月上旬外植体的体胚诱导率逐渐下降,8月开始产生愈伤组织的时间较长。因此,在体胚诱导过程中外植体应选取7月上旬蒙古栎未成熟合子胚。
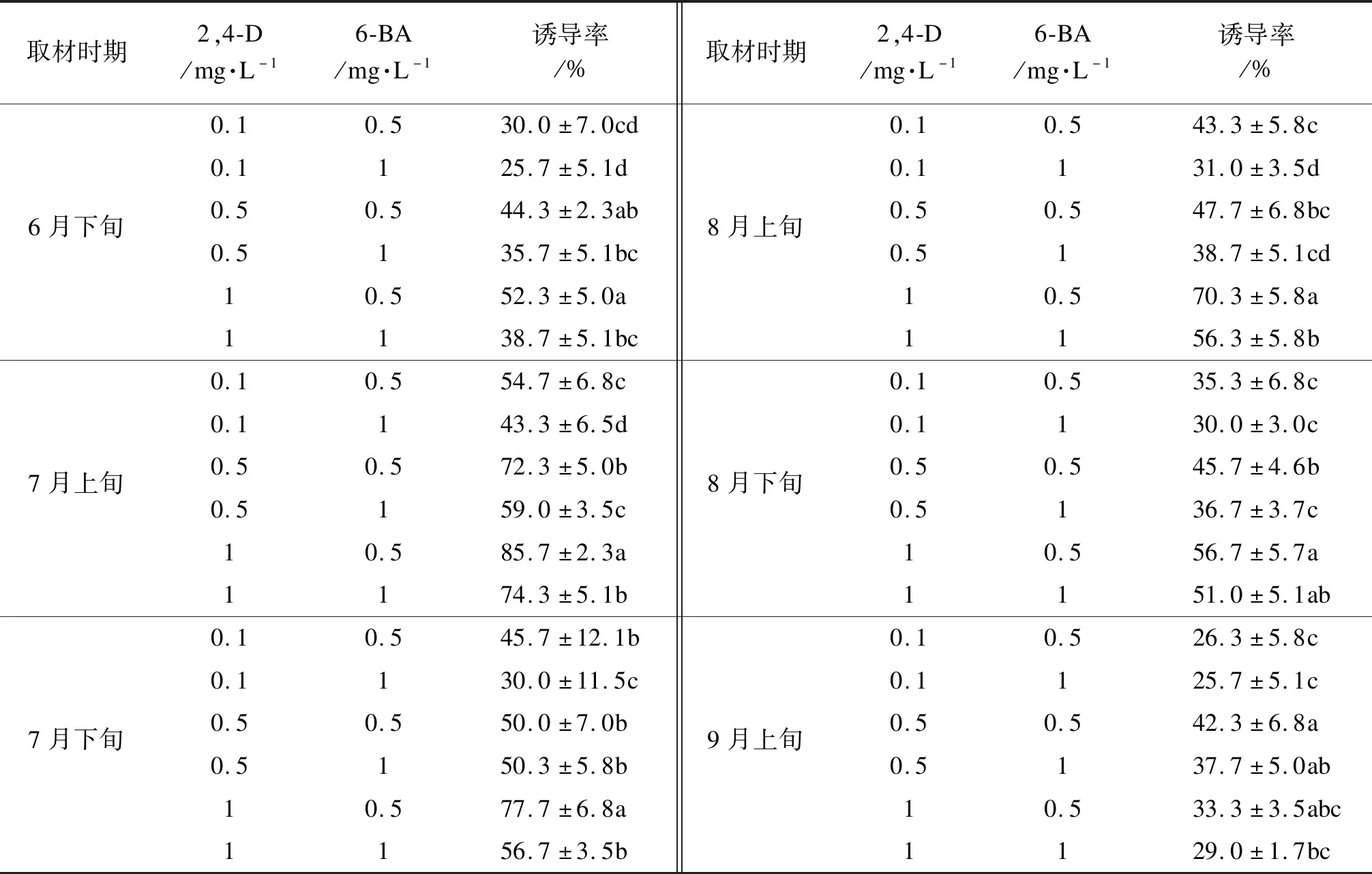
表1 取材时期对体胚诱导的影响
2.2 不同激素配比对初代培养的影响
由表2可知,不同质量浓度激素配比对体胚诱导差异显著。当只添加2,4-D时,体胚诱导率很低。随着6-BA质量浓度增加,体胚诱导率显著提高,但当6-BA质量浓度超过1 mg·L-1时,体胚诱导率开始下降;当2,4-D质量浓度逐渐增加时,体胚诱导率随之上升。由此可知,添加2,4-D和6-BA可显著提高体胚诱导率。因此蒙古栎未成熟合子胚的最佳诱导培养基为MS+2,4-D 1 mg·L-1+6-BA 0.5 mg·L-1+水解酪蛋白0.5 g·L-1,诱导率77.7%。
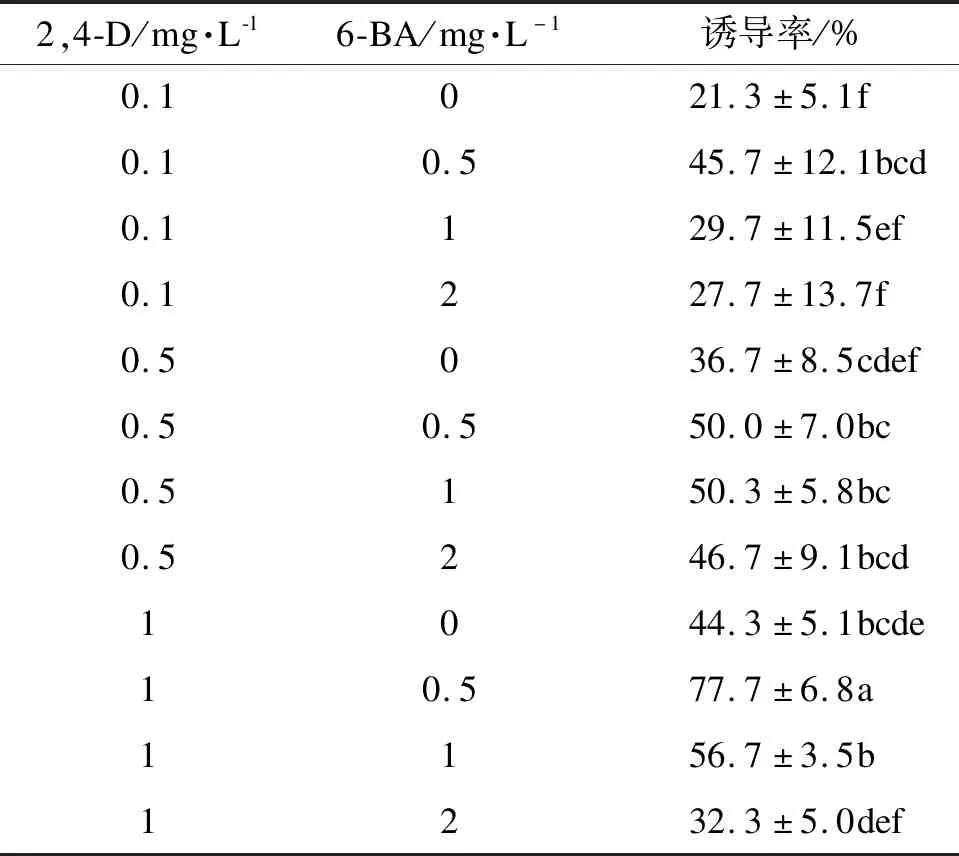
表2 不同激素配比对体胚诱导的影响
2.3 光照条件对初代培养的影响
由图1可知,蒙古栎未成熟合子胚诱导出的愈伤组织有两种状态:光照培养下(图1a、b)呈白色团状,表面滑腻,结构紧密,多数易形成非胚性愈伤组织;暗培养下(图1c)愈伤组织生长健壮,呈白色颗粒状,可多次继代增殖培养。
由表3可知,光照培养的体胚诱导率最高76.7%,暗培养的体胚诱导率最高77.7%,两者差异不显著。因此为获取胚性愈伤组织,应选用暗培养。
2.4 种源对初代培养的影响
不同种源均能诱导出胚性愈伤组织,但诱导率差异显著(表4)。在激素配比为2,4-D 0.5 mg·L-1、6-BA 1 mg·L-1的条件下,种源2的诱导率最高49%,且高于种源1;其余3种处理下,种源1的诱导率均高于种源2,且2,4-D 1 mg·L-1、6-BA 0.5 mg·L-1的诱导率最高56.7%。由图2可知,种源对愈伤组织的状态也存在影响,种源2的未成熟合子胚(去子叶)在培养过程中容易褐化(图2 a),继续培养容易变成结构紧密的非胚性愈伤组织(图2 b)。

注:a光照培养条件下愈伤组织结构紧实;b光照培养条件下愈伤组织表面滑腻;c黑暗培养条件下愈伤组织颜色为白色,呈现出颗粒状,结构松散。
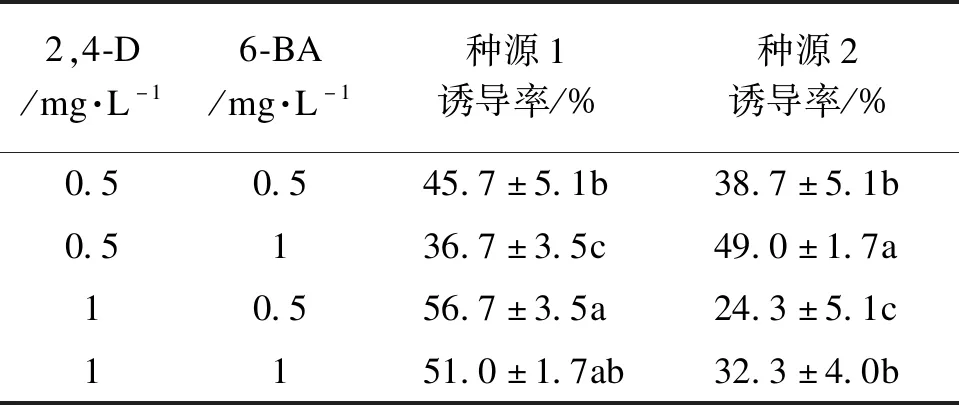
表4 不同种源对体胚诱导的影响
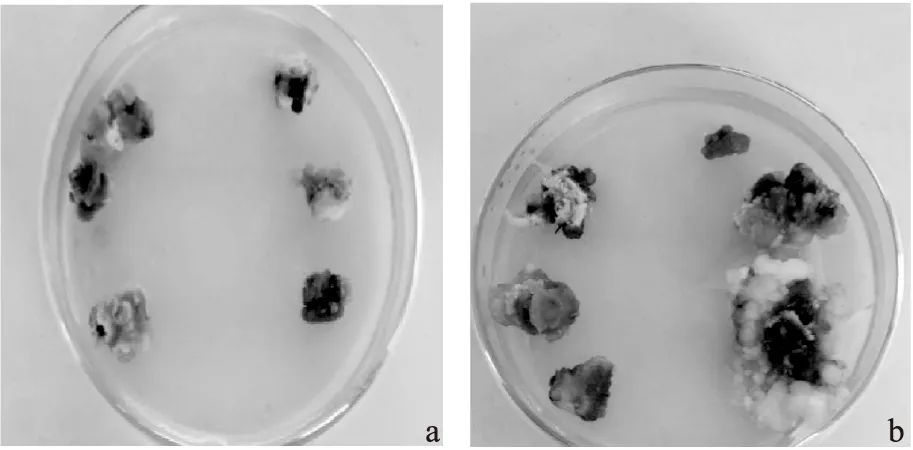
注:a种源2未成熟合子胚诱导的愈伤组织;b经过继代的种源2的未成熟合子胚诱导的愈伤组织。
2.5 不同激素配比对继代培养的影响
从表5可以看出,在NAA 0.5 mg·L-1、6-BA 0.5 mg·L-1的激素配比下,培养14 d即可在白色颗粒状愈伤组织(图3 a)和褐色颗粒状愈伤组织(图3 b)的表面观察到白色透明、大小不一的球形胚(图3 c、d),培养至第4周左右球形胚继续生长发育变大、变多(图3 e、f),且体胚增殖率最大72.3%。当激素质量浓度过高时,在继代培养过程中容易变为白色或褐色紧实结构(图3 i)的非胚性愈伤组织,在培养过程中不能继续分化出球形胚(图3 h)。
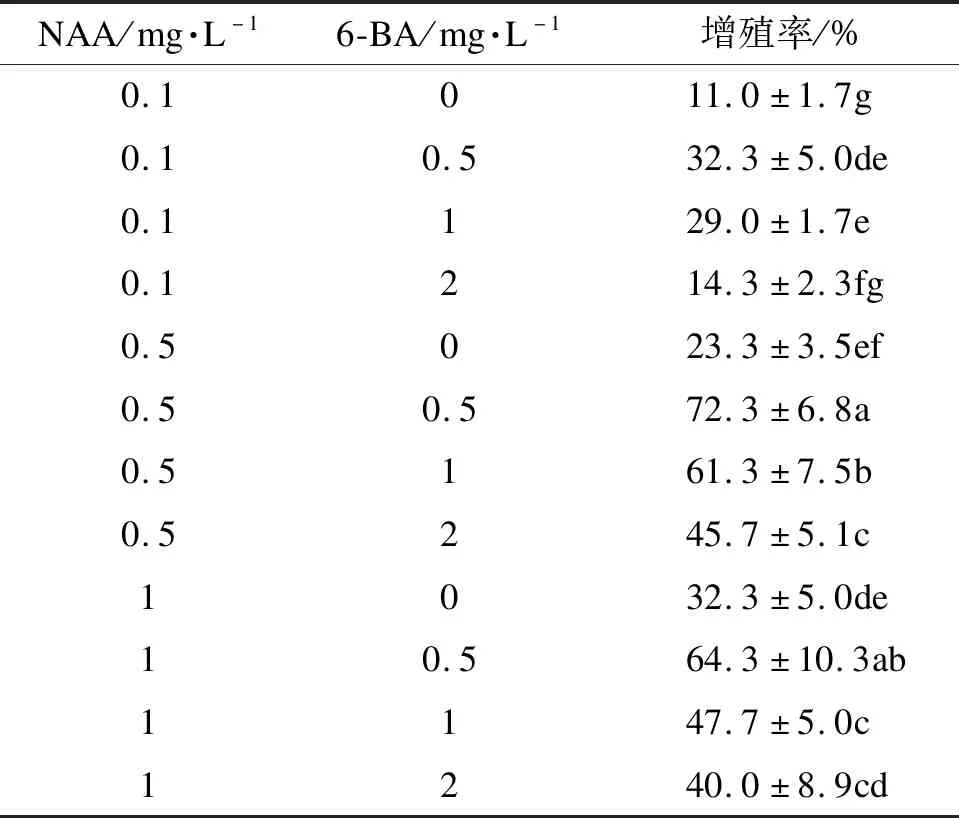
表5 NAA、6-BA对体胚增殖率的影响
3 结论与讨论
7月上旬是蒙古栎未成熟合子胚初代培养的最佳取材时期。最佳初代培养基为MS+2,4-D 1 mg·L-1+6-BA 0.5 mg·L-1+水解酪蛋白0.5 g·L-1,诱导率85.7%。取材时间对胚性愈伤组织的诱导有显著差异;光照条件对胚性愈伤组织的诱导差异不显著,但暗培养下生长健壮,可多次培养。不同种源对胚性愈伤组织的诱导率有显著差异。最佳继代培养基为MS+NAA 0.5 mg·L-1+6-BA 0.5 mg·L-1+水解酪蛋白0.5 g·L-1,增殖率72.3%,且培养4周是最佳培养时间。

注:a白色颗粒愈伤组织上诱导出的球形胚;b褐色愈伤组织上诱导出的球形胚;c继续培养白色颗粒愈伤组织上大小不同的球形胚;d继续培养褐色愈伤组织上大小不同的球形胚;e球形胚聚集现象;f培养4周左右白色颗粒愈伤组织上诱导出的球形胚;g培养6周左右球形胚停止生长发育;h高浓度激素培养下产生的非胚性愈伤组织;i褐色团状非胚性愈伤组织。
影响蒙古栎体胚诱导的原因诸多,如外植体、外源激素类型及配比、基因型以及培养环境等。本文主要研究了种源、未成熟合子胚取材时间、外源激素配比和光照条件对胚性愈伤组织诱导的影响。植物激素是体胚诱导过程中关键的因素,由于2,4-D是体胚发生过程中的重要激素,可单独使用也可配合细胞分裂素使用,所以大多数植株在诱导胚性愈伤组织时会选用2,4-D[13]。张涛[14]在研究芸芥Erucasativa体细胞胚胎发生时发现,添加2,4-D的培养基诱导芸芥胚性愈伤组织的效果最佳,且2,4-D质量浓度过高或过低都不利于体胚发生或增殖。6-BA属于细胞分裂素,诱导速度快,诱导率高,单独使用时多以直接体胚发生为主。张存旭[15]在栓皮栎体胚诱导研究中同时加入NAA和6-BA两种激素,愈伤组织质地较好且多为胚性组织。本研究选择2,4-D和6-BA配合使用,以间接体胚发生,能显著提高胚性愈伤组织诱导率。成功诱导胚性愈伤组织后继代增殖,用NAA[16]代替2,4-D,并适当降低质量浓度,成功诱导出球形胚,这与魏爽[10]在辽东栎体胚增殖阶段的结果一致。但后续随着继代增殖次数增多,胚性愈伤组织的胚性能力下降,这与阿拉伯橡胶树[17]体胚发生过程得出的结论非常相似。在今后的实验研究中,应重点探究如何保持愈伤组织胚性并及时剔除非胚性愈伤组织,在愈伤组织胚性活力较强时转入合适的体胚诱导培养基中[18]。
一般来说,分化程度低的组织更利于体胚诱导。研究表明,合子胚是诱导植物体胚发生最理想的材料,合子胚的取材时间对体胚诱导存在一定的影响。杨玲等[19]在研究花曲柳体胚诱导中发现,未成熟合子胚的体胚诱导率明显高于成熟合子胚。本研究表明,取材时期不但会影响诱导率,还会影响愈伤组织的质地。从实验数据来看,7月上旬的体胚诱导率最高,该时期的外植体为未成熟合子胚,8月至9月上旬合子胚逐渐成熟,体胚诱导时间变长且诱导率逐渐下降,这与姚增玉[20]在栓皮栎体细胞胚胎发生研究的结果一致。此外本研究发现种源对体胚诱导影响差异显著,可见基因型对体胚诱导的重要性。
光照条件对于体胚发生也有显著影响,且不同植株对于光的敏感性也不同。有些植株在体胚诱导过程中需要光照,如青冈栎Cyclobalanopsisglauca在体胚诱导时,只能在光下进行,移至黑暗处则不再形成体胚[21]。而北美鹅掌楸Liriodendrontulipifera胚状体在黑暗条件下发育健壮,在光下多形成畸形胚,且生长缓慢[22]。本研究中光照条件对体胚诱导率影响不显著,但是在暗培养下愈伤组织生长更健壮,能长时间保持新鲜,而光下培养的愈伤组织容易发生褐化,多次继代后易形成非胚性愈伤组织。但本研究在继代增殖过程中只诱导出球形胚,对于继代增殖的研究还有待于进一步完善。
