帕金森病患者肠道菌群变化及其与临床特征的相关性
2021-03-16孙百花李年应
孙百花,李年应,王 涛,吴 琼,乔 晋*
(1西安市第三医院神经内科,西安 710018;2西安交通大学第一附属医院神经内科;3陕西省森林工业职工医院神经内科;4西安交通大学第一附属医院康复医学科;*通讯作者,E-mail:qiaojn123@163.com)
帕金森病(Parkinson disease,PD)是一种中老年人常见的慢性神经系统变性疾病,病理特征为黑质多巴胺能神经元大量变性、脱失,神经元α-突触核蛋白(alpha synuclein,ɑ-SYN)沉积及路易小体(Lewy body,LB)形成[1]。中枢神经系统(central nervous system, CNS)与胃肠道的肠神经系统(enteric nervous system,ENS)和自主神经系统(autonomic nervous system,ANS)之间存在双向交流,近年来,研究发现脑-肠轴的相互作用受肠道菌群的调节,肠道微生物通过神经内分泌、免疫、直接神经机制影响大脑功能活动,并与PD患者运动症状及非运动症状有关[2]。有学者提出PD肠道起源学说,认为PD开始于肠道神经元,并逐渐进展到CNS,进而造成黑质纹状体多巴胺能神经元损伤,出现一系列运动及非运动症状[2,3]。国外很多研究[4-6]已证实PD患者肠道菌群组成与正常健康人群相比发生变化,且代谢功能影响肠道及CNS活动。但国内对此方面研究较少,中国南方地区(广东)对肠道菌群与PD方面有相关研究[7]。本研究旨在探索陕西地区PD患者肠道菌群变化与临床表现之间的关系,希望能够为PD病理生理机制提供科学依据,对于PD治疗提供新的思路。
1 研究对象与方法
1.1 研究对象
根据入选、排除标准,连续收集2018年3月至2018年11月西安交通大学第一附属医院神经内科门诊及住院部就诊的30例帕金森病患者粪便标本,并选取同期就诊于西安交通大学第一附属的健康体检者或患者家属22例作为对照组,对照组按年龄(±5岁)、性别及饮食习惯与病例组匹配。所有研究对象均取得知情同意。
1.1.1 病例组 纳入标准:所有患者均符合2015年MDS临床确诊的或很可能的帕金森病诊断标准[8]。
排除标准:①排除继发性帕金森综合征,如外伤后、药物性、脑炎后、血管性等;②排除帕金森叠加综合征,如多系统萎缩、纹状体黑质变性、进行性核上性麻痹及额颞叶痴呆等;③排除因精神障碍、重度认知功能障碍等原因不能完成量表评定的患者;④排除合并急慢性胃肠道疾病或近1月服用激素、免疫抑制剂、抗生素及菌群调节剂者。
1.1.2 对照组 收集2018年3月至2018年11月期间在西安交通大学第一附属医院就诊的健康体检者或患者家属,所有对照组人群与病例组根据年龄(±5岁)、性别、饮食习惯相互配对。
1.2 临床表现分型方法
采用统一的帕金森病评定量表(unified Parkinson’s disease rating scale,UPDRS)Ⅲ部分对运动症状进行评分;依据改良的Hoehn-Yahr(H-Y)分级标准进行临床症状严重程度分期;采用非运动评价量表(non-motor symptom related scales,NMSS)评估非运动症状的程度及频率;帕金森患者生活质量问卷-39(PDQ-39)评定生活质量;按照有无便秘将患者分为便秘组及非便秘组,按照罗马Ⅲ功能性便秘的诊断标准评价便秘,Wexner评分评价便秘严重程度。
根据发病年龄分为早发组(≤50岁)及晚发组(>50岁)[9]。根据改良Hoehn-Yahr(H-Y)分期分为轻度组(1-1.5期)、中度组(2-2.5期)、重度组(3-4期)[10]。根据UPDRS评分量表第2部分第16项及第3部分第20,21项的平均分定义为震颤得分;UPDRS第2部分第5,7,12-15项及第3部分18-19,22-31项的平均分为非震颤得分。根据震颤得分/非震颤得分是否大于1,将运动症状分为2种亚型:震颤为主型(震颤得分/非震颤得分>1)和非震颤为主型(强直少动型,震颤得分/非震颤得分≤1)[11]。
1.3 粪便标本留取步骤
①选择一个干净的蹲厕或马桶,冲洗干净,排便前先排尽尿液,然后在便池内垫两层干净的卫生纸;②将粪便排在铺好的干净纸巾上;③打开包装,带上一次性手套,取出采样保护装置(Loogsee粪便微生物基因组保护液套装),旋开采集管,采集粪便团块中心约1粒黄豆粒大小的粪便,将取好的粪便采样杆插回管内,旋紧密封旋盖;④手握采集管,在靠近易折杆侧用拇指推压盛液管中部,使盛液管中的杆子沿根部折断,露出小孔,轻挤盛液管使保护液通过小孔流入装有粪便的管内;⑤将盛液管中的液体全部挤入下端管中,轻轻晃动采集管,让采样头凹槽中的大便样本与采样头分离并与保护液充分混匀,使管内液体呈悬浊状;⑥将样本保存于-80 ℃冰箱中。
1.4 DNA提取及质检及测序

1.5 数据处理
根据原始序列(FASTQ格式)的barcodes信息(样本唯一),运用QIIME2 demux插件对不同样本的序列进行拆分[12]。将拆分后的序列,运用QIIME2 dada2插件进行质控,修剪(参数为-p-trunc-len-f 290,-p-trunc-len-r 256,-p-trim-left-f 26,-p-trim-left-r 26),去噪,拼接,以及去除嵌合体后,得到了最终的sOTU(sub-operational-taxonomic-unit)[13]。接着,运用QIIME2 feature-classifier插件将sOTU的代表序列比对到预先训练好的13-8版本99%相似度的GREENGENES数据库(根据338F/806R引物对将数据库修剪到V3V4的区域),得到了物种的分类信息表[14]。之后用QIIME2 feature-table插件剔除了所有污染性的线粒体和叶绿体序列。接着用QIIME2 core-diversity插件计算多样性矩阵,用emperor插件进行可视化[15]。最后,ANCOM, ANOVA, Kruskal Wallis, LEfSe和DEseq2的方法被用来鉴定分组和样本间丰度有差异的细菌[16]。
选取2017年8月~2018年8月在我院治疗的神经内科患者180例作为研究对象,将其随机分为对照组与观察组,各90例。其中,观察组男52例,女38例,年龄45~78岁,平均年龄(63.47±5.25)岁,脑出血8例.脑梗死65例,肌萎缩侧索硬化17例;对照组男50例,女40例,年龄45~79岁,平均年龄(63.52±5.16)岁,脑出血7例、脑梗死62例、肌萎缩侧索硬化21例。两组患者一般资料对比,差异无统计学意义(P>0.05)。所有患者及其家属均知晓本次实验的研究目的、方法和意义,自愿配合,且经我院伦理委员会批准同意。
1.6 统计方法

菌群分析,不同分组间菌群相对丰度差异检验使用LEfSe检验(非参数检验和线性判别分析的结合),线性判别分析log10LDA>2认为差异有统计学意义,P<0.05。α多样性由observed-otu,shannon,faith’s phylogenetic diversity(faith-pd)及chao1等指数来评估,各个指数之间的比较采用Wilcox分析方法,P<0.05认为差异有统计学意义。临床表型数据与微生物之间相关性采用Spearman相关分析,P<0.05认为差异有统计学意义。
2 研究结果
2.1 一般资料
PD共30例,男20例,女10例,年龄(62.93±7.88)岁,体质量指数BMI(23.51±2.53)kg/m2;健康对照组22人,男14人,女8人,年龄(62.59±7.90)岁;BMI(23.43±3.18)kg/m2,两组间年龄、性别和BMI差异没有统计学意义(P>0.05)。
PD患者发病年龄(58.97±9.09)岁,病程(3.89±3.09)年,震颤型12例,非震颤型18例,H-Y分级1.75(1.5,2.0),UPDRS Ⅲ评分(16.27±8.16)分,左旋多巴剂量平均(440.48±215.13)mg/d,其中使用左旋多巴制剂21例,多巴胺受体激动剂13例,MAO-B抑制剂10例,金刚烷胺6例。伴发运动波动8例,异动症3例;伴发便秘患者15例;早发型8例,晚发型22例。
2.2 PD患者肠道菌群分布特点
2.2.1 测序数据 两组52个样本共2 455 309条可用序列,序列平均长度407 bp,对所有样品全部的有效序列进行聚类/去噪,获得2 634个可操作分类单元(operational taxonomic units,OTU)。选取OTU的代表性序列与核糖体RNA数据库(GREENGENES Database 13-8版本,按99%序列相似性聚类)进行比对获得物种注释信息。基于OTU的绝对丰度及注释信息,对每个样品在一共7个分类水平种、属、科、目、纲、门、界(Species,Genus, Family, Order, Class, Phylum,Kingdom)上的序列数目占总序列数的比例进行统计。
2.2.2 菌群多样性分析 对某个样品中物种多样性的分析主要采用α多样性分析,用observed-otus,chao1,shannon以及faith’s phylogenetic diversity(faith-pd)指数来评估样本的物种多样性。本研究发现PD患者相较于正常对照在faith-pd指数、chao1指数、observed-otus指数、shannon指数方面均增高,差异有统计学意义(P=0.001 4,0.001 8,0.001 9,0.001 8)。结果显示,与对照(control)组相比较,PD组在菌群丰度及多样性方面均增高(见图1)。
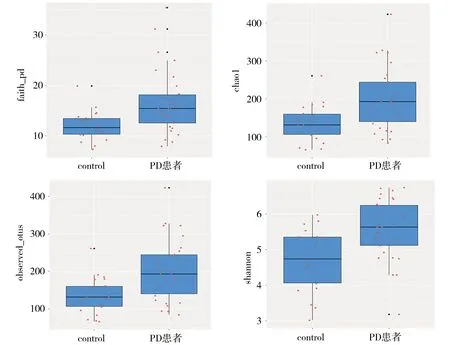
图1 PD组与对照组α多样性比较

表1 PD组与对照组在门水平细菌丰度比较
在科水平,双歧杆菌科(Bifidobacteriaceae)、瘤胃菌科(Ruminococcaceae)、肠杆菌科(Enterobacteriaceae)、链球菌科(Streptococcaceae)、草酸杆菌科(Oxalobacteraceae)、醋酸杆菌科(Acetobacteraceae)、红椿菌科(Coriobacteriaceae)、克里斯滕森菌科(Christensenellaceae)、组织菌科(Tissierellaceae)、红螺菌科(Rhodospirillaceae)、丛毛单胞菌科(Co-mamonadaceae)和紫单胞菌科(Porphyromonadaceae)的丰度PD组明显高于对照组(LEfSe检验,均P<0.05)。韦荣球菌科(Veillonellaceae)的丰度PD组明显减低(LEfSe检验,P=0.031,见图2)。

图2 PD组与对照组在科水平菌群丰度比较
在属水平,PD组卟啉菌属(Porphyromonas)、双歧杆菌属(Bifidobacterium)、乳酸菌属(Lactococcus)、肠杆菌属(Enterobacter)、颤螺菌属(Oscillospira)、草酸杆菌(Oxalobacter),毛螺菌属(Lachnospira)、肠球菌属(Enterococcus)、脱硫弧菌(Desulfovibrio)、吉米菌属(Gemmiger)、柯林斯氏菌属(Collinsella)、丁酸弧菌属(Butyricimonas)、另枝菌属(Alistipes)和荧光杆菌属(Odoribacter)的丰度明显增高,而PD组光岗菌属(Mitsuokella)丰度显著减低(LEfSe检验,均P<0.05,见图3)。

图3 PD组与对照组在属水平菌群丰度比较
2.2.4 肠道菌群与PD临床表现 按照不同分类方法,对PD患者进行临床分型,分别分析不同临床表现中肠道菌群组成差异。结果发现,伴发便秘患者(15人)与非便秘患者(15人)、震颤型(12人)与非震颤型(18人)、早发型(8人)与晚发型(22人)、伴发运动并发症(11人)与不伴发运动并发症(19人)、男性(20人)与女性(10人)、经药物治疗(24人)与未经药物治疗(6人),不同临床分型菌群α多样性指数observed-otus、chao 1、shannon以及faith-pd均未见明显差异(Wilcox检验,均P>0.05)。
2.2.5 肠道菌群与临床特征相关关系 在门水平,厚壁菌门及放线菌门丰度与UPDRS Ⅲ评分、NMSS评分、Wexner评分、PDQ-39评分均呈正相关;拟杆菌门丰度与UPDRS Ⅲ评分、NMSS评分、Wexner评分、PDQ-39评分均呈负相关,与临床分型、病程、H-Y分级、左旋多巴等效剂量等无明显相关性(见表2)。

表2 门水平菌群丰度与临床特征相关关系
在科水平,双歧杆菌科、肠杆菌科及紫单胞菌科丰度与UPDRS Ⅲ评分、NMSS评分、PDQ-39评分均呈正相关正相关(P<0.05,见表3)。

表3 科水平菌群丰度与临床特征相关关系
3 讨论
根据Braak病理分期,PD病变部位最早可能起始于嗅球及肠道肌间神经丛。近年来研究发现PD的病理改变可能是通过肠道菌群波及肠道神经系统。肠道菌群的改变导致α-突触核蛋白(alpha synuclein,α-SYN)的错误折叠,这些病理性α-SYN通过肌间神经丛被肠黏膜吸收进入肠道神经丛,然后沿迷走神经逆行传入脑干及大脑,造成黑质多巴胺能神经元损伤[17]。另外,肠道菌群通过产生与宿主神经系统相互作用的激素和神经递质,如单胺类、γ-GABA、短链脂肪酸等,对宿主神经活动产生直接影响,造成中枢神经系统胶质细胞活化、促炎信号分子产生和氧化应激等反应,这可能是导致PD神经退行性变的重要机制[18]。
既往研究报道了肠道菌群与PD关系。Ali等[19]的研究发现,PD患者中拟杆菌门、变形菌门及疣微菌门丰度明显增高,而厚壁菌门丰度明显减低,在属水平,Akkermansia(疣微菌门,疣微菌纲)、颤螺菌属(厚壁菌门,梭状芽胞杆菌纲)、拟杆菌属(拟杆菌门,拟杆菌纲)丰度明显增高。在我们的研究中,发现部分门水平菌群变化与他们的研究结果相似,我们发现变形菌门相对丰度明显增高,厚壁菌门、放线菌门丰度增高,而拟杆菌门丰度明显减低,这与我国李悦等[20]的研究结果相似。在属水平,颤螺菌属、乳酸菌属、双歧杆菌属丰度明显增加。Hasegawa等[21]的研究发现PD患者乳酸菌明显增高,且肠道菌群与左旋多巴及其他抗帕金森病药物均未发现明显相关性。乳酸菌丰度增高可造成肠道激素ghrelin水平减低,ghrelin可调节黑质纹状体多巴胺水平,亦可抑制PD神经元变性。在PD患者中,可观察到ghrelin分泌受损[22]。乳酸菌亦可调节肠道神经元和迷走神经传入活动,从而影响细胞内α-SYN的分泌。Scheperjans等[6]的研究发现,PD患者普雷沃氏菌科(Prevotellaceae)丰度减少了77.6%。Gabrielli等[23]的研究发现,PD患者更易伴发小肠细菌过度增殖症,PD伴发小肠细菌过度增殖症患者非运动症状发生率增高,且普雷沃氏菌丰度减低。普雷沃氏菌是结肠的共生菌,不仅降低肠道黏膜层的植物多糖、黏蛋白及糖蛋白,也与免疫系统相互作用,它与短链脂肪酸的水平相关,也与硫胺素及叶酸的生物合成相关。普雷沃氏菌减少导致肠道黏蛋白合成减少,黏膜通透性增高,局部或系统暴露于细菌毒素,导致结肠α-SYN表达增加[24]。但在我们的研究中发现,PD患者中普雷沃氏菌科丰度减低,但差异无统计学意义。在中国南方Lin等[7]的研究中发现,厚壁菌门丰度明显减低,而拟杆菌门及疣微菌门丰度增加,但差异无统计学意义;在科水平,发现毛螺旋菌科丰度减低,韦荣球菌科、疣微菌科丰度增高。在赵程等[25]的研究中,拟杆菌门明显减低,而放线菌门丰度明显增高;在科水平,链球菌科及肠杆菌科在PD患者粪便中明显增高。而在我们的研究中发现,相较于正常对照组,PD组患者肠道菌群组成中毛螺旋菌科、肠杆菌科、链球菌科、双歧杆菌科、瘤胃菌科、草酸杆菌科、醋酸杆菌科等丰度明显增高,而韦荣球菌科丰度减低。我们的研究结果与国内研究结果部分一致。
正常人体内肠道微生物中占主导地位的是厚壁菌门和拟杆菌门,其次是放线菌门、变形菌门[26]。肠道菌群组成与不同地区饮食习惯差别有密切关系,在我们的研究中,患者大部分来源于陕西地区,主食以面食为主者居多,且面食以小麦面为主,少部分患者主食以大米为主。有研究表明,食用全谷物为主的人相较于食用小麦及大米为主的人,肠道中双歧杆菌的水平明显增加,双歧杆菌属于放线菌门[27],而我们的研究结果中双歧杆菌科丰度增高,这与饮食习惯导致菌群改变并不一致,因此我们结果中菌群改变并不是因饮食影响,而是由于疾病本身因素导致。另有研究表明,食鱼肉等肉类为主的小鼠体内拟杆菌门明显增加而厚壁菌门数量明显减低[27],中国南方饮食习惯以鱼肉、海鲜类、稻米等居多,这可能是他们的研究结果与我们不同的一个原因。“高碳水化合物、高脂”为西方常见的饮食模式,以高糖高脂饮食为主的小鼠体内拟杆菌门明显减少,而厚壁菌门的数量增加[27,28]。这与西方研究结果也不相符,所以,PD肠道菌群的组成及丰度的变化为疾病本身改变,非饮食习惯所致。
既往研究发现,普雷沃氏菌与UPDRS Ⅲ评分相关,临床表型以姿势步态异常为主的PD患者肠杆菌科的数量明显多于震颤型患者,且肠杆菌科丰度与抗帕金森药物COMT抑制剂有关[6]。Unger等[5]的研究中发现,双歧杆菌属及肠杆菌科在PD患者丰度增高,但肠杆菌科与临床表型亦未发现明显相关性。但在我们的研究中,相关性分析发现,在门水平,厚壁菌门、放线菌门,在科水平,肠杆菌科、双歧杆菌科、紫单胞菌科丰度与UPDRS Ⅲ、NMSS、PDQ-39评分呈正相关,但与临床表型、病程、病情严重程度等未发现明显相关性。并且在我们的研究中,服用COMT抑制剂患者只有2例,遂未分析菌群与药物关系,未服用抗帕金森药物的患者仅有6例,研究未发现菌群组成与左旋多巴之间的关系。有研究表明,早发型患者中梭杆菌门明显增高,健康人群中,梭杆菌门含量极少,梭杆菌与肠道黏膜屏障改变及细胞代谢有明显关联。我们的研究中未发现早发型及晚发型PD患者肠道菌群α及β多样性之间差异。有研究表明,PD的严重程度和病程与肠道菌群具有明显相关性,毛螺旋菌科与PD病程呈负相关性,此菌科包含多种产丁酸菌,产丁酸菌的丰度减低,可引起丁酸盐(短链脂肪酸中一种)含量减低,短链脂肪酸可引起肠道通透性增加,促进肠道炎症反应[24]。对PD患者及正常人粪便中短链脂肪酸水平进行定量研究,发现PD患者粪便样品中乙酸、丙酸和丁酸的绝对浓度显著下降,丁酸盐的浓度相对减少,且应用恩他卡朋与丁酸浓度呈负相关[5]。Forsyth等[24]报告PD患者粪便中大肠杆菌(肠杆菌科中一种)含量增加,大肠杆菌可导致肠道屏障功能受损,肠黏膜通透性增加,使肠道神经系统更容易与病原接触。我们的研究虽没有发现PD患者中大肠杆菌水平增高,但发现肠杆菌科水平增高。在我们的研究中,可能由于研究样本数量较少,某些菌群变化与既往研究不相符,且在不同临床表现分型与肠道菌群组成单因素分析中,不同临床表现的分型数量少,未发现明显有意义的菌群差异,在相关性研究中虽发现某些菌群与UPDRS Ⅲ评分、NMSS评分及Wexner评分等相关,但相关系数低,需要扩大样本量进一步研究。
粪便菌群移植(fecal microbiota transplantation,FMT)作为一种新型的改善肠道微生物群态的手段。通过收集正常健康人群粪便,通过灌肠、结肠镜等方法移植于患者低位或高位肠道内,重建患者肠道菌群,从而治疗各种胃肠道疾病及胃肠外疾病。目前已有在临床中关于粪便菌群移植应用于顽固型便秘、炎症性肠病、肠易激综合征、肥胖等疾病治疗成功的案例。随着对“脑—肠—微生物轴”认识的进展,粪便移植应用于PD、多发性硬化、阿尔茨海默病等神经退行性疾病仍在进行探索[29]。但因粪便移植健康标本等的筛选、制备及移植方式等尚未有统一结论,且循证依据不足,限制了粪便移植在临床中的应用。未来可能需要更多的研究支持这方面结论,为PD治疗提供一种新的思路。
