无创CT门静脉成像联合血清学指标对肝硬化食管静脉曲张出血风险的预测
2021-03-15江国露吴哲刘孟昕郭莲怡马贺骥
江国露,吴哲,刘孟昕,郭莲怡,马贺骥
(1.抚顺市中心医院,辽宁 抚顺 113006;2.锦州医科大学附属第一医院,辽宁 锦州 121000)
食管静脉曲张出血(esophageal variceal bleeding,EVB)是肝硬化失代偿后最常见的一种并发症,失血可严重,临床情况危急,死亡率极高。EVB首次发生后患者死亡率高达 50%~70%,在积极治疗后6 w内死亡率为15%~25%[1-2]。及早评估EV程度、预测出血风险至关重要。上消化道内镜(upper gastrointestinal endoscopy, UGE)检查一直是诊断 EV、判断其程度的金标准,但有创性且费用较高等缺点一定程度上限制了其临床应用[2]5323-5333。近年来国内外学者致力于研究CT、超声、MRI、实验室血清学等无创指标对肝硬化食管静脉曲张程度及出血的诊断价值,寻找一种无创诊断标准来代替胃镜[3]。但关于预测EVB风险高低的联合无创模型研究较少见,本研究旨在建立CT影像指标联合血清实验室指标的无创诊断模型,探究其对EVB风险的诊断效能,为高风险EVB患者的临床诊治给予及时指导,从而提高生存率和改善预后。
1 资料与方法
1.1 一般资料
选取2010年1月至2020年1月本院经临床确诊为肝硬化门静脉高压症的患者176例,其中男性140例,女性36例,男性平均年龄为(54.0±8.3)岁,女性平均年龄为(62.9±10.5)岁。入院当日接受肝功能等检查,3日内完成腹部CT增强及胃镜检查。无相关手术史、门脉系统栓子、血液系统疾病及恶性肿瘤病史。
1.2 仪器与方法
1.2.1 胃镜检查
采用 Fujinon EG 485 及 OlympusCV240 电子胃镜。依据2003年食管胃静脉曲张(esophageal varices,EV)内镜下诊断和治疗规范试行方案,按程度分为无、轻、中、重度(EV0、EV1 、EV2 、EV3),依据肝功能Child-pugh分级标准分为ChildA、B、C级,依据出血风险及治疗标准分为高危EV组(EV2、EV3及EV1 合并ChildB、C级)和低危 EV 组(不合并ChildB、C级的 EV1和EV0)[4-5]。
1.2.2 CTPV检查
采用(PHILIPS Brilliance 64)64排螺旋CT机。检查前20 min饮水500~1000 mL,范围从膈顶至双肾下极。平扫后于肘静脉注入碘海醇85~100 mL,浓度为300 mg/mL,速率4.0 mL/s,动脉期扫描延时25~30 s、门脉期60~65 s及平衡期85~90 s。参数:管电压120 kV、电流300 mAs、螺距0.984、层厚0.5 mm、探测器0.625 mm × 64。将容积扫描数据传至Mxview工作站对门静脉及其分支血管进行三维后处理,包括多平面重建(multiplanar reformatted,MPR)、最大密度投影(maximum intensity projection,MIP)及容积再现(volume rendering,VR)。
1.3 观察指标
1.3.1 CT数据测量
门静脉内径(d1)、脾静脉直径(d2)、脾脏长径(d3)、脾前后径(d4)、脾厚径(d5);所有数据测量3次,取平均值,门静脉及脾静脉最宽处管径分别为d1、d2,脾脏冠状位上下缘之间的垂直距离为d3,脾脏轴位前后缘之间距离为d4,垂直于d4的脾脏内外缘间距离为d5,见图1、图2。
1.3.2 血清生化指标
白细胞计数(WBC)、红细胞计数(RBC)、血小板计数(PLT)、碱性磷酸酶(ALP)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、GGT(γ-谷氨酰转肽酶)、总胆红素(TBIL)、直接胆红素(DBIL)、间接胆红素(IBIL)、白蛋白/球蛋白(AG)、白蛋白(ALB)、球蛋白(GLB)、凝血酶时间(TT)、凝血酶原时间(PT)、活化凝血酶时间(APTT)、国际标准化比值(INR),并计算血小板/脾长径[6](PSR)、谷草转氨酶与血小板比率指数(APRI),APRI=(AST×100)/(40×PLT)[7]。
1.4 统计学方法

2 结 果
2.1 两组基本资料比较
176例,EV出血低风险组72例,高风险组104例,两组间性别、年龄及病因比较,差异无统计学意义(P>0.05),见表1。
2.2 两组CT及血清学指标分析比较
门静脉直径、脾长径、PSR、APRI、PLT、RBC、ALP、TBIL、DBIL、AG、ALB、TT、PT、APTT、INR比较,门静脉直径、PSR、PLT、RBC、AG、ALB、INR指标低风险组高于高风险组,余指标高风险组高于低风险组,差异有统计学意义(P<0.05);脾静脉直径、脾前后径、脾厚径、AAR、WBC、ALT、AST、GGT、IBIL、GLB比较,差异无统计学意义(P>0.05),见表2。
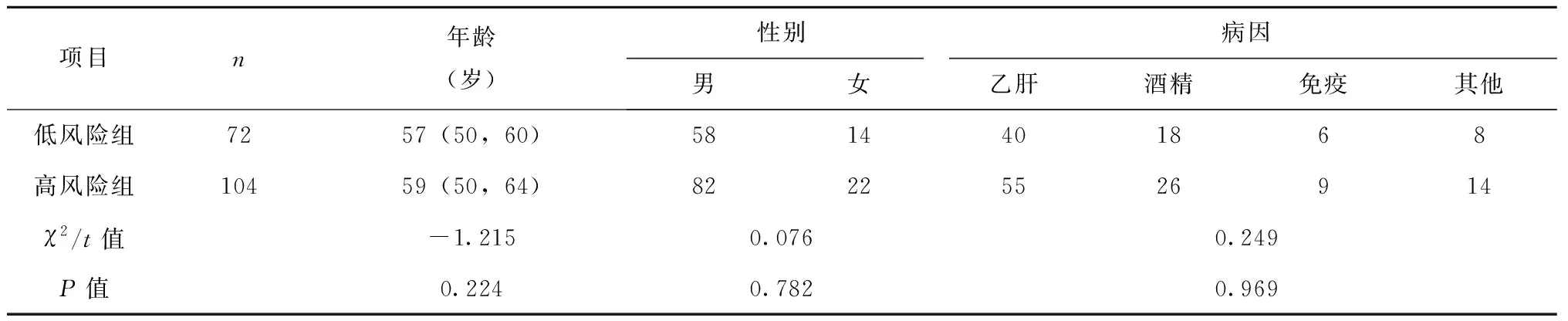
表1 两组患者基本资料比较
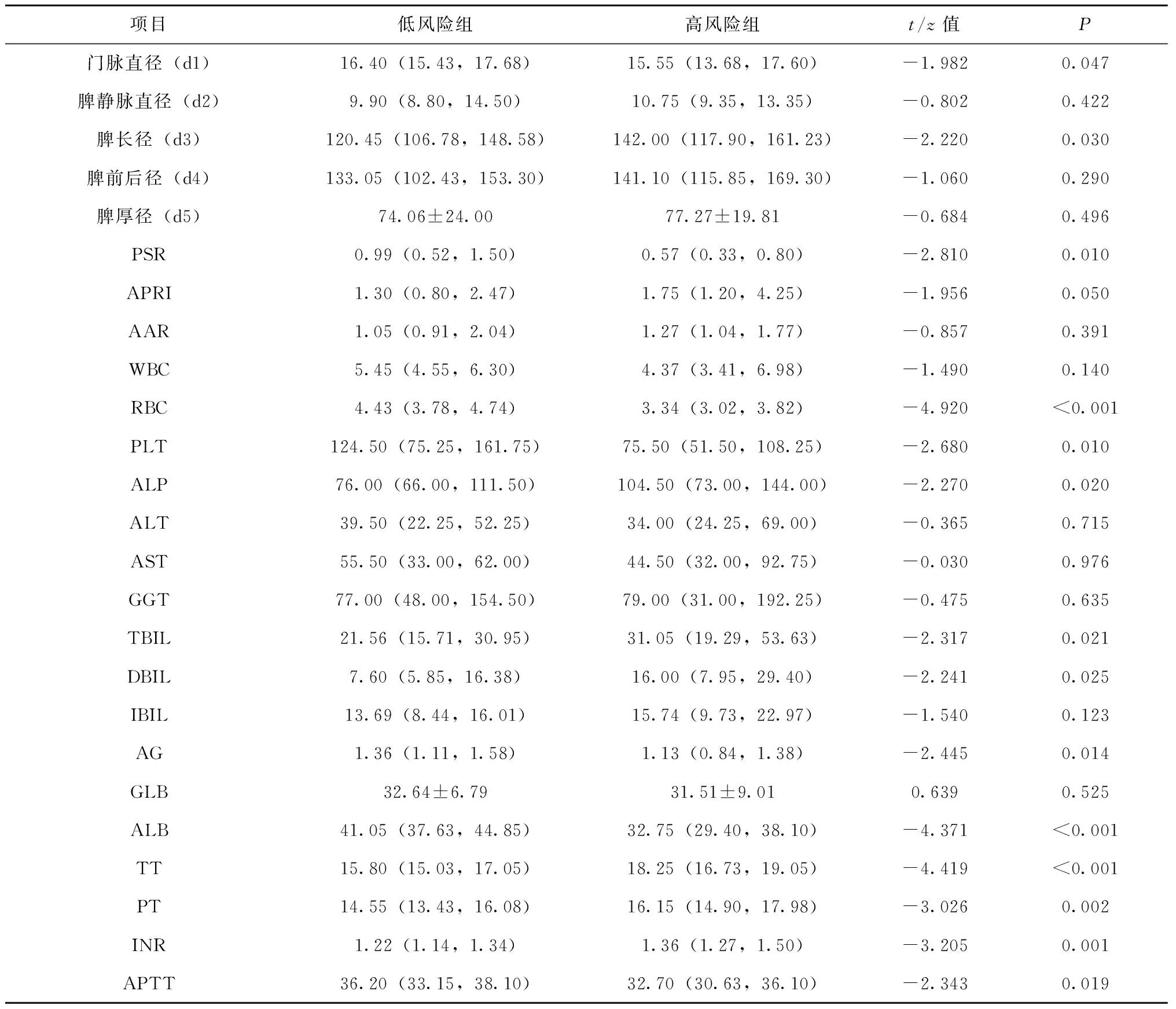
表2 两组肝硬化食管静脉曲张出血风险分析比较
2.3 食管静脉曲张出血风险危险因子
多因素回归分析显示门静脉直径、PSR、RBC、APTT是预测食管静脉曲张出血风险的独立危险因子,相应回归模型:Logistic(P) =17.235-0.194d1-1.564PSR-1.638RBC-0.17APTT,见表3。Hosmer-Lemeshow 检验表明回归模型与观测值拟合良好(P=0.871,P>0.05),说明该模型预测效果无统计学意义。
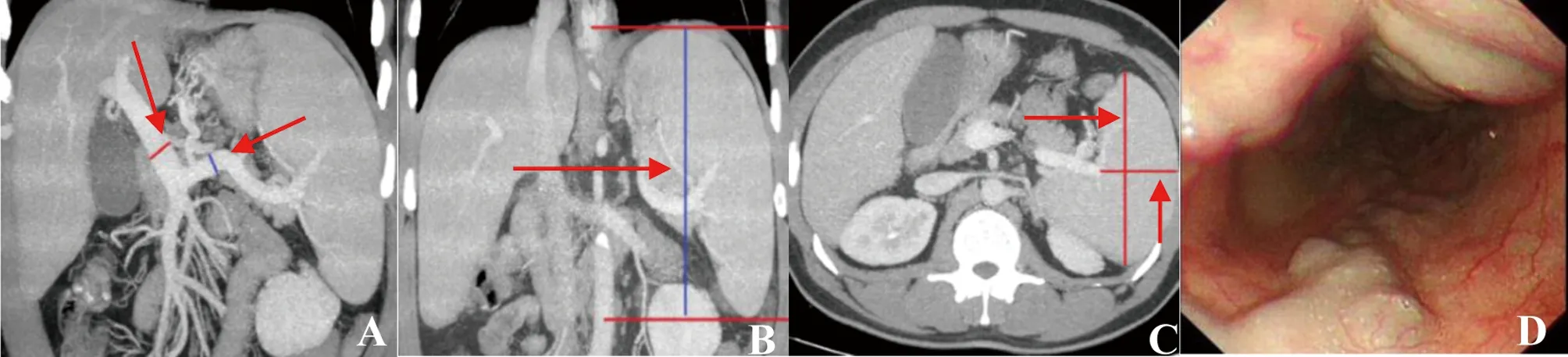
A:门静脉及其侧枝循环血管MIP图,门静脉及脾静脉最大径分别为18.6、12.6 mm(箭头);B~C:脾脏冠状位及轴位MIP图,脾脏长径、前后径及厚径分别是168.2、135.3、91.7 mm;D:胃镜显示患者食管静脉呈迂曲及串珠状,多处可见红色征
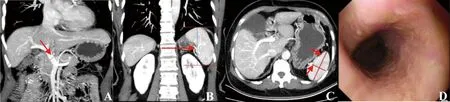
A:门静脉及其侧枝循环血管MIP图,图示(箭头)测量门静脉最大径12.4 mm;B~C:脾脏冠状位及轴位MIP图,脾脏长径、前后径及厚径分别是84.6、86.8、34 mm;D:胃镜显示患者食管黏膜光滑,呈粉红色,无糜烂、溃疡及曲张静脉
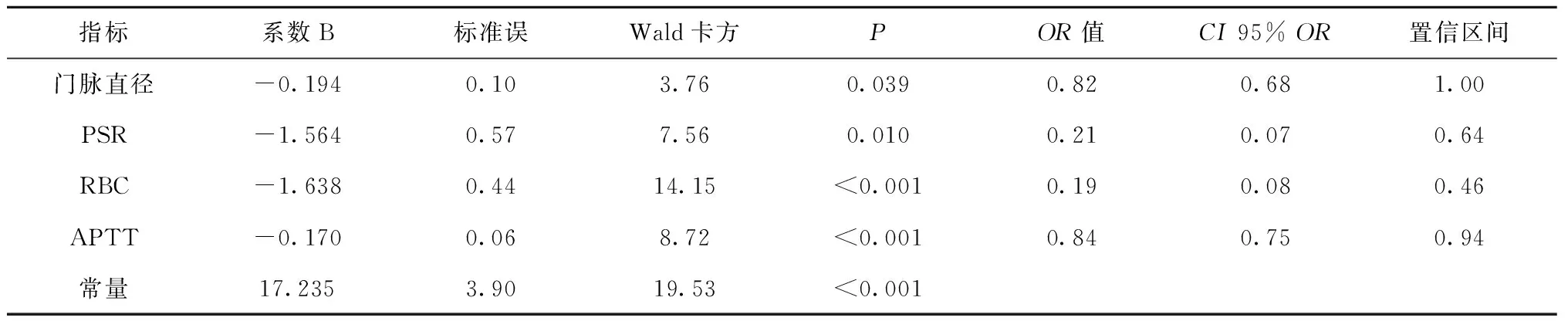
表3 CT门静脉成像指标结合生化指标分析结果
2.4 无创联合诊断模型预测能力
无创联合诊断模型的ROC曲线效能分析结果显示曲线下面积为0.873(95%CI:0.785-0.935),最佳诊断界值为0.6132,灵敏度为80.77%,特异度为80.56%。通过“K折交叉验证法(K=3)”选取59例患者作为验证集,对诊断模型进行检验,52例患者预测结果符合实际检验结果,即模型预测准确率为88.14%,见表4。

表4 无创联合诊断模型预测肝硬化食管静脉出血风险的交叉验证结果
3 讨 论
食管静脉曲张破裂出血是肝硬化患者最主要的死亡原因之一,胃镜检查一直是诊断EVB的金标准。目前有很多方法应用于EVB治疗,但患者死亡率仍然很高[8]。临床指南建议胃镜作为肝硬化患者常规检查,通过胃镜确定EV程度并预测出血风险,从而对患者进行合适的治疗,预防出血、降低死亡率。但很多肝硬化患者EV程度并不严重,不需要预防性治疗[8-9]287-294。CT成像后处理技术可以直观显示肝、脾形态改变,多维度观察、测量门脉及侧支循环血管管径等相关指标。
相关文献[10-13]显示门静脉内径、脾静脉内径、脾脏厚径、脾长径、脾脏前后径及PSR与食管静脉曲张程度相关,且肝功能减退、血小板减少、纤溶系统活性增高均可能诱发和加重肝硬化食管静脉曲张出血。因此,本实验纳入以上CT指标及肝功能、凝血等血清生物化学指标进行研究。
PSR由Giannini等首先提出,经过深入研究并统一认可其在评估EV程度方面存在不可或缺的价值,普遍认为EV程度越高PSR越低[6,10]779-785,1-15,本研究中EVB出血风险与PSR值呈负相关,与以往研究基本一致。此外,相关报道肝硬化门脉高压引起脾功能亢进,从而通过释放自身抗体、稀释血液、抑制骨髓产生并过分吞噬红细胞使红细胞计数明显降低,本研究结果与其基本一致[11]559-562。
本研究显示门静脉内径与EV出血风险呈负相关,高风险组门静脉内径中位数低于低风险组,一方面可能因为低风险组患者主要处于肝硬化早期,相应病理生理学改变是肝脏纤维化、肝窦结构变化引起肝内阻力增加阶段,进而门脉压力升高促使门静脉内径增加;另一方面,高风险组患者食管静脉曲张程度较低风险明显严重,曲张静脉管径较大,对于门静脉血液分流作用得到提升,产生自发性代偿,缓解了门静脉压力,同时肝功能障碍及侧枝循环共同作用使血管活性物质灭活能力明显减低并集聚在体循环中,使体循环血管持续扩张,一定程度降低门静脉压力。这与国内外相关文献结果一致[12,14]1028-1037。
本研究中APTT值大多在正常范围内(低风险64/72;高风险98/104),分析可能肝硬化患者同时存在抗凝及高凝[15],两者之间复杂的平衡关系使凝血酶原时间维持稳定;其次可能患者在住院前服用了抗凝类药物,影响了结果。
本研究创建的联合诊断模型AUC为0.873,诊断准确度为中等,对预测EV出血风险具有一定的临床诊疗价值。
总之,门静脉直径、PSR、RBC、APTT指标对EVB具有一定的预测价值,且相应预测模型对EVB风险评估效能较强,有助于临床治疗及预后。国内外文献显示相关指标研究结果并不完全一致,尚不存在统一标准,本研究的评价体系为综合指标,较单一指标准确性高,且无创、可重复,具有较好的临床应用价值。但本研究为回顾性分析且样本例相对有限,希望后续通过不断完善研究,给予临床更准确的诊断方法。
