扩散加权成像评价射波刀治疗小肝癌早期疗效的价值
2021-03-15余海龙史芳芳蔡剑鸣张见增胡海东郑增董景辉
余海龙 史芳芳 蔡剑鸣 张见增 胡海东 郑增 董景辉
肝细胞癌是我国常见的消化系统的恶性肿瘤之一,大多采取手术为主的综合性治疗。以往受技术水平限制,放射治疗的方法很少用于治疗肝细胞癌。近年来,精准放疗技术较以往有了很大发展,尤其是同步呼吸实时追踪技术的运用,大大提高了肿瘤照射的精确度和准确度,同时也减少了对肿瘤周围组织的放射性损伤,目前动态肿瘤的照射精准度已达到了1.5 mm以下,射波刀作为一种精准放疗方法越来越普遍的应用到肝细胞癌的治疗中。与开腹手术及射频、氩氦刀、微波等治疗手段比较,射波刀治疗是一种更安全有效、痛苦小的方法[1-3]。既往扩散加权成像在肝病的应用研究主要集中在肝脏良恶性肿瘤的鉴别诊断方面,近年来的一些研究成果表明磁共振扩散加权成像能够区分肝细胞癌治疗后的残留活性组织与坏死组织[4-7],应用于临床肝细胞癌疗效的评估。射波刀是近年来出现的肝癌治疗手段,对于这项新方法的疗效评价报道较少见。本研究通过对比分析射波刀治疗小肝癌术前及术后不同时期的表观扩散系数(ADC)值变化,探讨DWI在早期评估射波刀治疗小肝癌疗效中的价值。
资料与方法
一、研究对象
收集2017年9月至12月解放军总医院第五医学中心放射肿瘤治疗中心经射波刀治疗的肝细胞癌患者23例,其中男性18例,女性5 例;年龄为(52.2±7.9)岁。纳入标准:①有乙型肝炎、丙型肝炎或肝硬化病史的肝癌患者,临床诊断标准为2017年版的原发性肝癌诊疗规范[8];②术前HCC病灶为1个直径<3 cm或2个最大径之和<3 cm,且无血管侵犯、局部癌栓、淋巴结及远处脏器转移;③除了射波刀治疗,患者短期内术前及术后均未进行其他手段的局部肿瘤治疗;④患者分别于手术前及手术后的1个月、3个月及6~12个月进行MRI扫描及DWI序列扫描,MRI检查图像清晰,满足诊断要求。排除标准:①射波刀治疗前及治疗后短期内接受过针对肝癌病灶其他的局部或全身药物治疗;②未按规定时间完成完整的4次磁共振检查;③病灶位置受到呼吸及其他因素干扰、出现伪影,明显影响到测量准确性的病例。
二、MRI检查方法
分别于治疗前、治疗后1个月、3个月及6~12个月对23例患者进行MRI平扫及DWI序列的扫描,并分别于治疗前和治疗后3个月及6~12个月行LAVA动态增强扫描。采用GE HDx MR3.0T 磁共振扫描,采用8通道的体部线圈。患者均选取仰卧体位,扫描范围自肝脏上缘至双肾下缘,包含完整的肝脏组织。T1WI采用快速扰相梯度重聚成像、化学位移成像的压脂序列,TR 3.5~4.5 ms,TE 1.5 ms; T2WI采用脂肪抑制快速自旋回波序列,TR 6 000~8 000 ms,TE 85 ms;DWI采用平面自旋回波序列,单次激励,扩散梯度的b值分别取0和800 s/mm2,TR 2200 ms,TE 64 ms,激励次数4,FOV选取 38 cm×38 cm。采用脂肪抑制的LAVA快速肝脏容积成像序列进行动态增强扫描,TR选取 3.0~4.5 ms,TE 选取1.5 ms。高压注射器经肘静脉注射轧贝葡胺,药物剂量按0.1 mmol/kg计算,对比剂注射后18~25 s进行动脉早期及动脉晚期两次扫描,45~50 s后重复进行3次门脉期的扫描(包括2次横轴位扫描和1次冠状位扫描),注射造影剂5 min后进行横轴位的延迟期扫描。
三、ADC值测量
将DWI图像回传到GE AW 4.5后处理工作站,并得出ADC图像,使用Function Tool软件进行ADC值的测量。术后长期随访,6~12个月进行的MR平扫及动态增强扫描,按照改良后的实体肿瘤效果评价标准,得出缓解或进展的结果作为判断的金标准,进行坏死组织及残留活性组织的评价依据。参照平扫T1及T2图像对病灶组织勾画ROI,选取肿瘤凝固坏死部分绘制ROI,临近血管及胆管病灶测量时注意避开血管及肝内胆管,勾选ROI时注意选取的勾画范围大小保持一致,肿瘤完全坏死的病灶在显示病灶的连续3个层面、每层分别选择3个ROI进行ADC值测量并记录,再计算9个测量值的平均值为最终测量值;正常肝组织测量时尽量选取右叶远离肝脏边缘的区域,并注意避开同层面的病灶及周围放疗反应区、各级血管及胆管。鉴于肿瘤残留活性区域很小,勾画残留活性全部区域测量ADC值。由2名高年资放射科主治医师采用双盲法分别进行测量,测量值偏差较大时重新测量,最后取测量得出的平均值作为最终数据进行统计学分析。
四、统计学方法
采用SPSS 20.0软件进行统计学分析。肿瘤完全坏死组织采用配对样本t检验来分别对治疗后1个月、3个月和治疗前肿瘤组织ADC值进行比较,并对相应时期的正常肝组织进行比较,因为残留活性组织病灶仅有1例,病例数过少故不再单独对其进行统计学分析。P<0.05为差异有统计学意义。
结 果
23例患者(24个肝细胞癌病灶)均有乙型肝炎病史,均进行了射波刀治疗。24个病灶中位于肝左叶病变共7个,右叶16个,左右叶交界区1个。术后6~12个月,23个病灶完全坏死,1个病灶残留活性。治疗前后肿瘤完全坏死病灶及正常肝组织ADC值见表1。完全坏死病灶术后1个月及3个月的ADC值与治疗前差值比较差异均有统计学意义(P<0.05),见表2。坏死组织ADC值较治疗前肿瘤组织高(图1~6);射波刀治疗6个月后部分肿瘤坏死消失,DWI及ADC图可见病变区域的肝组织呈放疗后改变(图7~8);正常肝脏在治疗后1及3个月和治疗前的ADC值比较差异无统计学意义(P>0.05)。1个残留活性病灶ADC值为1.05×10-3mm2/s,低于完全坏死病灶ADC值。用ADC值来预测射波刀术后完全坏死组织,其ROC曲线下的面积为0.830,以1.29×10-3mm2/s为诊断截断值,诊断的灵敏度为85.7%,特异度为47.6%。
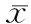
表1 射波刀治疗后不同时间肿瘤完全坏死及正常肝组织ADC值(×10-3 mm2/s, ±s)
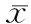
表2 23例小肝癌患者射波刀治疗后与治疗前肿瘤完全坏死及正常肝组织ADC的差值(×10-3 mm2/s, ±s)
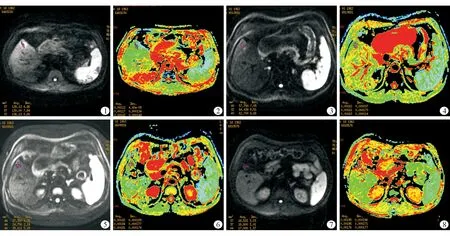
图1~8 男,50岁,肝细胞癌。图1,2为治疗前肿瘤组织DWI及ADC图,可见肝S5前缘高信号结节,病灶ADC值为1.10×10-3 mm2/s。图3,4射波刀治疗后1个月肿瘤组织DWI及ADC图,肝S5前缘结节呈稍高信号,ADC值为1.62×10-3 mm2/s。图5,6为射波刀治疗后3个月肿瘤组织DWI及ADC图,肝S5前缘结节呈等信号,ADC值为1.82×10-3 mm2/s。图7,8为射波刀治疗后6个月的DWI及ADC图,肝S5结节完全坏死、消失
讨 论
目前肝细胞癌治疗效果多采用实体肿瘤效果评价标准[9-10],其是基于肿瘤大小及动脉期血供情况,适用于肝细胞癌多种治疗后疗效的评估。肝脏是放射敏感器官,尽管同步呼吸实时追踪技术的应用已将放射损伤减少了许多,但放疗后3个月内出现的急性放射性肝损伤仍是不可避免的,急性放射损伤造成术后短期内病灶周边肝组织MR信号的改变,使得对病灶大小的判断很困难,放射损伤的磁共振平扫T2及动态增强扫描表现均与残留活性的肿瘤组织相似,故此期间用增强扫描的方法判断其活性也存在一定困难,这也是制约其临床应用的重要因素之一[11]。但随着时间延长,急性放射性损伤的逐渐减少及消失,它仍可以作为疗效评价的金标准。既往文献表明病变术后3个月以上的随访,可以按照实体肿瘤效果评价标准进行评价[12]。但临床医生希望影像检查能够在术后早期1~2个月就对其治疗效果进行评价,以便指导后续治疗。
DWI技术是通过在自旋转回波的T2加权序列中施加一对梯度脉冲,将肝内的胆管与血管的干扰信号去除掉,使病变组织得到了更好地显示,通过不同的b值获得DWI序列信号值。ADC是一种定量的单指数模型的DWI参数,它通过描述组织内水分子扩散的速率与范围,从细胞分子水平观察水分子运动受限情况,间接反映组织内部结构功能变化,如单体素内的细胞数目、细胞膜的完整性、细胞外间隙的大小等信息,不使用对比剂就可以无创且定量检测活组织内水分子扩散情况[13]。有研究表明,在肝细胞癌的MRI检查中DWI高信号的识别率将近90%,它与LAVA动态增强扫描对疾病的检出率差异无统计学意义,ADC 值可作为评价肿瘤病理分级的一种量化指标[14-16]。唐磊等[17]也认为磁共振扩散加权成像DWI和ADC是肿瘤靶向治疗疗效早期评估的潜力指标。
既往研究结果表明,射波刀治疗肝细胞癌前后正常肝组织的ADC值差异有统计学意义[18],本研究的结果与其相同。DWI检查能够反映组织的内部信息,肿瘤组织中细胞密集度的增加,细胞器及细胞内其他物质的增多,加之细胞间隙的变小,都会使组织水分子的扩散受到限制,在DWI表现为明显高信号,其ADC值低于正常肝组织及坏死组织[19-20]。同样的原理残留活性病灶及复发的病灶ADC值也低于坏死组织的ADC值[21]。本研究结果显示,小肝癌射波刀术后1个月及3个月病变的ADC值与术前的ADC值比较差异有统计学意义,术后病灶的ADC值均较治疗前的值升高。ADC值表示的是自由水分子在不同方向上扩散的速度和范围,组织坏死后细胞膜通透性增加甚至破裂,细胞数量减少,细胞间隙增大,其内水分子扩散程度增加,引起DWI上病灶信号的减低和ADC值升高。Schmid-Tannwald等[22]的研究也表明治疗后ADC值升高的幅度与肿瘤坏死的程度正相关,可预测疗效及预后。本研究也表明术后1个月就可以用DWI来区分小肝癌术前的肿瘤组织与术后完全坏死组织相区别。用ADC值来预测射波刀术后肿瘤坏死的ROC曲线下面积是0.830,用1.29×10-3mm2/s作为阈值,诊断的灵敏度为85.7%,特异度为47.6%。
本研究的局限性在于:第一,由于小肝癌的病灶较小,造成术后肿瘤完全坏死的比例偏高,残留活性的数量太少;第二,因MR-DWI图像的分辨率较低,容易产生图像变形及伪影,影响其测量出ADC值的准确度[23],故本组排除的病例较多,同时受研究时间限制,本研究纳入的样本量偏小;还有待于更长时间的大样本数据进一步研究证实;第三,由于晚期放射反应造成射波刀术后6个月肝组织局部纤维化,肝脏形态会有一定的变化,造成术后6~12个月扫描的层面与前几次扫描层面不能完全对应,数据会存在一定的偏差。
