小麦-簇毛麦易位系V832抗条锈性遗传分析及细胞学鉴定
2021-03-15卢涛杨艳徐志马东方尹军良
卢涛,杨艳,徐志,马东方,,尹军良
( 1.长江大学农学院,主要粮食作物产业化湖北省协同创新中心,湖北 荆州 434025;2.四川省农业科学院植物保护研究所,农业部西南作物有害生物综合治理重点实验室,四川 成都 610066)
由小麦条锈菌(Pucciniastriiformisf.sp.tritici) 引起的小麦条锈病在我国西北麦区、长江中下游麦区、华北麦区、西南麦区等地普遍发生,尤其是西北地区的小麦条锈病最重[1-2].虽然化学药剂防治可以及时控制该病害,但是有违我国目前提倡的“减药”方针.而且小麦条锈菌极易通过有性生殖产生新的毒性更强的生理小种,加之大面积推广小麦品种的抗感病程度不同或抗源的单一化导致条锈病常年大范围发生和大区域流行[3-4],已严重影响我国粮食安全.
截至2019年,国际上正式命名的抗条锈基因已有81个,即Yr1~Yr81[5-6].其中Yr5、Yr8、Yr9、Yr15、Yr17、Yr19、Yr24、Yr26、Yr28、Yr35、Yr36、Yr37、Yr38、Yr40、Yr42来自于小麦的稀有种或近缘种属,其余抗条锈病基因均来自普通小麦.除了上述已经命名的基因以外,还有一些未被正式命名的基因.如本课题组暂命名的抗条锈病基因YrR39、YrBai、YrH9017、YrH9015、YrS1和YrS2等[7-10].聚合全生育期和成株期抗条锈基因的小麦可达到持久抗条锈的特点[11].自1950年以来,我国已经发生了7次大规模小麦抗条锈“丧失”事件[12].因此,迫切需要鉴定新的抗条锈小麦品种(系),加速持久抗病小麦的选育.
小麦野生近缘植物中含有丰富的优良抗逆基因,利用远缘杂交技术将外缘抗病基因导入普通小麦,对改良普通小麦的抗性,累积抗病遗传增益具有重要战略意义[13-14].簇毛麦(Haynaldiavillosa2n=14VV)是小麦亚族簇毛麦属的一年生二倍体物种,对小麦全蚀病、小麦条斑病和叶枯病等具有良好抗性.傅杰等[15]已成功将簇毛麦的这些优良基因导入普通小麦中,形成一系列的小麦新品系.本研究利用我国流行的条锈菌小种(菌系)对簇毛麦易位系V832进行抗性鉴定、遗传分析和细胞学分析,以明确V832是否携带小麦抗条锈病基因并鉴定抗病基因来源以及细胞学特性,为进一步利用簇毛麦中优良抗条锈病基因提供理论支持.
1 材料与方法
1.1 供试材料
小麦V832、铭贤 169、簇毛麦、普通小麦7182,由西北农林科技大学植物保护学院抗病遗传研究室提供.以铭贤169为母本,与V832进行杂交获得F1、F2、F3、BC1群体,条锈菌流行小种和菌系Su11-4、Su11-7、CYR23、CYR29、CYR32、CYR33及CYR34,由长江大学农学院分子真菌与基因组学实验室保存.
1.2 试验方法
所有供试小麦种子先用1%的H2O2浸泡10 min,蒸馏水清洗后浸种24 h,待种子萌发后播种,置于数控温室中培育.待小麦幼苗长至二叶期接种第一片叶,用手指蘸清水轻搓叶片表面以脱去蜡质层,将新鲜条锈菌夏孢子涂抹于小麦叶片正面,接种后将小麦放入暗箱(10 ℃、相对湿度100%)培养,24 h后取出,放置温室继续培养,温度控制在15~17 ℃(昼)/10~12 ℃(夜),每日光照15 h,光照强度 729 mol/(m2·s),相对湿度75%~80%[16].
1.3 调查与统计分析
待感病的铭贤169充分发病时调查接种小麦的发病程度.反应型分为11级,分别是:0、0;、0;+、1、1+、2、2+、3-、3、3+、4,发病程度从低到高划分,其中0为免疫,4为小麦叶片着生大量条锈菌夏孢子堆且无褪绿斑,划分0~2+型为抗病,3-~4为感病.据此标准调查抗病亲本、感病亲本、F1、BC1、F2和F2∶3代接种后的反应型[17].统计抗病和感病数目,计算杂交群体F2的抗感分离比例以及F2∶3家系的分离比例,并用χ2(≤χ20.05)和P值进行分离比例的适合度检验,确定最适分离比率,进而明确小麦V832含有的抗病基因数目[18].
1.4 基因组原位杂交(GISH)
将小麦V832种子放置在无菌水中培养,剪取1.5 cm新鲜根尖,放置于冰水中12 h,再固定于卡诺氏固定液(无水乙醇∶冰醋酸=3∶1)中24 h,蒸馏水清洗3遍后在45%冰醋酸中压片,液氮冷冻揭片后置于-20 ℃保存.用地高辛(Roche,Germany)标记华山新麦草总DNA,与制备好的H1684杂交后加抗体地高辛-荧光素,用含适量碘化丙锭的抗褪色剂封片,最后置于荧光显微镜观察染色体构型并照相[19].
2 结果与分析
2.1 V832苗期的抗性鉴定及抗性来源分析
以铭贤169为感病对照,用条锈菌生理小种Su11-4、Su11-7、CYR23、CYR29、CYR32、CYR33及CYR34对V832进行苗期抗条锈性接种测试.结果表明,V832对所有参与测试小种表现为免疫到高抗(表1).因此,V832是一个优良抗小麦条锈病的抗源.
用Su11-4、Su11-7、CYR23、CYR29、CYR32、CYR33及CYR34对簇毛麦和7182进行了苗期抗条锈性接种测试.结果显示,V832的抗病反应型小麦与簇毛麦极为接近,为免疫到高抗( IT 0~0;);而7182与铭贤169一致( IT 3+~4)(表1).据此推断,V832对条锈病的抗性极有可能来自于簇毛麦.

表1 V832及其亲本苗期的抗条锈性鉴定结果Table 1 Evaluation of resistance of V832 and its parents to Puccinia striiformis in seedling stage
2.2 V832 苗期抗病性遗传分析
结果显示,所有杂交群体的F1代均表现抗病反应型.接种Su11-7的BC1代群体中,12株抗病,14株感病,符合1∶1分离比(χ2=0.04,P=0.69);F2群体中,102株抗病,31株感病,符合3∶1的分离比(χ2=0.12,P=0.65);由F2获得的F2∶3代家系中纯抗家系36个,抗感分离家系66个,感病家系31个,符合1∶2∶1分离比(χ2=0.38,P=0.83).结果表明,V832对Su11-7的抗病性是由1对显性基因控制.
接种CYR32的BC1代群体中,14株抗病,11株感病,符合1∶1分离比(χ2=0.16,P=0.55);F2群体中,168株抗病,52株感病,符合3∶1的分离比(χ2=0.15,P=0.64);F2∶3代家系中纯抗家系61个,抗感分离家系105个,感病家系50个,符合1∶2∶1分离比(χ2=1.29,P=0.83).结果表明,V832对CYR32的抗病性是由1对显性基因控制.
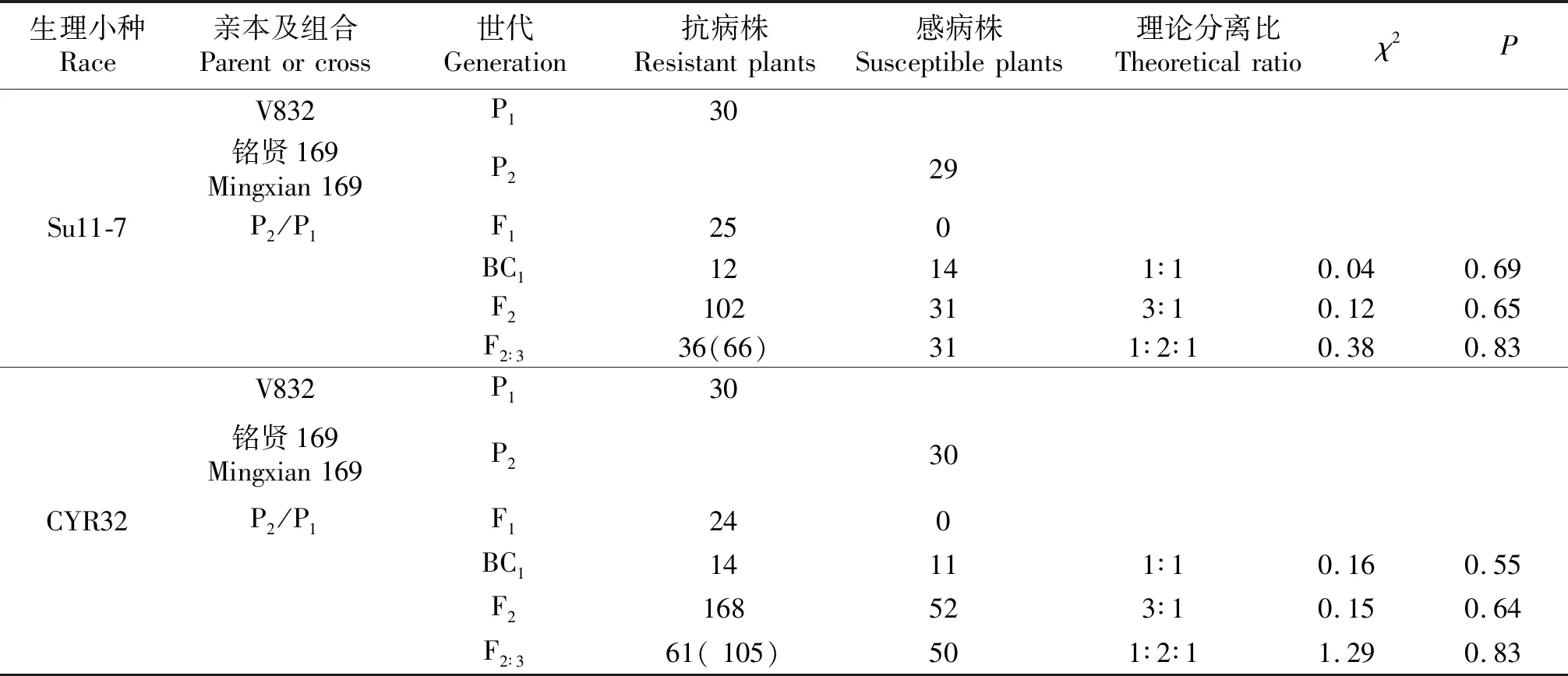
表2 V832对Su11-7和CYR32的抗条锈病遗传分析Table 2 Inheritance analysis of V832 to Pst races of Su11-7 and CYR32
2.3 V832的细胞学特征
以簇毛麦总DNA为探针,对V832 进行了基因组原位杂交(GISH)试验.结果表明,V832含有42条染色体,并有一对染色体片段呈现簇毛麦DNA信号(图1).这表明V832含有来自簇毛麦的染色体或大的染色体片段.

图1 V832的原位杂交结果Figure 1 Insitu hybridization analysis of line V832
3 讨论
根据课题组多年田间鉴定结果,易位系V832具有良好的全生育期抗病性.本研究对V832的抗条锈性鉴定结果表明,V832对我国目前流行的条锈菌小种具有优良的抗病性,推测抗病基因可能来源于簇毛麦.V832对Su11-7和CYR32的抗、感病的分离比例符合3∶1的分离模式,说明衍生于簇毛麦的小麦新抗源V832对Su11-7和CYR32分别由一对显性基因控制.但是V832对Su11-7和CYR32的抗病基因是否相同,以及该基因在V832染色体上的具体位置有待通过分子标记进一步确定.以便后续挖掘与抗病基因连锁的分子标记用于分子辅助育种.
上世纪70年代中期起,南京农业大学细胞遗传实验室将簇毛麦的多种抗病基因导入普通小麦.研究者选育了一批兼抗白粉病和条锈病的小麦-簇毛麦异附加系、代换系和易位系[20].90年代末井金学等[21]用当时的小麦条锈病菌优势小种CYR29、CYR30和CYR31测定了簇毛麦与小麦的杂交后代的抗条锈性,结果表明簇毛麦含有宝贵的抗条锈基因,并认为簇毛麦的抗条锈基因可转移至普通小麦中,并且此类基因具有较强的传递性.进入21世纪以来,侯璐等[22]对两个小麦-簇毛麦易位系进行抗条锈性遗传检测,表明小簇麦易位系V9128-1至少含有两对抗条锈基因,V9129-1中至少含有3对抗条锈病基因.尹军良等[23]对小麦-簇毛麦易位系中的V9125-3和V9125-4进行抗条锈性遗传分析,表明V9125-3和V9125-4都至少含有两对抗条锈基因.这5个易位系(V832、V9128-1、V9129-1、V9125-3和V9125-4)抗条锈基因的异同必须通过等位性分析加以确认.本实验室后续将开展相关工作,以便于抗条锈基因的精准利用.周新力等[24]通过对小麦-簇毛麦易位系V9128-1进行抗条锈遗传分析和分子标记,表明V9128-1对CYR30的抗条锈性是由一对显性基因控制,并将YrV1定位于3BS染色体上.侯璐等[25]通过对小麦-簇毛麦易位系V9128-3进行抗条锈遗传分析和分子标记,表明V9128-3对Su11-4的抗条锈性是由一对显性基因控制,并将YrHV定位于2AL染色体上.王睿等[26]通过对小麦-簇毛麦易位系V9125-2进行抗条锈遗传分析和分子标记,表明V9125-2对CYR29的抗条锈性是由一对显性基因控制,并将YrWV定位于7DS染色体上,而且抗病基因YrWV不同于YrHV和YrV1.综上,已育成的小麦-簇毛麦易位系中含有丰富的抗条锈基因,且为质量遗传,作为抗源在小麦抗锈育种中具有重要的应用价值.利用外源抗病基因防治条锈病在我国小麦生产中也取得了良好的实践效果,如小偃6号[27]、中梁22[28]等.本研究发现的优异抗病资源V832对多个条锈菌小种均具有良好抗病性,可能含有多个抗病基因,因此具有很好的利用价值.
4 结论
本研究通过基因组原位杂交(GISH)证实了V832含有来自簇毛麦的染色体片段,而且外源染色体片段长达整个染色体短臂,推测V832中的抗条锈病基因来源于簇毛麦.小麦易位系V832可以通过杂交将优良基因导入其他主栽小麦品种中,加之V832与普通小麦7182的农艺性状接近,所以V832在育种上的直接利用更具可行性.尤其是在新的条锈菌小种不断出现的形势下,综合利用簇毛麦中的抗条锈病基因对我国小麦抗病育种具有重要意义.
