丹参叶柄遗传转化体系的建立及EDT1基因的导入
2021-03-15张换样李静朱永红秦丽霞竹梦婕吴慎杰焦改丽
张换样,李静,朱永红,秦丽霞,竹梦婕,吴慎杰,焦改丽
(山西农业大学棉花研究所,山西 运城 044000)
丹参是著名的传统中草药之一,广泛应用于预防和治疗高血脂,心脑血管,和急性缺血性中风等疾病.以丹参为主的多种复方制剂如复方丹参注射液、复方丹参片、复方丹参胶囊和复方丹参滴丸等被广泛用于临床治疗心血管疾病、肾病、肝病及抗感染等[1].
我国大部分丹参种植区位于黄土高原干旱半干旱生态区,常年降雨量较少,丹参生长期内常受到干旱胁迫,干旱胁迫引起丹参根部生长不良,对丹参的生长发育和药用成分造成很大影响,因此增强丹参抗旱能力有非常重要的意义[2-3].高效的丹参遗传转化体系,对于创制优良丹参种质资源、研究丹参代谢调控机理具有重要意义[4-6].目前不少研究单位已经初步建立了丹参的遗传转化体系.但常用的以丹参叶片和茎段为外植体进行遗传转化,存在不易操作,分化率低等很多问题.本研究以叶柄为外植体进行遗传转化可以有效解决这些问题.从拟南芥耐旱突变体edt1中分离克隆出的EDT1基因,在干旱胁迫下调控一系列耐旱基因表达和信号转导,在野生型拟南芥和烟草中过表达EDT1,不但显著增强抗旱性与改良根系构型,提高光合效率和水分利用率.本研究以叶柄为外植体拟建立一套高效的丹参遗传转化体系,并将EDT1基因转入常规的丹参栽培品种中,以期获得抗旱性增强的优良丹参种质材料[7].
1 材料与方法
1.1 材料与试剂
1.1.1 受体材料 本研究选用HLM(成都电子科技大学提供)为受体丹参品种.
1.1.2 外源植物表达载体 外源植物表达载体为pCB3000-EDT1为人工合成载体,pCB系列的植物表达载体及相关元件已在植物基因操作中广泛应用[7],所用启动子为35S启动子,控制基因在转基因植物不同的组织和器官内都有表达,长835 bp,来自花椰菜花叶病毒.终止子为Nos,来源为农杆菌Ti质粒胭脂碱合成酶基因的终止子序列.
1.1.3 培养基配方 共培养及愈伤组织诱导培养基:MS+2.0 mg/L 6-BA+0.1mg/L NAA;抗性愈伤组织筛选培养基:MS+2.0 mg/L 6-BA+0.1 mg/L NAA+50 mg/L卡那霉素(Kan)+500 mg/L潮霉素(Cef);生根培养基: 1/2 MS+250 mg/L Cef.以上所有培养基 pH值均为5.8,121 ℃高压灭菌15 min,卡那霉素和头孢霉素在灭菌后温度降至60 ℃左右时于超净工作台加入.培养室温度为(25±2)℃,光周期条件为16 h/8 h,光照强度为2 000 lx,其中共培为暗培养[8-9].
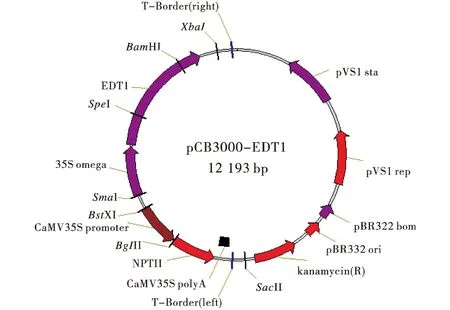
图1 pCB3000-EDT1载体图谱Figure1 Map of Vector pCB3000-EDT1
1.2 方法
1.2.1 丹参无菌苗的制备 将丹参种子用4% NaClO溶液浸泡5 min,再用30% H2O2溶液浸泡5 min,然后用无菌水清洗3遍,接种于1/2 MS培养基上,3 d后开始发芽,分别取发芽14 d的叶片、叶柄和茎段作为外植体.
1.2.2 农杆菌的活化与外植体的浸染、转化、筛选、再生 挑取单菌落,接种于液体培养基中加入Kan 50 mg/L及利福平(rif)20 mg/L,28 ℃、180 r/min振荡培养24 h.将菌液倒入无菌离心管中,离心5 min,弃上清,加入液体培养基稀释.将外植体材料放入稀释后的菌液中浸染15 min,取出用无菌滤纸吸去菌液.将外植体放入共培培养基上避光培养48 h.
将共培48 h后的外植体转接于含有卡那霉素和头孢霉素的筛选培养上继续培养.每15 d更换1次培养基.待再生芽长到1 cm左右时,转入生根培养基生根.生根后的再生株经PCR检测并移栽到温室花盆中.
1.2.3 不同外植体的转化效率比较 以叶片(0.5 cm×0.5 cm)、叶柄(1 cm)、茎段(1 cm)为外植体,分别选50个外植体在1.2.2的条件下进行浸染转化,3次重复,分别于共培后30 d、45 d和60 d统计分化出再生芽的外植体数.比较3种外植体的转化效率.
1.2.4 菌液浓度和浸染时间的转化效率比较 收集D600=0.6时的农杆菌,用MS液体培养基分别稀释至菌浓度为D600=0.1、0.2、0.3、0.4、0.5、0.6的浓度梯度,设计不同的浸染时间(10、15、20、30、60 min)进行浸染处理.共培养48 h后,在含卡那霉素50 mg/L的培养基上筛选,每15d更换一次培养基,统计外植体分化率.
1.2.5 转EDT1基因丹参再生株的PCR检测 取少量丹参再生株叶片(T0)与受体对照(CK)叶片,利用CTAB法提取总 DNA.EDT1基因的扩增引物为P1:5′-AACTGGTTGTGGACCTTTTGGT-3′和 P2:5′-TCGACAAGTGCCATAGCATTCA -3′,扩增产物片段大小为557 bp.PCR反应程序为:95℃预变性3 min,然后94 ℃变性30 s;62 ℃退火30 s;72 ℃,延伸60 s;40个循环,最后再72 ℃延伸10 min.扩增产物1.0%琼脂糖凝胶电泳检测[10-13].
1.2.6 转EDT1基因丹参再生株的抗旱性鉴定 获得的转基因丹参T0代植株及其受体对照移栽到花盆中,成活后停止浇水,20 d后复水,比较复水后转EDT1基因丹参与其受体对照生长情况,初步鉴定转EDT1基因丹参的抗旱性.
2 结果与分析
2.1 不同外植体的转化效率比较
以丹参叶柄、叶片和茎段作为外植体进行比较,不同外植体的分化情况不同,以叶柄作为外植体分化和再生都相对较好(图2).对不同外植体浸染培养不同时间的分化率和最终成苗数进行统计,如表1所示,不同丹参外植体的转化效率差异显著,分化速度也有明显差异.培养30 d后,叶柄外植体与茎段差异显著(P<0.05),与叶片差异不显著(P<0.05),叶片与茎段之间差异不显著.培养45d后叶柄与叶片和茎段之间差异极显著,叶片与茎段之间差异不显著.培养60 d后,叶柄与叶片和茎段之间差异极显著,叶片与茎段之间差异不显著.最终成活再生苗数叶柄与叶片和茎段之间差异极显著,叶片与茎段之间差异不显著.以丹参叶柄作为外植体分化率高、分化速度快,比叶片和茎段有明显的优势.而且以叶柄作为外植体相对于叶片操作更方便,后期培养更易于消除农杆菌污染,减少细菌污染几率.

A、B、C:以叶片为外植体转化丹参;D、E、F:以叶柄为外植体转化丹参;G、H、I:以茎段为外植体转化丹参.A、B、C:Transforming Salvia miltiorrhiza with leaves as explants;D、E、F:Transforming Salvia miltiorrhiza with leaflets as explants;G、H、I:Transforming Salvia miltiorrhiza with stem segments as explants.图2 不同外植体转化丹参比较Figure 2 Comparison of Salvia miltiorrhiza transformation with different exoplants
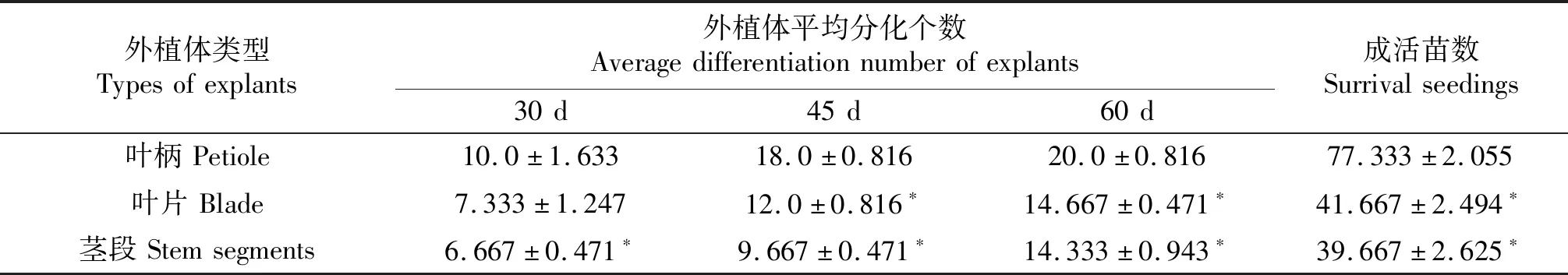
表1 不同外植体的转化效率比较Table 1 Comparison of conversion efficiency of different explants
2.2 转EDT1基因丹参植株的获得
经种子消毒处理获得的丹参无菌苗14 d叶龄叶柄切成1 cm左右的小段,经农杆菌浸染、共培48 h后,转移到含50 mg/LKan的筛选培养基上,每15 d继代一次,经筛选共获得44个克隆的142个阳性再生株(图 3).

A:丹参叶片农杆菌浸染;B:丹参叶片浸染后诱导愈伤和出芽;C:丹参茎段农杆菌浸染;D:丹参茎段浸染后诱导愈伤和出芽;E:丹参叶柄农杆菌浸染;F:丹参叶柄浸染后诱导愈伤和出芽;G:丹参再生株获得;H:丹参再生株获得.A:Agrobacterium tumefaciens of Salvia miltiorrhiza leaves;B:Induction of callus and budding of Agrobacterium tumefaciens Salvia miltiorrhiza leaves;C:Agrobacterium tumefaciens in stem segment of Salvia miltiorrhiza;D:Induction of callus and budding of Salvia miltiorrhiza stems after soaking;E:Salvia miltiorrhiza petioles impregnated with Agrobacterium tumefaciens;F:Induction of callus and budding of Salvia miltiorrhiza after soaking;G:Obtaining of Salvia miltiorrhiza regeneration plant;H:Obtaining of Salvia miltiorrhiza regeneration plant.图3 转EDT1基因丹参的获得Figure 3 Acquisition of EDT1gene Salvia miltiorrhiza
2.3 农杆菌液浓度及浸染时间对丹参转化效率的影响
如图4所示结果表明,农杆菌浓度和浸染时间对丹参的转化效率有显著影响.相同农杆菌液浓度不同浸染时间比较结果表明,浸染15 min与其它浸染时间比较,分化率显著提高.相同浸染时间不同农杆菌液浓度的转化率比较结果表明,在所有的浸染时间中,农杆菌液浓度D600=0.4时分化率显著高于其它浓度.根据试验结果,选择农杆菌液浓度D600=0.4,浸染时间15 min作为最适宜的浸染条件.
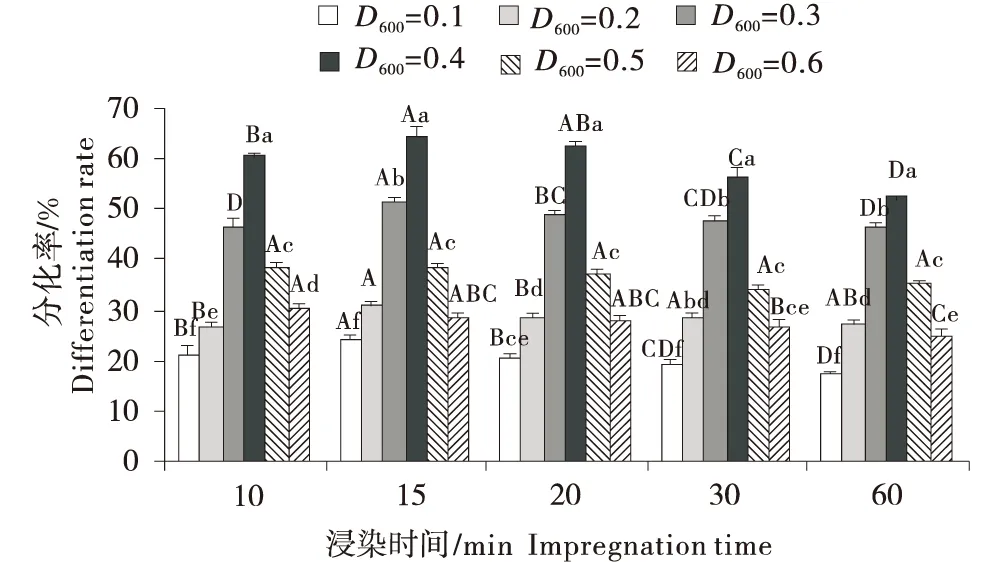
图4 农杆菌液浓度及浸染时间对丹参分化率的影响Figure 4 Effect on differentiation rate of Salvia miltiorrhiza of Agrobacterium tumefaciens concentration and soaking time
2.4 转EDT1基因丹参再生株的PCR检测
PCR检测结果表明,共获得44个克隆的142个阳性再生株.142个阳性株均扩增出大小相同,长度为 557 bp的目标条带,空白对照和受体对照均未扩增出目标条带(图5),证明外源基因EDT1已导入受体丹参基因组 DNA中.
2.6 转EDT1基因丹参再生株的抗旱性鉴定
经PCR检测为阳性的转基因丹参植株,经扩繁后,移栽到网室花盆中.为鉴定转基因丹参植株的抗旱性,选取4个阳性再生株系与其受体对照,干旱胁迫 20 d,当转基因株系与对照均表现萎蔫,这时进行复水处理,复水后转基因植株恢复生长,受体对照不能恢复生长.表明转EDT1基因丹参比其受体对照抗旱性增强(图6).

M:mark2000;1:空白对照;2:受体对照;3~144:转EDT1基因丹参阳性株.M:mark2000;1:Black control;2:Pecep control;3~144:Positive strain of transferring EDT1 gene Salvia miltiorrhiza.图5 转EDT1基因丹参的PCR检测Fgure 5 PCR detection of transferring EDT1gene Salvia miltiorrhiza

A为受体对照丹参植株,B、C、D、E为转EDT1基因丹参植株;1为干旱胁迫前的转EDT1基因丹参植株及受体对照丹参植株;2为干旱20d后的转EDT1基因丹参植株及受体对照丹参植株;3为复水后的转EDT1基因丹参植株及受体对照丹参植株.A.Receptor of EDT1gene Salvia miltiorrhiza,B、C、D、E.EDT1 gene Salvia miltiorrhiza;1.EDT1 gene Salvia miltiorrhiza plants and receptor plants before drought Stress;2.EDT1 gene Salvia miltiorrhiza plants and receptor plants of 20 days after drought stress;3.EDT1 gene Salvia miltiorrhiza plants and receptor plants after rewater.图6 转EDT1基因丹参抗旱性鉴定Figure 6 Identification of drought resistance of EDT1gene Salvia miltiorrhiza
3 讨论
丹参的遗传转化体系创建,已取得一些成熟的研究成果.常用的转化方法是以叶片和叶柄为外植体,采用MS+6-BA+NAA作为诱导愈伤组织的培养基,并以头孢霉素作为除菌培养抗生素.本研究比较了以叶柄、叶片和茎段分别作为外植体的转化效率,以及不同农杆菌液浓度和浸染时间对转化效率的影响,最终确定了以14 d叶龄叶柄为外植体,农杆菌液浓度D600=0.4 浸染15 min,MS+2.0 mg/L 6-BA+1.0 mg/L NAA 愈伤诱导培养基为基本条件的丹参转化体系[14-17].
丹参遗传转化受基因型限制不明显[18-20],报道的受体品系也比较多.目前报道的丹参转化以叶盘为外植体的较多,多数研究者的研究结果表明叶片比叶柄转化效率更高,而上海师范大学周伟的研究表明,28 d叶龄的丹参叶柄比叶片的分化效率更高,更容易成芽[21-24].本研究以14 d叶龄的叶柄、茎段和叶片为外植体,结果表明以叶柄为外植体比叶片和茎段有明显优势,表现在分化率高,分化速度较快.不同外植体的分化效率可能与丹参叶龄有关,当丹参叶龄在7~14 d时,叶片的分化效率较高,当叶龄超过14d至28d甚至更长时,叶柄的分化效率较高.无论叶龄大小,以叶柄为外植体在浸染过程中更易于操作,相比之下,叶片难以剪切,放置时间稍长会萎蔫卷曲.在后期培养中,叶片四周容易翘起脱离培养基,造成农杆菌清除困难[25-27].
EDT1基因是中国科技大学向成斌教授从拟南芥耐旱突变体edt1中分离克隆得到的,在野生型拟南芥和烟草中过表达EDT1基因不但显著增强抗旱性与改良根系构型,还显著提高光合效率和水分利用率[28].EDT1基因被转入玉米、水稻、棉花中,获得了抗旱性显著提高的种质材料[29].在干旱胁迫下,本研究获得的转EDT1基因再生丹参植株叶片及根系生长明显优于受体对照,抗旱能力明显提高.
