miR-9-5p调控雄激素受体的表达促进卵巢颗粒细胞增殖
2021-03-15王芳杨丽华余柯达何健英邹立波
王芳,杨丽华,余柯达,何健英,邹立波
(金华市人民医院生殖中心,金华 321000)
多囊卵巢综合征(PCOS)是一种女性最常见的内分泌失调疾病,影响大约5%~10%育龄妇女[1-2]。PCOS主要以高雄激素血症、慢性无排卵和多囊卵巢为主要临床表现,并常伴有痤疮、脱发、皮脂溢、肥胖、多毛症和棘皮症等[3]。当前越来越多的研究发现,卵巢颗粒细胞(KGN)的异常增殖与PCOS的形成有密切关系[4-5]。因此,探究KGN增殖潜在的调控机理将为PCOS的治疗提供新的方案。微小RNA(microRNAs,miRNAs)是一类高度保守的小型非编码RNA,通过与目标mRNA 3’-非编码区(3’-UTR)互补配对,在转录后水平上调节基因转录和翻译[6]。先前已有大量研究证明,异常表达的miRNAs与人类多种疾病的病理过程有关,包括肿瘤、炎症性疾病、代谢性疾病及PCOS等[7]。当前研究者已发现数十种miRNAs通过调控KGN增殖而在PCOS形成中发挥重要作用,如miR-19b[8]、miR-27a-3p[9]、miR-145[10]及miR-320a[11]等。但是,关于miR-9-5p在PCOS中的研究尚未见诸报道。本研究旨在比较miR-9-5p在PCOS患者及健康女性血清中的表达特征,分析在PCOS中的诊断价值,并探讨对KGN增殖的作用及机制。
资料与方法
一、实验材料
1.研究对象:收集2018年1月至2019年10月于金华市人民医院生殖中心就诊的50例PCOS患者为实验组,以体检科进行健康体检的50例健康女性为对照组。所有参与者要求年龄为18~35岁。实验组纳入标准[12]:(1)闭经或少经(每年<8个月经周期);(2)临床或生化检查提示高雄激素血症,临床高雄激素血症[13]诊断标准:多毛症,且Ferriman-Gallwey评分≥3;生化高雄激素血症[14]:根据正常月经的健康女性的睾酮水平,将总睾酮水平或游离睾酮水平定为高于第95个百分点(总睾酮>67 ng/dl或游离睾酮>0.84 ng/dl)。对照组为月经正常、卵巢功能正常、无高雄激素血症的女性。所有参与者排除标准:先天性肾上腺皮质增生症,库欣综合征,过去3个月内服用过药物(类固醇、避孕药、二甲双胍或噻嗪类利尿剂等)。
本研究经金华市人民医院伦理委员会批准通过,所有参与者均签署知情同意书。
2.主要试剂及仪器:Trizol与Lipofectamine 2000试剂(Invitrogen,美国),反转录及荧光定量试剂盒(QIAGEN,德国),PCR引物(上海生工生物工程),DMEM培养基、FBS与双抗(Thermo Fisher Scientific,美国),miR-9-5p拮抗剂(antagomir)与阴性对照(antagomir control)(苏州吉玛基因),MTT与DMSO(Sigma-Aldrich,美国),双重荧光素酶报告基因分析系统(Promega,美国),兔抗人单克隆AR抗体(ab108341)、兔抗人单克隆GAPDH抗体(ab181602)及山羊抗兔HRP二抗(ab6721)均购自英国Abcam,。全自动生化测试仪(BK-1200#,济南博科生物),荧光定量PCR仪(7500HT/FAST#,ABI,美国),酶标仪(680#,BIO-RAD,美国),二氧化碳细胞培养箱(MCO-18AC#,SANYO,日本),流式细胞仪(CytoFLEX#,Beckman,德国)。
二、研究方法
1.生化检测:测量所有参与者的身高和体重,并计算体质指数(BMI)。通过化学发光免疫法测量睾酮(T)水平,通过葡萄糖氧化酶法测定空腹血糖(fasting plasma glucose,FPG)水平,通过放射免疫法测定空腹胰岛素(fasting serum insulin,FINS)及黄体生成素(LH)、卵泡刺激素(FSH)及抗苗勒管激素(AMH)水平。
2.RNA提取和qRT-PCR:从所有参与者肘前区域采集5 ml全血样品,部分分离血清并置于-80℃保存。按照试剂说明,从剩余全血样品中提取总RNA,并反转录合成cDNA。根据实时定量PCR试剂盒说明书配制反应体系,反应条件:95℃ 150 min;95℃ 10 s,58℃ 30 s,72℃ 30 s,40个循环。以小核U6基因作为miR-9-5p的内参,进行PCR反应。miR-9-5p引物序列:上游引物5′-CGAGCTCTGTGTGTGTGTGTGTGTG-3′,下游引物5′-TTCCGCGGCCGCTATGGCCGAGGAA-3′;U6引物序列:上游引物5′-CTCGCTTCGGCAGCACA-3′,下游引物5′-AACGCTTCACGAATTTGCGT-3′。采用2-ΔΔCt法计算miR-9-5p的相对表达量[15]。
3.细胞培养:KGN购自日本茨城县理研生物资源中心,培养于含10%FBS、1%双抗的DMEM培养基,置于37℃、5% CO2、95%湿度的培养箱中培养。
4.细胞转染:细胞实验设计为3组,分别为空白组、antagomir control及antagomir组。空白组细胞不进行转染,而antagomir control及antagomir组细胞分别转染antagomir control及antagomir。具体操作如下:转染前一天,将KGN以2×105/孔的密度接种到6孔板中。使用Lipofectamine 2000试剂分别按照说明书进行antagomir和antagomir control的转染。将转染后的KGN在37℃、5%CO2的条件下培养48 h,收集细胞用于qRT-PCR检测。
5.MTT:将KGN以6×103/孔的浓度接种在96孔板中,并用antagomir和antagomir control进行转染。转染后24、48、72 h,将20 μl MTT(5 mg/ml)添加到每个孔中,并再孵育4 h。然后通过离心(1 000g×5 min,室温)弃去上清液,并向每个孔中加入100 μl二甲基亚砜(DMSO)以溶解结晶。使用ELx808酶标仪测量每孔在490 nm波长的吸光度(OD)。
6.流式细胞仪检测:将转染后的KGN细胞接种在6孔板中,并培养48 h后,用PBS洗涤两次并重悬。然后向细胞中加入70%的冷乙醇,混合后在4℃下孵育过夜。第二天离心收集细胞,在黑暗条件下向每个样品中添加2 μl RNA酶(RNase)和300 μl碘化丙啶(PI)染料溶液,混合并在室温和黑暗环境中孵育30 min。通过流式细胞仪检测各样品的细胞周期。
7.荧光素酶报告基因实验:通过PCR扩增含野生型或突变型miR-9-5p结合位点的AR mRNA 3′-UTR的部分片段,并将其克隆到pMIR载体的萤火虫报告基因的下游,产生重组载体AR-wt和AR-mut。使用Lipofectamine 2000试剂将构建的重组载体AR-wt和AR-mut与antagomir和antagomir control共转染到KGN中。转染后48 h,使用Promega公司提供的双重荧光素酶报告基因分析系统测定荧光素酶活性。以海肾荧光素酶活性为对照标准化各样品的萤火虫荧光素酶活性。
8.Western Blotting:按照蛋白裂解液RIPA说明书,提取处理后KGN的总蛋白,将30 μg总蛋白质收集在上样缓冲液中,12%SDS-PAGE电泳分离,随之转移到PVDF膜上。将膜与5%的牛奶封闭30 min,然后与抗AR(1∶1 000稀释)和GAPDH(1∶2 500稀释)抗体在4℃下孵育过夜,并采用TBS-T缓冲液洗涤3次,每次5 min。将膜与过氧化物酶偶联的二抗(1∶3 000稀释)在室温下孵育1 h,并采用TBS-T缓冲液洗涤3次,每次5 min。使用Bio-rad ChemiDoc MP Imaging系统检测蛋白条带,并利用Image Lab 软件分析各条带的光密度。
三、统计学分析

结 果
一、两组研究对象的一般临床资料和内分泌参数比较
两组研究对象的年龄及BMI差异均无统计学意义(P>0.05)。与对照组相比,实验组血清中T、FPG、FINS、LH及AMH水平均显著升高,而FSH水平则显著降低(P<0.05)(表1)。

表1 两组一般资料和内分泌参数比较
二、miR-9-5p在PCOS患者血清中表达特征及诊断价值
调整年龄和BMI后,miR-9-5p在实验组和对照组血清中的相对表达水平分别为(0.037±0.018)和(0.022±0.014),差异有统计学意义(t=6.51,P<0.001)(图1A)。ROC曲线显示,miR-9-5p在诊断PCOS中AUC为0.76,敏感性为65.43%,特异性为74.09%(P<0.001)(图1B)。
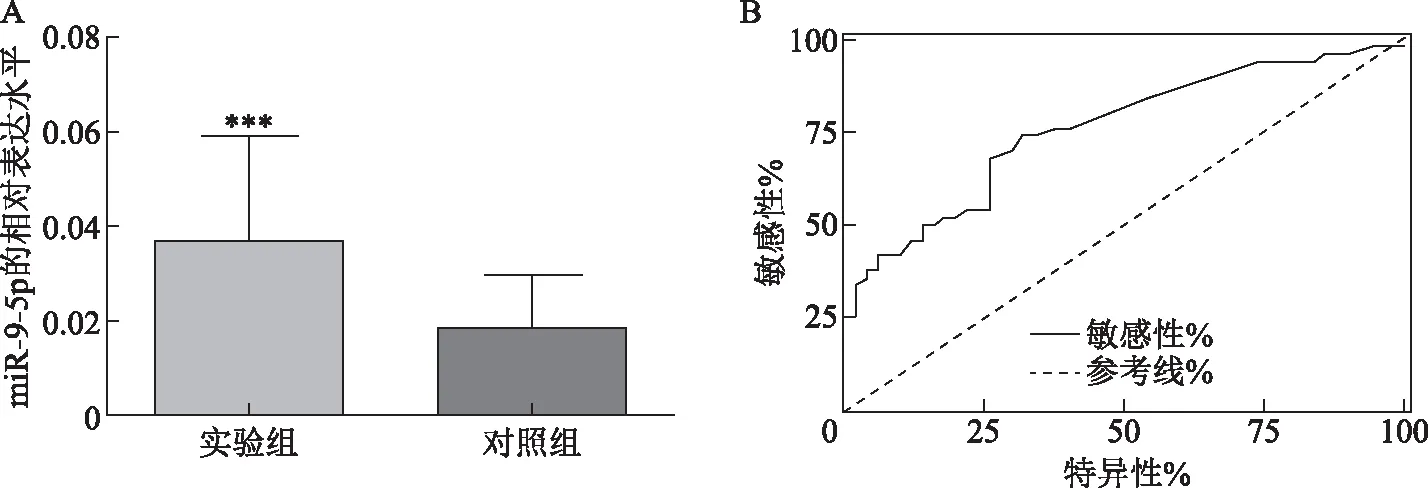
A:两组血清中miR-9-5p的表达水平;B:miR-9-5p 诊断PCOS的ROC曲线。与对照组比较,***P<0.001
三、转染antagomir后KGN细胞中miR-9-5p的表达水平变化
与空白组相比,KGN细胞转染antagomir和antagomir control 24 h后,细胞内可见大量红色荧光蛋白表达,表明转染效果良好(图2A)。空白组、antagomir control及antagomir组中miR-9-5p的相对表达水平分别为(1.0±0.21)、(1.05±0.16)及(0.17±0.19),组间比较具有显著性差异(F=29.29,P<0.001)。与空白组和antagomir control组相比,antagomir组中miR-9-5p的表达水平显著降低(P<0.001)(图2B)。

A:KGN转染效果鉴定;B:miR-9-5p在各组KGN内的表达情况。与空白组及antagomir control组比较,***P<0.001
四、miR-9-5p对KGN增殖能力的影响
MTT法检测转染后KGN在不同时间段增殖情况,结果显示,空白组细胞在0、24、48及72 hOD值分别为(0.24±0.025)、(0.40±0.032)、(0.76±0.058)及(0.95±0.077);antagomir control组细胞在0、24、48及72 h OD值分别为(0.24±0.025)、(0.38±0.029)、(0.77±0.049)及(0.91±0.073);antagomir组细胞在0、24、48及72 h OD值分别为(0.24±0.025)、(0.31±0.034)、(0.65±0.051)及(0.79±0.066),组间比较有显著性差异(F=11.85,P<0.001)。与空白组、antagomir control组相比,antagomir组细胞在24、48、72 h增殖能力显著降低(P<0.001)(图3A)。空白组细胞在G0/G1、S及G2/M期的比例分别为(48.56±5.78)、(27.44±3.26)、(24.0±3.09);antagomir control组细胞在G0/G1、S及G2/M期的比例分别为(50.0±6.44)、(26.18±3.97)、(23.82±2.60);antagomir组细胞在G0/G1、S及G2/M期的比例分别为(61.23±7.48)、(16.68±2.05)、(22.09±3.72),组间比较差异有显著性(F=5.91,P=0.003)。与空白组及antagomir control组相比,antagomir组细胞中G0/G1期比例增加,而S期细胞比例减少(P<0.001)(图3B)。
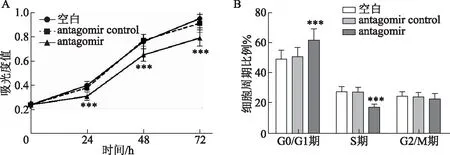
A:转染后KGN在不同时间段增殖情况(MTT法);B:转染后KGN细胞周期的变化与空白组及antagomir control组比较,***P<0.001
五、miR-9-5p靶基因的预测验证
采用TargetScan Human 7.2数据库预测miR-9-5p的靶基因,发现AR mRNA 3’-UTR中“ACCAAAG”序列与miR-9-5p中“UGGUUUC”种子序列完全互补配对,提示AR可能为miR-9-5p靶基因(图4A)。荧光素酶报告基因实验结果显示,当转染重组载体AR-wt后,空白、antagomir control及antagomir组相对荧光素酶活性分别为(1.0±0.18)、(1.13±0.20)、(3.65±0.69),组间比较有显著性差异(F=31.60,P<0.001)。与空白及antagomir control组相比,antagomir组中相对荧光素酶活性升高(P<0.001)(图4B)。
当转染重组载体AR-mut后,空白、antagomir control及antagomir组相对荧光素酶活性分别为(1.0±0.11)、(1.04±0.15)、(0.95±0.23),3组比较无显著性差异(F=1.78,P=0.52)(图4B)。WB结果显示,空白、antagomir control及antagomir组细胞中AR蛋白的表达水平分别为(1.0±0.13)、(0.92±0.08)、(6.44±0.71),3组比较有显著性差异(F=43.41,P<0.001)。与空白及antagomir control组相比,antagomir组细胞中AR蛋白表达水平显著升高(P<0.001)(图4C)。

A:AR mRNA 3’-UTR与miR-9-5p的结合位点预测;B:荧光素酶报告基因实验结果;C:WB分析AR蛋白的表达水平变化。与空白及antagomir control组比较,***P<0.001
讨 论
PCOS是一种代谢与内分泌异常疾病,是女性不育的重要原因之一[1]。近几十年来,尽管研究者做了大量关于PCOS的相关探究,但该病发生的确切原因尚不清楚。由于雌激素对子宫内膜组织的长期刺激,PCOS患者可增加肿瘤的患病风险[16]。因此完全有必要系统地探索PCOS的发病机理,并为其治疗提供新的方案。miRNAs是一种小分子RNA,在进化中高度保守,参与人体的正常生长、代谢和发育,在多种生理过程中也起着关键作用[6]。近年来研究发现,miRNAs在多种疾病状态下异常表达,并被认为是疾病的重要治疗靶点[17]。目前,已发现许多miRNAs在PCOS中表达上调或下调,并参与PCOS的病理形成过程[18]。例如,miR-324在PCOS患者卵巢组织和KGN中表达显著下调,过表达miR-324通过诱导凋亡而抑制KGN细胞活力[19]。低表达的miR-16在PCOS中促进颗粒细胞增殖并抑制凋亡,miR-125b亦可调节PCOS中KGN增殖[20]。另一项研究报道,miR-483在PCOS患者中表达下调并降低KGN增殖[21]。本研究评估了患有PCOS血清中miR-9-5p的表达水平,特别是矫正了患者的年龄和BMI,并发现miR-9-5p在PCOS患者血清中表达上调。更为重要的是,我们发现干扰miR-9-5p通过抑制细胞周期G1到S期的转变而抑制KGN增殖,提示miR-9-5p具有促进KGN增殖的作用。
在人类基因组中,miR-9从三个独立的基因组位点转录分别映射到染色体1q22(miR-9-1)、5q14.3(miR-9-2)和15q26.1(miR-9-3),这些转录本最终产生了功能成熟的miR-9-5p。越来越多的证据表明,miR-9-5p通过调控细胞增殖而影响肿瘤的发生发展[22]。此外,Wang等[23]发现血清miR-9-5p表达与细胞因子和趋化因子水平显著相关,可作为类风湿关节炎的无创性生物标志物。Ylmaz等[24]报道血清中miR-9-5p表达下调与阿尔茨海默氏病患病风险增加显著相关。Sørensen等[25]发现脑脊液中miR-9-5p可能是新的急性缺血性脑卒中诊断标志物。近年来,研究者亦发现一些miRNAs可作为新的诊断PCOS的分子标志物。Jiang等[26]发现血清miR-21可能提示PCOS进展,并可以作为新型诊断PCOS的无创性生物标志物。Song等[27]证实血清miR-6767-5p是新型诊断PCOS的分子生物学标志物,并且可能参与PCOS代谢。本研究采用ROC曲线发现血清miR-9-5p表达对PCOS的诊断具有较高的特异度及敏感度,提示miR-9-5p可能是一种新的PCOS诊断标志物。正如前面报道的一样,本研究不仅证实了miR-9-5p在PCOS中异常表达,并为PCOS诊断标志物提供了新的成员。
越来越多的报告表明,miRNAs可以与靶基因的3′-UTR结合并在转录后水平上调节基因表达。由于雄激素作用通过AR介导,因此AR介导的作用与PCOS的发生密切相关。动物模型研究显示,AR的全身治疗可诱发PCOS样临床特征;而使用AR拮抗剂氟他胺治疗可恢复某些PCOS患者的正常排卵,并在PCOS小鼠模型中挽救无怀孕和类似焦虑的行为[28]。此外,AR信号缺失可保护雌性小鼠免于产前高雄激素血症引起的PCOS[29]。据报道,AR是前列腺癌和膀胱癌中miR-381[30]和miR-449a[31]的直接靶标。此外,越来越多的研究表明,AR在卵巢KGN异常增殖中起着重要作用[32]。与上述结果一致,我们的研究进一步证明AR是KGN细胞中miR-9-5p的直接靶标,miR-9-5p可直接与AR mRNA 3’-UTR互补结合而降低KGN中AR蛋白的表达水平。该结果表明,miR-9-5p通过直接调控AR而促进KGN增殖进而影响PCOS的发生发展。
综上所述,本研究发现miR-9-5p在PCOS患者血清中表达上调,推测可能是一种新的PCOS诊断标志物。在机制上,miR-9-5p通过直接调控AR而促进KGN增殖。
