Fisetin对缺血再灌注肝脏氧化应激性损伤的保护作用*
2021-03-15李泽信王建国
李泽信,王 霄,王 迎,张 妤,李 荣,王建国
(1.新乡医学院第一附属医院肝胆胰外科,河南 卫辉 453100; 2.新乡医学院药学院,河南 新乡 453003;3.安阳市人民医院神经内科,河南 安阳 455000; 4.新乡医学院护理学院,河南 新乡 453003)
肝脏缺血再灌注(ischemia/reperfusion,I/R)损伤是肝脏手术、肝移植术和出血性休克的常见并发症[1]。既往研究[2]证明,氧化应激性损伤在I/R损伤病理过程中发挥着至关重要的作用。I/R肝脏于再灌注后肝组织中产生大量活性氧自由基(reactive oxygen species,ROS),可直接导致肝脏组织氧化应激性损伤和肝衰竭[3]。因此,为防治肝脏I/R损伤,降低肝脏手术风险,寻找一种安全、高效的药物或治疗靶点具有十分重要的意义。3,3′4′7-四羟基黄酮(Fisetin)为广泛存在于多种水果、蔬菜和植物中的一种黄酮类化合物,在多种慢性疾病和肿瘤治疗中效果显著[4-5]。有研究[6]发现,Fisetin作为抗氧化剂在细胞体外培养状态下,能够有效降低肝细胞氧化应激性损伤,但Fisetin对I/R肝脏氧化应激性损伤是否同样具有保护作用尚未见文献报道。本研究通过小鼠肝脏I/R损伤模型探讨Fisetin对肝脏氧化应激指标的影响,并初步探讨了Fisetin对I/R肝脏氧化应激性损伤的保护作用。
1 材料与方法
1.1 材料 选取6~8周龄雄性C57BL/6小鼠18只,体质量为20~25 g,由河南省实验动物中心提供[许可证号:SCXK(豫)2010-0002]。给予适应性喂养,昼夜各光照12 h,温度为(25±1)℃,相对湿度为45%~55%,所有大鼠自由饮水和进食。动物处置符合动物伦理学标准。18只小鼠随机分为Sham组、I/R组及I/R+Fisetin组,各6只。
1.2 方法
1.2.1 构建小鼠肝脏I/R损伤模型 缺血前1 h,I/R+Fisetin组小鼠经腹腔注射Fisetin 50 mg·kg-1(Sigma公司),Sham组和I/R组则注射等体积的二甲亚砜(dimethyl sulfoxide,DMSO)。给药1 h后:I/R组、I/R+Fisetin组麻醉后仰卧固定于37 ℃恒温的小动物加热垫上,参照文献[7]介绍的方法制作小鼠肝脏I/R损伤模型:常规消毒后上腹部正中切口,逐层打开腹壁入腹腔,充分暴露肝脏区,分离肝左叶和中叶的门静脉及肝动脉,并用血管夹夹闭以阻断血流,使70%肝脏缺血,当被夹闭的肝脏组织部分颜色变浅时即肝血管阻断成功,血管夹夹闭腹腔后,小鼠置于37 ℃孵育箱内,血流阻断1 h后,打开腹腔并松开血管夹,使肝脏进行再灌注,逐层缝合关闭腹腔。Sham组:单纯开腹并游离肝门,不进行I/R处理和腹腔注射Fisetin。再灌注6 h后再次麻醉小鼠,获取下腔静脉血液样本及肝脏,离心分离出血清置于-80 ℃冰箱中保存,用于生化检测;取部分肝脏组织,体积分数10%甲醛溶液固定制备石蜡切片;另取部分肝脏组织用于检测氧化应激相关指标。
1.2.2 观察指标 ①小鼠肝脏功能的检测:谷丙转氨酶(ALT/GPT)试剂盒和谷草转氨酶(AST/GOT)试剂盒均购自南京建成生物工程研究所。严格按照试剂盒说明检测Sham组、I/R组和I/R+Fisetin组大鼠血清中谷丙转氨酶(ALT)和谷草转氨酶(AST)的含量。②苏木精—伊红(HE)染色观察肝脏组织病理学变化:3组肝脏组织取材,质量浓度10%甲醛溶液固定,采用乙醇梯度(体积分数80%、90%、95%、100%)脱水,二甲苯透明,制作组织石蜡切片;然后依次脱蜡、水化,首先苏木精染色15 min,盐酸乙醇溶液分化5 s后氨水溶液返蓝,再用伊红染色5 min,最后脱水、透明、封片,在显微镜下拍照保存图像,采用Image J图像分析软件计算组织坏死面积所占的百分比。③小鼠肝脏细胞ROS水平检测:各组肝脏组织放入预冷的组织培养液中,清洗血迹及污染物。去除组织块中的坏死成分、纤维、脂肪及血管;用眼科剪将组织块剪成1 mm3左右小块,放在预冷的组织培养液中进行漂洗,洗去剪碎的细胞碎片;将300目尼龙网扎在烧杯上,将剪碎的组织放在网上,以眼科镊或刮刀轻搓组织块,边搓边以PBS冲洗,直至将组织搓完;收集细胞悬液,500 g离心10 min去上清,并用PBS洗2次,并重悬制备单细胞悬液,细胞计数总数不少于106个。ROS测定严格按照试剂盒(南京建成生物工程研究所)说明进行,加入10 μm 2′,7′-二氯荧光黄双乙酸盐(2,7-dichlorodi-hydrofluorescein diacetate,DCFH-DA)于细胞悬液,37 ℃孵育30 min;收集单细胞悬液,1 000 g离心10 min,弃上清,并用PBS重悬。荧光酶标仪检测,激发光为490 nm,发射光为530 nm。测定结果以荧光强度/mgprot表示。④小鼠肝脏组织丙二醛(MDA)含量、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)活性检测:MDA试剂盒、GSH-Px试剂盒和SOD测定试剂盒均购自南京建成生物工程研究所。称取肝组织约0.5 g,按体质量(g)∶体积(mL)=1∶9的比例加入9倍的生理盐水,冰浴条件下机械匀浆,制备成10%的匀浆上清液后按照相应试剂盒说明进行检测。

2 结果
2.1 Fisetin对肝脏ALT、AST水平的影响 小鼠肝脏再灌注6 h后,I/R组与Sham组比较,血清中直接反映肝细胞膜功能的ALT水平升高,差异有统计学意义(t=7.69,P<0.001),血清中直接反映线粒体膜功能的AST水平升高,差异有统计学意义(t=7.67,P<0.001);I/R+Fisetin组小鼠于再灌注6 h后血清ALT、AST水平高于Sham组,但与 I/R组比较,血清ALT、AST水平下降,差异有统计学意义(t=4.59、5.11,P<0.001)。见表1。

表1 3组小鼠肝脏功能指标比较
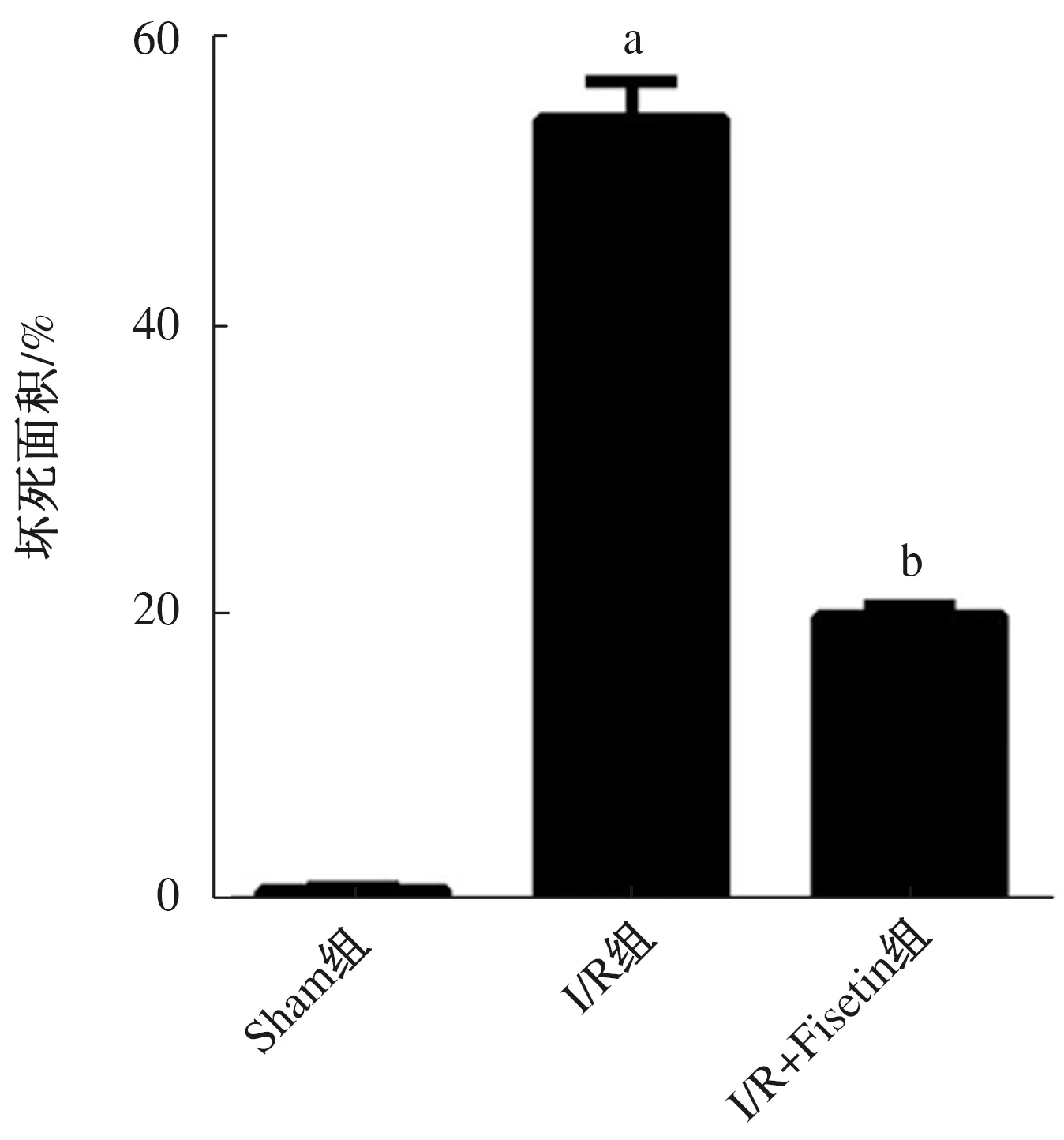
2.2 Fisetin对肝脏病理学的影响 小鼠肝脏HE结果显示,Sham组小鼠肝脏组织学形态正常,无明显病理学改变(图1A);I/R组小鼠肝组织出现静脉充血、肝细胞水肿和灶状坏死,大量中性粒细胞浸润,部分细胞核固缩染色加深(图1B);I/R+Fisetin组小鼠肝细胞水肿和静脉充血明显减轻,中性粒细胞浸润明显减少,肝组织坏死面积明显缩小(图1C)。

图1 3组小鼠肝脏再灌注6 h后肝组织染色(HE×200)
2.3 Fisetin对肝脏ROS水平和MDA含量的影响
小鼠I/R组肝脏再灌注6 h后肝脏组织ROS相对水平是Sham组的4.05倍,差异有统计学意义(t=-7.76,P<0.001);I/R+Fisetin组小鼠再灌注6 h后肝组织中ROS相对水平是Sham对照组的1.96倍,虽然ROS水平仍高于Sham组,但I/R+Fisetin组小鼠肝脏ROS相对水平较单纯I/R组下降,差异有统计学意义(t=-4.93,P<0.001)。与小鼠I/R组比较,I/R+Fisetin组小鼠肝脏再灌注6 h后MDA含量下降,差异有统计学意义(t=4.67,P<0.001)。见图2、表2。
注:a与Sham组比较,P<0.001;b与I/R组比较,P<0.001。

表2 3组小鼠肝组织氧化应激指标比较
2.4 Fisetin对肝脏SOD和GSH-Px活性的影响 I/R组小鼠肝脏再灌注6 h后肝脏组织中SOD和GSH-Px活性低于Sham组,差异有统计学意义(t=6.86,P<0.001);腹腔注射Fisetin 50 mg·kg-1的小鼠肝脏中SOD和GSH-Px活性虽然没有恢复至Sham组水平,但与小鼠I/R组比较,I/R+Fisetin组小鼠肝脏再灌注6 h后肝脏组织中SOD和GSH-Px活性显著升高,差异有统计学意义(t=5.80、-5.84,P<0.001)。见表3。

表3 3组小鼠肝组织中抗氧化指标比较
3 讨论
Fisetin是一种纯天然的膳食类黄酮化合物,又名漆黄素、非瑟酮等,主要从漆木科植物中提取。有研究[8]认为,Fisetin具有强大的抗氧化、抗炎、抗肿瘤、降糖、神经保护以及心血管等多脏器保护作用。本研究发现,小鼠肝脏再灌注6 h后I/R组与Sham组比较,反映肝细胞膜和线粒体膜损伤的ALT和AST水平均有升高;与 I/R组比较,I/R+Fisetin组小鼠于再灌注6 h后血清ALT、AST水平明显下降。这说明了小鼠应用Fisetin后I/R肝脏细胞功能得到了有效保护。既往研究[9]发现,中性粒细胞在器官再灌注组织中大量浸润释放氧自由基和炎症介质是导致I/R损伤的重要途径。本研究发现,I/R组小鼠肝组织出现静脉充血、肝细胞水肿和灶状坏死,大量中性粒细胞浸润,部分细胞核固缩染色加深;然而,I/R+Fisetin组小鼠肝细胞水肿和静脉充血明显减轻,中性粒细胞浸润明显减少,肝组织坏死面积明显缩小,提示Fisetin对小鼠I/R肝脏结构与功能的保护作用可能与中性粒细胞浸润减少、ROS水平降低有关。
ROS主要来自细胞膜、线粒体电子传递链和胞质内质网中的烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶复合物,是含氧化学反应分子, 包括单线态氧、超氧阴离子、羟基自由基和过氧化氢等;ROS是氧化应激的直接导火索,其水平急剧增加可导致细胞膜性结构脂质过氧化、膜蛋白氧化,造成氧化应激损伤[10]。器官组织中ROS水平高低是肝脏细胞氧化应激程度的标志物,近年来对组织器官氧化应激性损伤与保护的研究成为热点[11]。张妍薇等[12]研究发现,Fisetin能抑制H2O2环境下细胞内ROS的产生,从而在抗氧化应激性损伤过程中发挥细胞保护作用,这与本研究对Fisetin进行的体内研究结果基本一致。本研究发现,在小鼠I/R组肝脏再灌注6 h后肝组织ROS相对水平是Sham组的4.05倍,即肝脏I/R诱发氧自由基大量释放;但腹腔注射Fisetin(50 mg·kg-1)的I/R小鼠肝脏ROS相对水平下降至单纯I/R组的0.48倍,说明I/R+Fisetin组小鼠再灌注6 h后肝组织中ROS相对水平被显著抑制。本研究通过小鼠肝脏I/R损伤模型发现,Fisetin在体内通过抑制ROS的产生对I/R肝脏氧化应激性损伤同样具有保护作用。MDA是ROS氧化应激过程中脂质过氧化反应的终产物,MDA含量高低是反映肝细胞膜和线粒体膜等细胞膜性结构损伤程度的标志。为进一步验证肝细胞膜、细胞器膜结构和功能损伤的一致性,本研究在检测反映肝脏功能的ALT、AST水平高低的同时,也对小鼠肝组织中MDA含量进行了检测,结果发现Sham组、I/R组和I/R+Fisetin组肝脏再灌注6 h后肝组织MDA含量分别为(3.040±0.693)、(12.781±3.086)和(6.287±1.444)nmol·mgprot-1;与小鼠I/R组比较,腹腔注射Fisetin(50 mg·kg-1)的I/R肝脏组织MDA含量于小鼠肝脏再灌注6 h后显著下降,说明Fisetin可能是通过降低I/R肝脏内ROS水平和MDA含量来减轻肝脏I/R损伤的。
机体生理状态下体内的SOD、GSH-Px等抗氧化酶系统与ROS、MDA氧化应激系统处于动态平衡状态[13]。有研究[14]证明,SOD活性增加在心肌缺血再灌注损伤保护中起着至关重要的作用。SOD作为抗氧化酶,能催化氧自由基歧化反应或通过SOD催化产生过氧化氢,部分过氧化氢可还原为羟自由基或者全部还原为水,最终清除自由基,保护细胞免受损伤;GSH-Px是肝脏中合成硫醇和三肽分子的催化酶,主要解毒脂质过氧化产物MDA,维持膜蛋白质巯基状态,修复细胞膜性结构[15]。在I/R肝脏中,为了明确Fisetin抑制ROS水平升高和MDA含量增加是否也与SOD和GSH-Px有关。本研究检测发现,3组肝脏再灌注6 h后小鼠肝组织SOD活性Sham组最高,其活性反映机体清除氧自由基的能力;GSH-Px活性是生物体内一种很重要的抗氧化剂和自由基清除剂,对维持细胞膜的结构和功能具有重要意义;小鼠I/R组肝脏再灌注6 h后小鼠肝脏组织中SOD和GSH-Px活性低于Sham组,说明肝细胞损伤状态下SOD和GSH-Px活性均被抑制;腹腔注射Fisetin(50 mg·kg-1)的I/R小鼠肝脏中SOD和GSH-Px活性虽然没有恢复到Sham组水平,但与小鼠I/R组比较,I/R+Fisetin组小鼠肝脏再灌注6 h后肝组织中SOD和GSH-Px活性显著升高,这说明Fisetin能够通过诱导I/R肝脏组织中SOD和GSH-Px活性增加来减轻肝脏的氧化应激反应,进而减轻I/R肝脏氧化应激性损伤。
综上所述,本研究结果证明,Fisetin能够有效改善肝脏I/R损伤的发生,其机制可能与Fisetin诱导SOD和GSH-Px活性升高有关,分别通过抑制ROS水平缓解氧化应激程度和降低MDA含量修复细胞膜性结构,从而对I/R肝脏氧化应激性损伤起到有效的保护作用。
