治疗性单克隆抗体的药物监测:LC-MS/MS技术的应用进展
2021-03-13郭宏丽胡雅慧
夏 颖,郭宏丽,胡雅慧,陈 峰
(南京医科大学附属儿童医院药学部药学研究中心,南京210008)
近年来,治疗性单克隆抗体(monoclonal antibody,mAb)在临床中应用越来越广泛,其用于多种疾病的治疗,包括各种肿瘤、免疫疾病、炎症性疾病等[1-5]。但是,mAbs的药代动力学(PK)和药效动力学(PD)过程非常复杂,具有非线性动力学特征、个体暴露差异大、以非特异性途径消除、特异性靶标介导以及药物处置个体差异大[6]。因此,需要对mAbs 进行治疗药物监测(therapeutic drug monitoring,TDM),通过测定患者体内的药物暴露、药理标志物或药效指标,实施个体化药物治疗[7-9]。
mAbs 的传统生物分析方法包括:液相放射免疫测定、固相酶联免疫吸附测定、报告基因测定、酶免疫测定、均相迁移测定等[10-11],以酶联免疫法(enzyme linked immunosorbent assay,ELISA)最为常用[7],该方法简单快速、可用于高通量分析,但其存在定量范围较窄(约2个数量级)、方法开发时间长、存在交叉免疫、非特异性结合、专属性差、仅可测定抗体的游离形式等缺点,限制了其应用[12-13]。近年来,LC-MS/MS 法在大分子药物领域的应用引起了广泛的关注,与传统ELISA 相比,其定量范围更宽(3~5个数量级)、选择性高、方法开发时间短、结果更可靠[12,14]。然而,LC-MS/MS 作为小分子药物定量的“金标准”,在mAbs 的检测中存在难点,如mAbs 相对分子质量约10~15 kD,内源性干扰蛋白含量达60~80 g/L[12],因而其样品前处理更为复杂,目前仍难以确定建立LC-MS/MS 的最佳策略。本文综述了近年来LC-MS/MS 测定mAbs 的分析方法、分析过程、常见问题及解决办法,为临床mAbs的TDM提供技术指导。
1 基于LC-MS/MS定量分析mAbs的方法分类
LC-MS/MS 定量分析mAbs 主要有两种途径:(1)“自下而上”(bottom-up approach)分析,即把mAbs 酶解成更小的肽,然后选取一个或多个特征肽进行LC-MS/MS 分析。(2)“自上而下”(top-down approach)分析,即直接用LC-MS/MS 分析完整的mAbs,但此方法受分析物大小限制,常适用于相对分子质量小于10~15 kD的mAbs[12]。
“自下而上”的分析检测mAbs 某一肽段而非整个蛋白质,所以检测灵敏度高,选择性好,应用广泛。“自上而下”的分析可减少样品制备步骤,提高分析通量。然而,由于全扫描光谱中蛋白质电荷包膜、加合物形成和色谱分离的复杂性,使其难以获得足够的灵敏度[15-16]。因此,该方法的生物分析应用较少。故本文将介绍LC-MS/MS“自下而上”分析的工作流程及相关问题。
2 基于LC-MS/MS定量分析mAbs的方法开发
2.1 特征肽(signature peptide)的选择
方法开发的关键是选择治疗性mAbs 的特征肽,常选择mAbs 的互补决定区(CDR)序列的片段作为特征肽,选择标准为:(1)特征肽应具有唯一性(拥有唯一的序列)和代表性;(2)肽序列长度为6~20 个氨基酸,若氨基酸太少检测易受到干扰,而氨基酸太多会超出检测限;(3)在整个分析过程中稳定,避免有反应性残基和易被修饰的氨基酸,如甲硫氨酸、天冬酰胺、色氨酸和谷氨酰胺;(4)尽量不含连续或交替出现的精氨酸、赖氨酸,以及脯氨酸-精氨酸或脯氨酸-赖氨酸序列,以避免酶切不完全;(5)特征肽在MS/MS分析中易于离子化和解离,质谱响应优[14,17-18]。
目前,特征肽的确定方法主要包括:(1)从已有实验数据中寻找特征肽;(2)根据相关数据库预测特征肽,并选取可信度高的肽段进行进一步比对,常用工具软件包括Peptide Mass,Protein BLAST,Peptide Atlas,Skyline,UniProt/Swissprot 等[14,18]。该法应用较多,如Peng等[19]先通过Peptide Mass 软件预测了英夫利昔单抗CDR 区的肽段,然后用BLAST 软件对比了人血清蛋白和英夫利昔单抗的氨基酸序列,并排除了血清中存在的肽段。通过理论分析对比,从而选出候选肽段。为避免后续方法开发出现其他问题,因此建议选择两个或多个特征肽进行MS/MS 定量[14]。特别是采用选择性反应监测模式(SRM)进行测定时,质量分辨率不够高,可能会存在离子通道的干扰,样品分析中若出现较明显的信号变化,提示可能存在干扰[20]。部分文献中抗体药物进行LC-MS/MS 分析时选用的特征肽见表1。
2.2 样品前处理
mAbs 基质样品复杂,混有大量内源性蛋白质和小分子化合物,因此需对其进行样品前处理,以提高灵敏度、选择性和准确性。
2.2.1 直接酶解法 该法选用一定量的胰蛋白酶直接对mAbs 进行酶切,与其他方法相比,该法操作简单,成本更低。因为精氨酸和赖氨酸在mAbs 中出现频率较高,胰蛋白酶会切割精氨酸和赖氨酸后的肽键,故常选用胰蛋白酶作为蛋白水解酶[14]。通常,需考察缓冲液种类、加入酶量、孵育温度、孵育时间等对酶切效率的影响;并可考虑是否需要微波、高温、有机溶剂或振摇等加速反应以提高酶切效率,Mouchahoir 等[23]借助LC-MS/MS方法建立NISTmAb 的肽谱图时对上述条件进行了详细的考察,从而获得了最佳条件。另外,还需优化胰蛋白酶与目标蛋白的加入比例,Chiu 等[24]在分析贝伐单抗时,考察了胰蛋白酶与目标蛋白加入比例1∶10 到1∶100 之间的酶切效率,发现其比例1∶50时酶切效率最高。该方法包括溶液中酶解法和蛋白球酶解法。

表1 LC-MS/MS定量分析单克隆抗体的特征肽
溶液中酶解法,是通过加热或添加表面活性剂[如十二烷基硫酸钠(SDS)或RapiGest,等]使蛋白质变性,然后用二硫苏糖醇(DTT)或三(2-羧乙基)膦等还原二硫键,再加入碘乙酰胺(IAA)等烷化剂使还原后的巯基烷基化,形成稳定硫化物,以阻止二硫键的恢复,最后加入胰蛋白酶进行酶切处理,用甲酸终止酶切反应,得到所需肽段。
蛋白球酶解法,是用甲醇、乙腈、饱和硫酸铵溶液等将待测样品进行蛋白沉淀,离心去除上清液后用碳酸氢铵溶液复溶蛋白球,得到均匀的蛋白悬浮液,直接加入胰蛋白酶酶解[21]或加入三氟乙醇(TFE)、DDT、IAA 等进一步变性后,加入胰蛋白酶酶解,最后用甲酸终止反应[13]。Ouyang 等[25]在定量分析蛋白1(候选生物大分子药物)的实验中,采用蛋白球酶解法进行样品前处理,并将其与溶液中酶解法进行比较,发现蛋白球酶解法处理后待测物的响应比后一种方法的响应高15 倍,基质效应也得到了改善,酶解效率更高。
总体而言,蛋白球酶解法可有效地去除一些水溶性蛋白、磷脂、盐类等,与溶液中酶解法相比,提取后的样品更干净,干扰更少[26]。故蛋白球酶解法相对更优,应用也越来越广。
2.2.2 酶解结合固相萃取法(SPE) 该方法包括样品经SPE 柱后进行酶解和酶解后的样品经过SPE 柱两种,该类方法可实现样品的进一步纯化,是一种更具选择性、灵敏度更高的样品净化方式,可以除去绝大部分干扰物质,降低杂质信号[26]。常用的SPE 柱有Oasis MCX 96 孔板、Bond Elit C18SPE 柱等[27]。对于体积排阻SPE,利用分子排阻原理,排除无法进入SPE 孔隙的大分子蛋白。例如,40~80 Å 孔径的SPE 柱可以大致去除相对分子质量大于20 kD 的蛋白质。而离子交换SPE 与反相色谱正交分离模式联用时,通常有更高的选择性净化作用[12]。Shibata[28]等在蛋白酶解后进一步用Oasis HLB 的SPE 柱纯化样品,成功定量人血清中西妥昔单抗浓度并用于肿瘤患者的药代动力学研究。
2.2.3 高丰度蛋白质的去除 由于生物样品的组成很复杂,其内源性蛋白的总浓度高达60~80 mg/mL。故简单的酶解处理不能满足低丰度蛋白的检测灵敏度,即需要进行富集操作,以减少干扰并提高mAbs 分析的灵敏度,其中一种富集方法是去除高丰度蛋白。白蛋白是含量最丰富的蛋白质,质量浓度为35~50 mg/mL,故常利用化学亲和力或免疫亲和力,采用白蛋白消耗试剂盒去除血清中大量白蛋白或其他高丰度蛋白[12]。Echan等[29]用白蛋白试剂盒处理后,结果显示蛋白含量降低了85%。Liu[30]等用异丙醇和1.0%三氯乙酸的混合物去除血浆中白蛋白,结果表明该方法可去除95%的白蛋白,且目标蛋白几乎无损耗,该方法简单稳健,成功用于测定猴血清中靶标蛋白BMS-C的浓度。
2.2.4 免疫亲和捕获法 mAbs 样品前处理常需要用特异性或非特异性方法富集目标分析物。其中,免疫捕获富集是最常用的方法,其通过特异性抗体等捕获目标蛋白或其特征肽,然后洗脱除去未被捕获的杂质,再将待测物与捕获剂分离,洗脱收集待测物后进行酶切处理。使用的捕获剂包括抗独特型抗体、目标mAbs 本身的配体蛋白、蛋白A、蛋白G、抗人Fc抗体等,一般前两种用于具有抗原结合位点的mAbs 的亲和纯化,可定量分析游离药物(非配体形式)的浓度;而后几种广泛用于具有免疫球蛋白(Ig)G Fc 区域的mAbs 的亲和纯化,可定量测定总药物浓度[31-33]。已有大量文献报道通过蛋白A或蛋白G特异性结合IgG 的Fc区域,将蛋白A、G 偶联到磁珠上形成磁珠复合体或采用蛋白A、G 树脂,高效地进行目标蛋白的捕获。Chiu等[33]开发了一种普遍适用于IgG 的mAbs药物的亲和纯化方法,其采用蛋白G 磁珠捕获并分离出目标蛋白,去除了其他高浓度的干扰蛋白,大大降低了基质复杂性,提高了选择性。同时,纯化步骤会减少胰蛋白酶的用量,从而节约成本。
Ig 是血清中最丰富的蛋白质之一[34-35],这些内源性Ig 在上述纯化过程中会与治疗性mAbs 一起被提取,在质谱分析时产生干扰并竞争性抑制电离。此外,在免疫亲和作用中,内源性Ig 将与治疗性mAbs 竞争结合位点,从而可能降低回收率。Amrani 等[31]开发了一种免疫亲和纯化方法,弥补了此缺点。其用涂有链霉亲和素的96孔板捕获生物素化的肿瘤坏死因子-α(b-TNF-α),从而选择性提取人血清中英夫利昔单抗的活性形式。Jourdil等[36]也用类似的免疫亲和捕获方法成功定量分析了人血浆中英夫利昔单抗的浓度。
2.3 内标的选择
选择内标对于LC-MS/MS 分析至关重要,其可有效地校正样本处理分析过程中的偏差及基质效应,从而确保分析方法的稳健性和检测结果的可靠性。
2.3.1 稳定同位素标记的特征肽(SIL 肽) SIL肽是目前最常用的一种内标,通常在酶切处理后加入。这种方法非常直接,能有效校正酶切后及LC-MS/MS 分析过程中的偏差,且SIL 肽常易于以低成本合成[37]。但是,这类内标的主要缺点之一是不能校正样品处理过程中一些关键步骤如提取、酶切等引入的偏差,因此,可能会导致定量结果的偏倚[38]。
2.3.2 稳定同位素标记的延伸特征肽(延伸SIL肽) 延伸SIL 肽即在特征肽两端的酶切位点加上额外的氨基酸。在样品酶切前加入延伸SIL 肽内标,该类内标可随样品一起被胰蛋白酶酶切,从而在一定程度上校正酶切效率的变化[39]。当然,由于这类内标是单纯的肽段,酶切位点单一,故其比治疗性mAbs 更易被酶切。所以,严格来说,这类内标的酶切效率与治疗性mAbs 的也不等同。且对于免疫亲和捕获法,捕获剂如蛋白G 无法捕获延伸SIL肽,故无法校正亲和捕获过程[24]。
2.3.3 稳定同位素标记蛋白(SIL 蛋白) SIL 蛋白作为内标,通常在样品处理开始时添加,甚至在样品采集期间添加,从而很好地监测酶切效率、样品处理全过程和LC-MS/MS 分析结果。这类内标可以作为金标准来确保方法的准确性和精密度。但缺点是不易获得,要制备完全相同的SIL 蛋白是相当困难的,因为即使是培养条件的微小差异也可能导致糖链或氨基酸修饰的显著差异[12]。
2.3.4 蛋白质类似物 当难以获得SIL 蛋白内标时,可考虑选用蛋白质类似物为内标。蛋白质类似物内标应尽可能与治疗性mAbs 相似,以更好地校正目标蛋白的分析偏差。例如,Willrich 等[13]选用马的IgG 作为内标,与SIL 蛋白相比,选用的IgG与治疗性mAb 有相似的三级结构,是种属特异性肽并大大降低了成本,使用马IgG 内标有助于克服胰蛋白酶酶切效率的变化,提高了批间精密度。
另外,Damen 等[40]用两种内标校正方法进行3种IgG 的mAbs药物的同时分析:SIL肽内标可以校准样品前处理过程及LC-MS/MS 分析的偏差,但每个待测物需要各自的SIL 肽内标;而柱后输注内标(PCI-IS)可作为通用内标,校正基质效应,但无法校正前处理过程的偏差。故选用贝伐单抗的延伸SIL 肽和PCI-IS 两种内标,从而有效地提高了定量的准确度和精密度。表2 总结了近年来部分文献中选用的内标。
3 基于LC-MS/MS 定量分析mAbs 前处理的常见问题
3.1 多电荷的影响
与小分子化合物不同,在ESI 条件下,蛋白质或肽会形成多电荷离子,从而使高分子质量的蛋白或肽在质谱有限的质荷比扫描范围内能被检测到。但是同一蛋白或肽在不同的ESI 条件下电离会产生电荷分布不同的多电荷离子峰簇,其丰度和稳定性存在较大差异,从而降低了质谱检测的分辨率和选择性。所以对于LC-MS/MS 分析蛋白类药物,需特别注意要选择灵敏度高的母离子。此外,离子源参数特别是去簇电压(DP)、流动相的组成、pH、基质等对其质谱响应的影响显著。Hahne等[43]通过实验发现,在流动相中加入一定量的二甲基亚砜(DMSO)能增加肽类的质谱响应。因此,在方法开发中需全面优化以上几个因素,从而建立灵敏度高、稳健的方法。有研究表明,带2 个电荷或3个电荷的母离子较常用,其质荷比在质谱较常用的检测范围内(400~1 000)[44]。
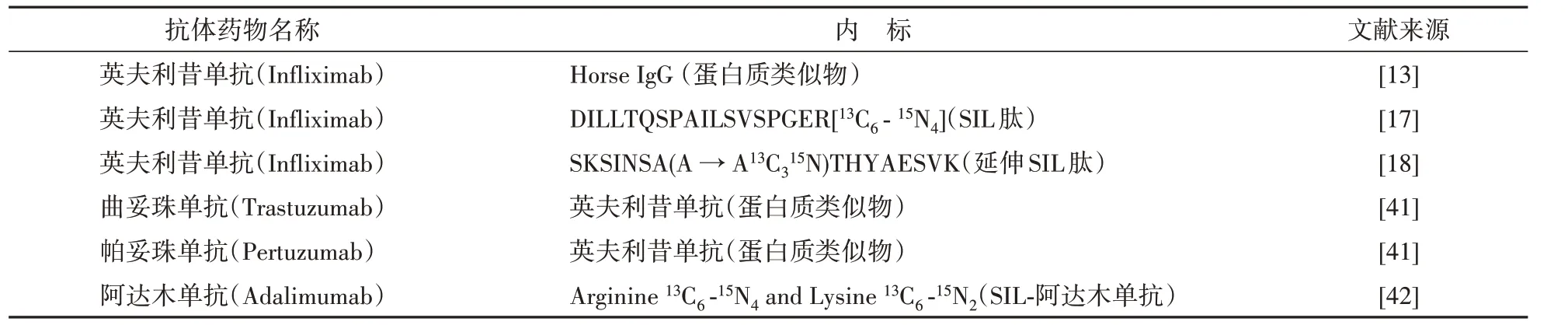
表2 LC-MS/MS定量分析单克隆抗体的内标
3.2 稳定性
稳定性是mAbs 定量分析的主要关注点。研究表明,样品储存条件影响蛋白质或肽的稳定性[45]。尤其是低浓度时,蛋白质或肽易受体内蛋白酶水解的影响。可以在样品处理的一个或多个环节加入蛋白酶抑制剂[46],且样品前处理应在冰上或4 ℃条件下处理,因为大多数蛋白酶在室温至37 ℃时活性最佳。
此外,某些氨基酸如蛋氨酸和半胱氨酸易发生氧化,因此,应尽量减少暴露在空气中的时间。因半胱氨酸易于形成分子内和分子间二硫键,常加入DTT 或2-巯基乙醇,以完全还原二硫键,然后用IAA或碘乙酸烷基化。
pH也影响mAbs的稳定性。在酸性条件下,某些氨基酸残基末端易发生裂解及脱酰胺作用等。因此,应尽可能在pH 近中性的缓冲液中处理并储存mAbs。还需注意的是,反复冻融、剧烈涡旋等会破坏蛋白质,样品处理过程应温和,储存过程中也应避免此类情况[12]。
3.3 吸 附
mAbs易吸附于容器壁、移液枪头、LC-MS系统管路等,导致各浓度水平回收率不平行、质谱响应降低等。一般,带正电的肽及蛋白易吸附于带负电的玻璃表面,而中性肽及蛋白由于疏水性相互作用,易吸附于疏水性的聚丙烯材料物上。然而,吸附不容易预测,仅在实验中表现出来[47]。根据这种非特异性吸附的原理及影响因素,可采取以下措施解决:(1)根据肽及蛋白的性质选择合适的容器;(2)在待测物溶液中加入置换剂,常用结构类似物或富含蛋白溶液(血浆、血清等)。如Peng等[19]在定量测定英夫利昔单抗时,其储备液以空白血清为溶剂配制;(3)在待测物溶液中加入有机溶剂、酸、盐或表面活性剂等,改善肽类溶解度,从而减少损失。Zhang 等[48]发现溶剂为50%乙腈水溶液时,肽类吸附最少,回收率相对较高。
3.4 特异性蛋白结合
LC-MS/MS 测定肽和蛋白的一个潜在问题是待测样品与蛋白特异性结合。随着生物药物的快速发展,一个值得关注的问题是抗药抗体(ADA)的形成,其产生于机体免疫系统的一种自身保护[45]。而ADA的存在除了可能导致生物制剂临床疗效丧失外,在LC-MS/MS 定量测定时也会导致结果有偏差,因此在样品处理时需将ADA和mAbs分开。Ji 等[49]在固相萃取前,用8 mol/L 盐酸胍变性猴血浆样品,使小分子蛋白药物与其ADA分离。
3.5 翻译后修饰(PTM)
PTM 的一些常见形式包括磷酸化、糖基化、泛素化、亚硝基化、甲基化、乙酰化、脂化和蛋白水解。因其会影响蛋白的特性,故在定量测定时必须考虑PTM。一般而言,当选择特征肽时,应排除含有潜在PTM 的序列。若要定量糖蛋白,可通过PNGase F 糖苷酶切去N 糖。根据研究目的不同,有时又需要以含PTM 的蛋白质作为目标蛋白,这给LC-MS/MS 定量方法的开发带来了很大的挑战,因为含有PTM 的特定序列可能不适合LC-MS/MS分析。总的来说,PTM 会影响LC-MS/MS 检测的准确性,应尽量避免[12]。
4 总结与展望
LC-MS/MS 在mAbs 分析研究中越来越受关注,与传统方法比较,其选择性好、重现性佳、方法稳健、结果准确可靠,是ELISA 等方法强有力的补充。然而,由于mAbs 的固有特征,LC-MS/MS 定量测定mAbs 面临着诸多挑战,其样品处理操作相对繁琐。相信随着LC-MS/MS 技术的发展,可以实现部分操作的自动化,仪器性能也会有更好地提高,从而将LC-MS/MS 技术广泛用于mAbs 的治疗药物监测,更好地发挥抗体药物的治疗作用。
