抗炎三肽KdPT对小鼠眼干燥症的治疗作用
2021-03-13许元生
王 华,许元生,宋 燕
(广州领晟医疗科技有限公司,广州510663)
眼干燥症是由于泪液的量或质或流体动力学异常引起的泪膜不稳定和(或)眼表损害,从而导致眼不适症状及视功能障碍的一类疾病。目前世界范围内眼干燥症发病率为5.5%~33.7%,我国眼干燥症的发病率为21%~30%[1]。
研究表明,炎症是眼干燥症发病的关键环节,抗炎已经成为治疗眼干燥症(特别是中重度眼干燥症)的重要手段[2-4]。目前治疗眼干燥症常用的抗炎药物主要有糖皮质激素类或环孢菌素A 滴眼液等,然而长期使用糖皮质激素有升高眼压[5]、存在诱发青光眼及白内障的潜在风险,而环孢素滴眼液则具有刺激性强的缺点[6],因此,开发新的安全有效的治疗眼干燥症的局部抗炎药物具有重要的临床意义。
KdPT(Lys-D-Pro-Thr)是一种衍生自α-促黑色素细胞激素(α-melanocyte-stimulating hormone,α-MSH)的抗炎三肽,具有多重抗炎活性。有文献报道,α-MSH 可以用于治疗眼干燥症和修复角膜损伤[7-9],但目前尚未有KdPT 对眼干燥症的治疗作用的报道,本研究通过建立苯扎氯铵诱导小鼠眼干燥症模型,考察了KdPT 对眼干燥症的治疗作用,为新型眼干燥症治疗药物的开发提供数据支持。
1 材 料
1.1 试 剂
KdPT(纯度大于98%,批号:C613160802-YJ1,深圳市健元医药科技有限公司);人工泪液滴眼液、荧光素钠滴眼液(中山大学附属眼科医院);泪液检测酚红棉线(天津晶明新技术开发有限公司);苯扎氯铵(批号:BCBX5919,美国Sigma 公司);其他试剂均为市售分析纯。
1.2 仪 器
兰羚KJ5D 裂隙灯(苏州康捷医疗股份有限公司);JB-P5 包埋机、JB-L5 冻台(武汉俊杰电子有限公司);RM2016 病理切片机(上海徕卡仪器有限公司);KD-P 组织摊片机(浙江科迪仪器设备有限公司);E100 显微镜、DS-U3 成像系统(日本尼康公司)。
1.3 动 物
SPF 级BALB/c 小鼠(7 周龄,15~17 g)120 只,雄性,购自中山大学药学院实验动物中心,实验动物合格证号为:44007200064321,实验动物使用许可证号:SYXK(粤)2010-0102,在温度20 ℃~25 ℃和湿度50%~70%进行12 h 光/暗循环饲养。所有动物实验均符合动物伦理委员会标准。
2 方 法
2.1 小鼠眼干燥症模型的构建及分组给药
SPF级BALB/c小鼠120 只,雄性,适应1周后,造模动物右眼滴入0.2%苯扎氯铵溶液5 μL,每天2 次,持续4 周,诱导小鼠蒸发过快型眼干燥症模型。正常对照组给予生理盐水,其他操作均相同。造模4周后进行荧光素钠染色,按荧光素钠染色评分随机分为6 组:正常对照组(以生理盐水造模)、模型对照组、KdPT 低、中、高剂量组、人工泪液组,每组10只动物,分别滴眼给予相应药物处理(正常对照组和模型对照组给予生理盐水,KdPT 低、中、高剂量组分别给予1、10、100 μg/mL 的KdPT,阳性对照组给予人工泪液),给药体积为每眼5 μL,每日2次。
2.2 角膜荧光素钠染色
分别于给药3、5、7、10、14 d 后在裂隙灯钴蓝光下观察并记录小鼠眼表形态,同时进行荧光素钠染色评分。荧光素钠染色方法为:吸取1%荧光素钠溶液5 μL 滴至小鼠眼表,并闭合眼睑使荧光素钠均匀涂布于角膜表面,90 s 后用生理盐水200 μL 冲洗3 次,棉签轻轻吸取眼睛周围液体后,用裂隙灯显微镜钴蓝光下观察角膜上皮荧光素钠染色情况。将眼表分为4个象限,并对每个象限进行评分,评分分为4 个等级:无染色为0 分;轻微的点状染色为0.5 分;弥漫的点状染色为1 分;覆盖少于1/3 角膜的弥漫染色为2 分;覆盖1/3 至2/3 角膜的弥漫染色为3 分;覆盖超过2/3 角膜的弥漫染色为4 分,4 个象限总分为12 分,得分越高表示眼干燥症越严重。
2.3 酚红棉线
给药治疗14 d 后,麻醉并固定小鼠,用显微结膜镊轻拉小鼠下眼睑暴露下结膜囊,将酚红棉线一端置于下睑内侧结膜囊内60 s后取出,测量被泪液浸湿的酚红棉线红色部分总长度。
2.4 组织病理分析
给药治疗14 d 后,将小鼠麻醉后处死,迅速取下包括上下眼睑在内的整个眼球,眼球固定液固定并染色,制作病理切片,光学显微镜下观察角膜组织的病理学变化。
2.5 统计分析
实验数据由GraphPad Prism 7.0 生物统计学软件进行统计学处理:计量数据以表示,采用Two-Way ANOVA 结合Dunnett′s 多重比较法进行分析;采用方差分析结合Dunnett′s 多重比较法进行分析;计数资料采用Kruskal-Wallis 秩和检验进行分析;采用One-Way ANOVA 结合Dunnett′s多重比较法进行分析。
3 结 果
3.1 一般状态观察与体重
各组小鼠一般状态均无明显异常,与模型对照组相比,各治疗组小鼠体重均无统计学差异(P >0.05)。
3.2 角膜荧光素钠染色评分
治疗7、14 d 后,与正常对照组相比,模型对照组荧光素钠染色评分显著升高,具有统计学差异(P <0.01),说明造模成功;与模型对照组相比,各治疗组的荧光素钠评分均有不同程度的降低,其中以KdPT 高剂量组和阳性对照组最为明显,且有显著的统计学差异(P <0.01),见图1和图2。
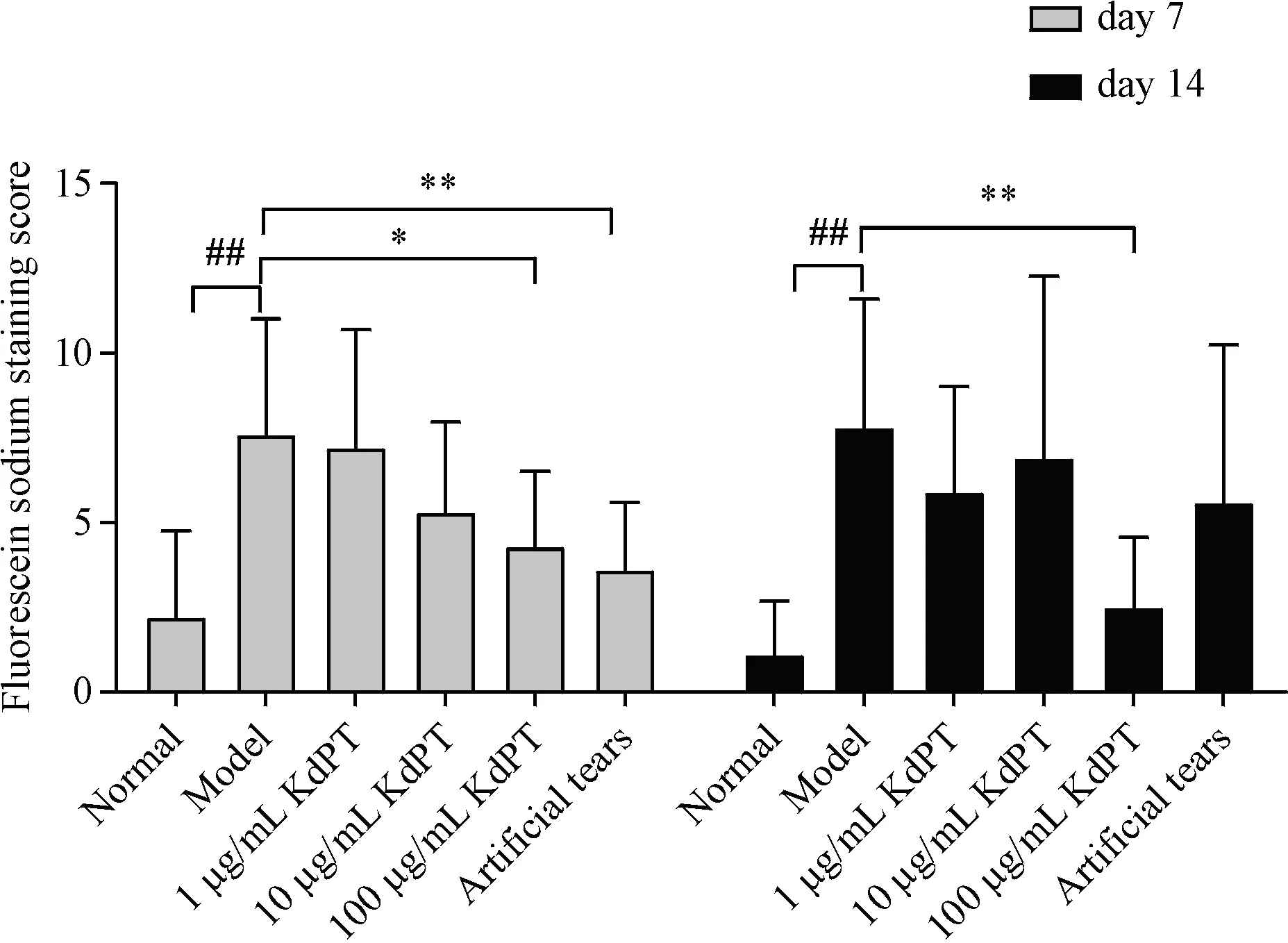
Figure 1 Corneal fluorescent staining scores of each treatment group(n = 10)

Figure 2 Corneal fluorescein sodium staining of model control group(A)and 100 μg/mL KdPT group(B)
3.3 泪液分泌量测定
与正常对照组相比,模型对照组小鼠酚红棉线长度明显缩短,泪液分泌量明显降低(P <0.01),说明造模成功;与模型对照组相比,KdPT各治疗组和阳性对照组均可增加酚红棉线长度,促进泪液分泌,且KdPT 中剂量组、高剂量组、阳性对照组有显著的统计学差异(P <0.01),见图3。
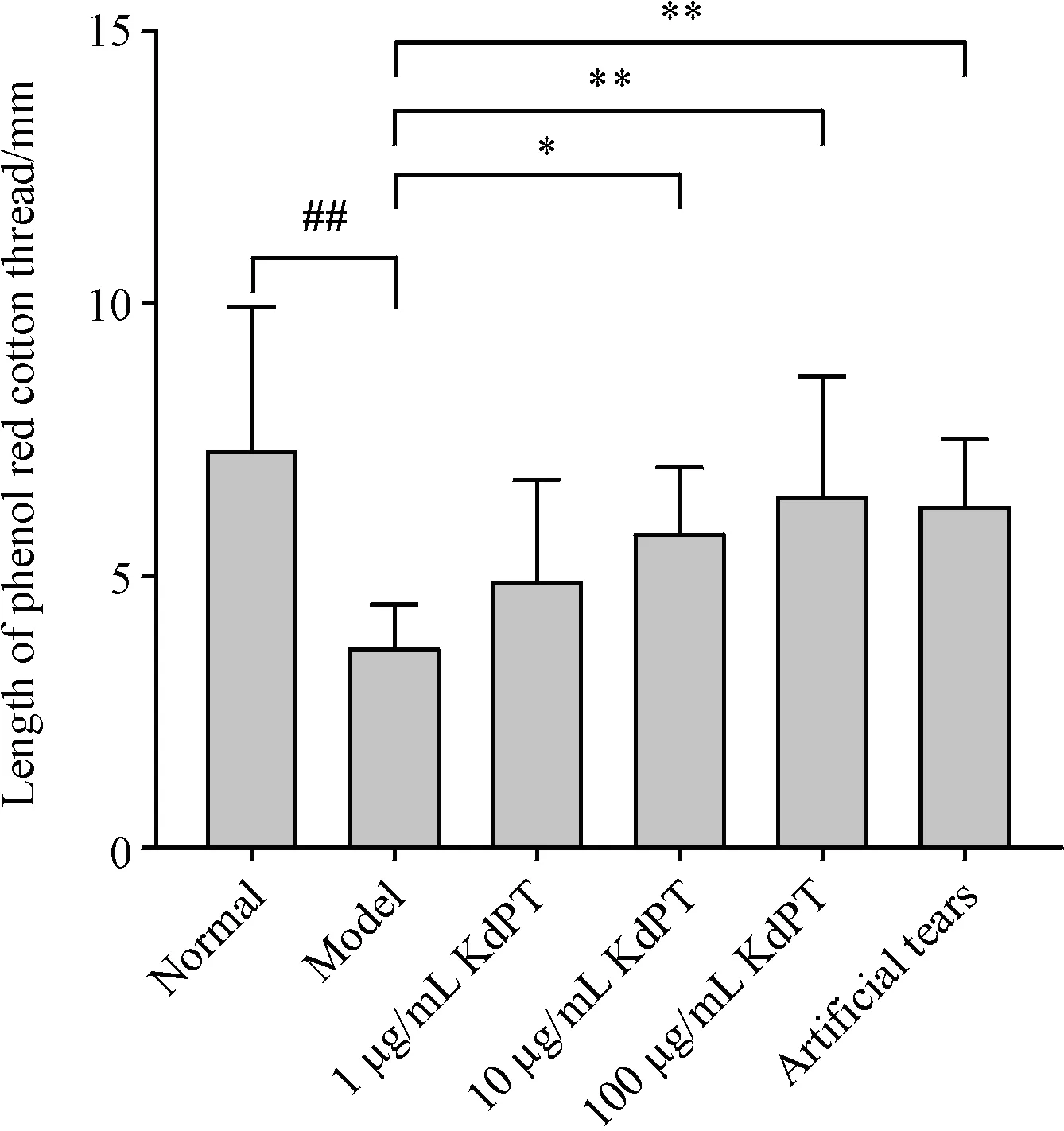
Figure 3 Lacrimal secretion of each treatment group(,n = 10)
3.4 病理学变化
与模型对照组相比,各治疗组的病理评分均有不同程度的降低,其中以KdPT 高剂量组(100 μg/mL)、阳性对照组最为明显,且有显著的统计学差异(P <0.01),见图4。组织病理结果显示,模型对照组角膜上皮厚度不均匀,局部变窄,并出现裂隙,基质重度肿胀,表现为裂隙扩张。KdPT 治疗明显改善眼干燥症小鼠的角膜组织病理评分,特别是高剂量组角膜上皮厚度均匀,细胞形态正常,无角质,基质厚度均匀,无血管、无炎症,见图5,提示KdPT治疗明显修复了受损的角膜上皮。
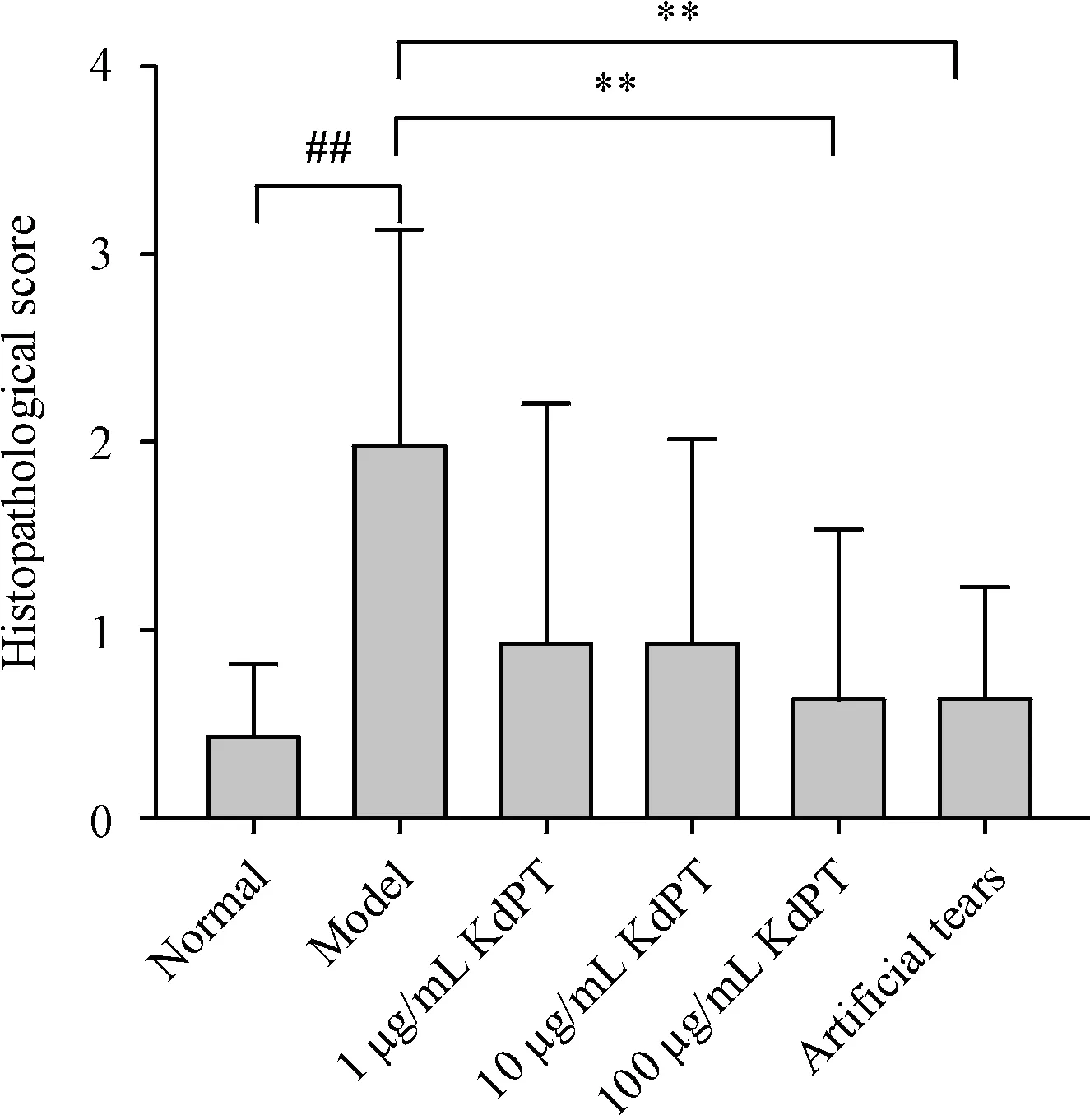
Figure 4 Corneal histopathological score of each treatment groups,n = 10)
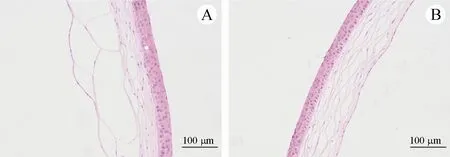
Figure 5 Corneal histopathology of model control group and 100 μg/mL KdPT group
4 讨 论
KdPT 为衍生自促黑激素α-MSH 的抗炎三肽,具有多重抗炎活性,对多种炎症性疾病有良好的治疗作用。文献报道,KdPT 对溃疡性结肠炎[10-11]、鼻炎[12]、银屑病[13]等疾病有明显的治疗作用,目前KdPT治疗溃疡性结肠炎的研究在国外已进入临床Ⅱ期,在国内进入临床Ⅰ期(国内代号为LH025,由广州领晟医疗科技有限公司开发),具有良好的开发前景。本研究通过建立苯扎氯铵诱导小鼠眼干燥症模型,考察了KdPT 对眼干燥症的治疗作用,研究结果表明,KdPT治疗可促进泪液分泌,修复受损的角膜上皮,对小鼠眼干燥症具有明显的治疗作用,有可能开发为眼干燥症的新型治疗药物。本研究为KdPT 开展眼干燥症的临床开发提供了数据支持,增加了药物潜在的适应证,具有重要的研究价值。
炎症是眼干燥症发病的关键因素[3],IL-1R 是参与眼干燥症发生的重要受体[14-16],KdPT 是IL-1R的抑制剂,能够阻断多种炎症因子(如IL-1β 等)与IL-1R 的结合,从而阻断炎症通路,这可能是KdPT能够治疗眼干燥症的作用机制之一。
本研究首次证实了KdPT 三肽对蒸发过强型小鼠眼干燥症模型具有显著的治疗作用,后续研究中将考察KdPT 对其他眼干燥症模型的有效性和安全性,同时对其作用机制进行更加深入地研究,为KdPT 用于眼干燥症治疗的临床开发积累更多的数据。
