Livin基因沉默对人喉癌Hep2细胞凋亡和增殖及化疗敏感性的影响*
2021-03-13何盛梅李昌亚孟令辉赵厚育
何盛梅, 李昌亚, 孟令辉, 赵厚育
(贵州医科大学附属医院 耳鼻咽喉科, 贵州 贵阳 550004)
喉癌是一种发生于头颈部的常见肿瘤,由于发病位置特殊,可影响患者发音、呼吸和吞咽功能,因此严重影响患者的生活质量[1]。除了手术治疗,大部分喉癌需要结合化疗,其中顺铂是喉癌等头颈部鳞癌的一线化疗用药,具有便宜、高效等特点[2]。然而,喉癌细胞对顺铂(cisplatin,DDP)的敏感性下降,直接影响治疗效果,但目前癌细胞对DDP耐药机制尚不清楚[3]。凋亡是化疗药物诱导肿瘤细胞死亡的主要模式,凋亡抑制蛋白(inhibitor of apoptosis proteins, IAPs)家族在调节肿瘤细胞的凋亡敏感性方面起着核心作用[4]。Livin是IAP家族新成员,具有强大的抗凋亡能力,特异性表达于人的胚胎组织及许多肿瘤组织中,在正常成人组织中低表达或无表达,是当今肿瘤治疗的一个新靶点[5]。课题组前期研究中发现,Livin在喉癌中高表达且和不良预后相关[6],因此本研究通过RNAi沉默Livin的表达而获得喉癌细胞对DDP的敏感度提升,可能为喉癌增敏治疗提供实验依据。
1 材料与方法
1.1 材料
1.1.1细胞与主要试剂 人喉鳞癌Hep2细胞株购自中国科学院上海细胞生物研究所细胞库; RPMI-1640培养基和Trizol RNA提取试剂(美国Gibco),Lipofectamine 2000(美国Invitrogen),小鼠抗人β-actin单克隆抗体(美国Santa Cruz Biotechnology),鼠抗人Livin单克隆抗体(美国Chemicon),兔抗人Caspase 3多克隆抗体(武汉博士德),噻唑蓝[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,Thiazolyl Blue Tetrazolium Bromide,MTT;美国Sigma],洗涤缓冲液(tris buffered saline tween,TBST)和磷酸缓冲液(phosphate buffer saline,PBS)由实验室配制, DDP购自山东齐鲁制药厂。
1.1.2主要仪器 台式低温高速离心机(beckMAN COULTER.INC),蛋白半干式转膜仪(美国BioRad),Power PAC-300电泳仪(美国Bio-Rad),RNA/DNA定量仪(美国Pharmacia),凝胶成像系统(日本Olympus),磁力搅拌器(上海沪西分析仪器厂),恒温干燥箱(上海医疗器械厂)。
1.2 方法
1.2.1靶向Livin的siRNA真核表达载体的构建、细胞培养及转染 依据GenBank中Livin基因已知序列(NM-139317),结合网上在线设计软件,对它们的共同序列筛选出3条干扰序列,并合成3对siRNA。siRNA1:靶序列为5′ -CCGTGTCCATCGTCTTTGT-3′,正义链为5′ -CCGUGUCCAUCGUCUUUGU dTdT-3′,反义链为3′ -dTdT GGCACAGGUA GCAGAAACA -5′。siRNA2:靶序列为5′- GGAAGAGACTTTGTCCACA -3′,正义链为5′ -GGAAGAGACUUUGUCCACA dTdT-3′,反义链为3′-dTdTCCUUC UCUGAA ACAGGUGU-5′。siRNA3:靶序列为5′- AGAGAGGTCCAGTCTG AAA -3′,正义链为5′-AGAGAGGUCCAGUCUG AAA dTdT-3′,反义链为3′ -dTdTUCUCUCCAGGUCAGACU UU-5′。siRNA序列由广州瑞博生物科技有限公司合成,所得siRNA分别命名为:Livin-siRNA1、Livin-siRNA2、Livin-siRNA3及control-siRNA。同时设计出非特异性靶序列作为阴性对照。Hep-2 细胞在含10%胎牛血清的培养基中、37 ℃的5%CO2培养,细胞转染过程按转染试剂盒说明书进行,以6孔培养板,转染终浓度为50 nmol/L,用Lipofectamine 2000为转染试剂,按说明书进行转染。研究分为Hep2细胞+control-siRNA组(Hep2-con组)、Hep2细胞+ Lipofectamine 2000组(Hep2-L组)、Hep2细胞+Livin-siRNA1转染组(Hep2-s1组)、Hep2细胞+Livin-siRNA2转染组(Hep2-s2组)、Hep2细胞+Livin-siRNA3转染组(Hep2-s3组)及Hep2细胞+PBS空白对照组(Hep2组)。根据Livin-siRNA转染喉鳞癌Hep2细胞对Livin表达的影响结果,在后续实验中,合成的3对siRNA仅保留干扰效果最好Hep2-s1,即后续实验中仅有Hep2-con组、Hep2-L组、Hep2-s1组及Hep2组。
1.2.2Western blot检测Livin蛋白表达水平 收集需要检测蛋白的细胞并提取细胞总蛋白,取蛋白样品各10 μL进行聚丙烯酰胺凝胶电泳3 h,将蛋白转移到聚偏二氟乙烯(polyvinylidene fluoride, PVDF)膜上,硝酸纤维素膜浸泡于10%脱脂奶封闭液,室温下缓慢摇动1 h,加鼠抗人Livin单克隆抗体(1 ∶400),4 ℃振摇孵育过夜;洗涤缓冲液(tris buffered saline tween,TBST)洗膜,加用辣根过氧化物酶标记的二抗稀释液室温下振摇孵育1 h,将PVDF膜浸于显色液中观察结果,用凝胶成像分析仪进行摄像。
1.2.3MTT检测细胞活力 培养细胞,调整浓度为2×107个/L,细胞按100 μL (2×103个/孔)接种于96孔培养板,每组接种21个孔;37 ℃的5%CO2孵箱及饱和湿度条件下培养7 d,每孔加5 g/L MTT 20 μL,37 ℃孵育4 h,弃上清;每孔加二甲基亚砜(dimethylsulfoxide,DMSO)150 μL,振荡10 min,充分溶解结晶,选择490 nm波长于酶标仪上测定各孔光吸收值(optical density,OD),记录结果。
1.2.4流式细胞仪检测细胞周期变化及凋亡 对数生长期Hep2细胞按5×105个/孔接种于6孔培养板,细胞贴壁生长24 h,按“1.2.1”项下分组分别进行转染,0.25%胰蛋白酶消化各组Hep2细胞,1 000 r/min 4 ℃离心10 min,去上清,PBS洗2次,缓慢加入无水乙醇2.1 mL,使乙醇终浓度达70%以固定细胞,4 ℃过夜;加碘化丙啶(propidium Iodide,PI)染液500 μL,4 ℃避光反应30 min;流式细胞仪检测细胞周期及细胞凋亡,分别计算各组细胞G0/G1期、S期、G2/M期各期细胞所占的百分率,观察是否存在亚二倍体凋亡峰,计算各组细胞凋亡率[细胞凋亡率=(凋亡细胞数/总细胞数)×100%]。
1.2.5平板克隆形成实验 对数生长期Hep2细胞按5×105个/孔浓度接种于6孔培养板,每组细胞分别接种5个孔,细胞贴壁生长24 h,根据分组分别进行转染,待细胞长满至80%~85%底面积时,每组分别加入DDP至终浓度为0.00 、0.01、0.10、1.00及10.00 mg/L进行化疗;0.25%胰蛋白酶消化并用吸管吹打成单个细胞,按每皿50、100及200个细胞的梯度密度将4组细胞各剂量分别接种于培养皿中,以十字方向轻轻晃动培养皿,使细胞分散均匀;肉眼观察培养皿中克隆形成情况,倒置显微镜(100×)下计数大于50个细胞的克隆数,计算集落形成率[集落形成率(%)=集落数/接种细胞数×100%];重复3次,取平均值,计算各组细胞集落抑制率[集落抑制率=(1-实验组集落形成率/对照组集落形成率)×100%]。
1.3 统计学分析
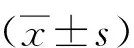
2 结果
2.1 Livin-siRNA转染喉鳞癌Hep2细胞对Livin表达的影响
Western blot 检测结果显示,Hep2-s1、Hep2-s2及Hep2-s3组分别与Hep2组相比,人喉鳞癌Hep2细胞Livin蛋白的表达水平降低(P<0.05);Hep2-con组和Hep2- L组分别与Hep2组相比,人喉鳞癌Hep2细胞Livin蛋白表达水平差异无统计学意义(P>0.05)。见图1。
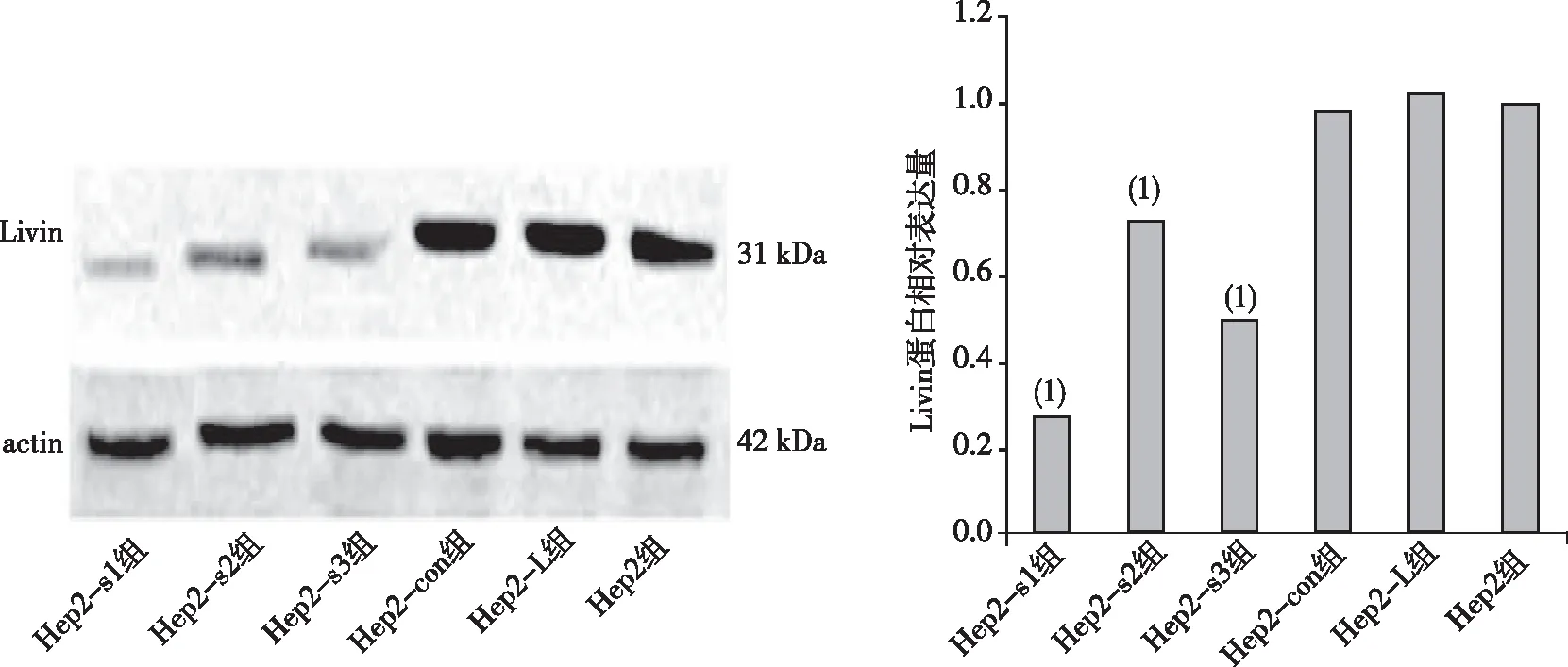
注:(1)与Hep2组比较,P<0.05。图1 各组细胞中 Livin蛋白的表达Fig.1 Expression levels of Livin protein in the cells of each group
2.2 Livin-siRNA转染喉鳞癌Hep2细胞对其生长抑制及凋亡的作用
细胞生长曲线显示,与Hep2组相比,Hep2-s1组人喉鳞癌Hep2细胞生长曲线上升平缓,各检测点光OD下降(P<0.05);Hep2-con组、Hep2- L组分别与Hep2组比较,各检测点光OD基本一致 (P>0.05),说明Livin-siRNA可抑制Hep2细胞的生长。见图2。

注:(1)与Hep2组比较,P<0.05。图2 各组细胞的生长曲线Fig.2 Proliferation curves of the cells in each group
2.3 细胞周期和凋亡
细胞周期结果显示,与Hep2组相比,Hep2-s1组人喉鳞癌Hep2细胞被阻滞于G0/G1期(P<0.05),S期细胞及G2/M期细胞明显减少(P<0.05),并在G1期前出现一明显的亚二倍体凋亡峰,但Hep2-con组和Hep2- L组细胞周期无变化(P>0.05);细胞凋亡结果显示,与Hep2组相比,Hep2-s1组人喉鳞癌Hep2细胞凋亡率升高(P<0.05),Hep2-con组和Hep2- L组分别与Hep2组比较、细胞凋亡率无变化(P>0.05)。见表1。

表1 各组细胞的细胞周期和细胞凋亡率比较Tab.1 Comparison of cell cycle and apoptosis rate in the cells of each
2.4 Livin-siRNA转染喉鳞癌Hep2细胞对其化疗敏感性的影响
2.4.1平板克隆形成实验 结果显示,不同浓度DDP处理的Hep2-s1组与Hep2组比较, Hep2细胞克隆形成率均降低,尤以0.10、1.00和10.00 mg/L的DDP下降明显(P<0.05);不同浓度DDP处理的Hep2-con组、Hep2-L组分别与Hep2组比较, Hep2细胞克隆形成率无变化(P>0.05)。见图3。

注:(1)与同浓度Hep2组比较,P<0.05。图3 各组细胞各化疗剂量下的细胞克隆形成率Fig.3 Colony formation rates of each group at different chemotherapy doses
2.4.2MTT检测 在同一DDP药物浓度下,Hep2-s1组与Hep2组相比,Hep2细胞存活率降低(P<0.05);Hep2-con组、Hep2- L组分别与Hep2组比较,细胞存活率无差异(P>0.05)。见图4。
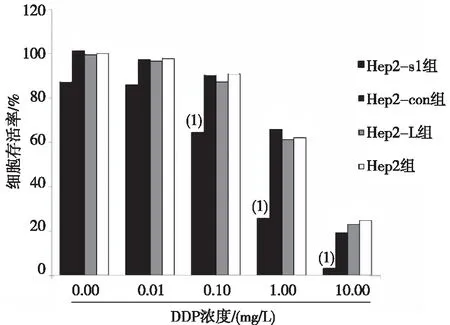
注:(1)与同浓度Hep2组比较,P<0.05。图4 不同浓度DDP作用后各组细胞的存活率Fig.4 Cell viability rates of each group after different concentrations DDP treatment
2.4.3DDP作用后细胞生长抑制情况 5 mg/L DDP作用后各组Hep2细胞生长抑制率均随时间延长呈升高趋势,Hep2-s1组与 Hep2组比较,各时间点细胞生长抑制率明显增加(P<0.05);Hep2-con组、Hep2- L组分别与Hep2组比较,各时间点人喉鳞癌Hep2细胞凋亡率和生长抑制率均无差异(P>0.05)。见图5。
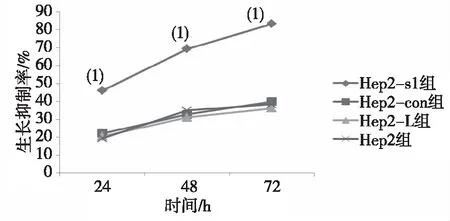
注:(1)与同时点Hep2组比较,P<0.05。图5 DDP作用后不同时间点各组细胞生长抑制率Fig.5 Cell growth inhibition rates of each group at different time points after DDP treatment
3 讨论
本实验结果显示,通过RNA干扰方法沉默Livin在喉癌中的表达,获得良好效果,观察到喉癌细胞中Livin蛋白表达显著减少。IAP家族中的一个重要成员Livin,在成人的正常组织中几乎无表达,但在多种常见恶性肿瘤中高表达,如有研究发现Livin在腮腺肿瘤[7]、骨肉瘤[8]、卵巢癌[9]中高表达,且和不良预后有关。由于Livin有强大的凋亡抑制能力和肿瘤组织内特异性分布,并且是影响细胞周期和细胞凋亡的关键分子和维持肿瘤细胞存活的必要条件[10],因此以Livin为目的基因的肿瘤基因治疗可以有效地杀死肿瘤细胞,逆转肿瘤的恶性表型,并且能最大限度地减少对正常细胞的毒性作用[11-13]。因此以Livin基因作为肿瘤基因治疗的靶点是很好的基因治疗策略,本实验利用RNA干扰技术沉默其表达,以对其功能进行进一步研究。
Livin基因作为IAP家族中的一个重要成员,不仅有强大的抗细胞凋亡作用,还可以调节细胞周期分布、抑制细胞增殖[10]。本研究探讨了Livin基因对细胞凋亡和细胞周期的影响,流式细胞仪检测结果显示,Livin表达下调后,G0/G1期细胞增加,S期细胞及G2/M期细胞减少,提示细胞增殖能力下降,细胞增长趋势受到抑制;通过MTT比色法绘制细胞生长曲线观察到Livin表达下调使Hep2细胞增殖受抑,细胞生长曲线低平,缺乏指数增殖特征。另外,流式细胞仪结果还显示,Livin表达下调后,使其主要的拮抗细胞凋亡功能丧失,细胞凋亡率升高。同时,细胞周期检测图也显示在G1期前出现一明显的亚二倍体凋亡峰,提示Livin RNAi有诱导细胞凋亡的作用。同样,Wang等[14]采用RNAi沉默Livin在恶性黑色素瘤细胞中的表达后,发现肿瘤细胞的增殖受到抑制。
细胞凋亡存在3条通路,即死亡受体通路、线粒体通路及内质网通路,并最终都通过Caspases起作用[15-17]。IAP家族具有BIR结构域能与Caspase结合,抑制后者的活性,从而抑制细胞的凋亡[18]。在IAP家族成员中,仅有Livin具有α和β亚基,每个亚基各有1个BIR序列,Livin可通过BIR结构域与Caspase-3结合,发挥抑制细胞凋亡的功能[19]。本实验探讨了沉默Livin后,细胞对DDP敏感性的变化。靶向Livin可能通过复杂的分子机制逆转肿瘤化疗耐药,如沉默结肠癌细胞中的Livin表达,可能通过调节细胞凋亡与自噬的串扰而实现癌细胞对5-氟尿嘧啶的增敏[20];Livin可能介导了前列腺癌细胞对紫杉醇的耐药,而柚皮苷可能通过降低其表达而获得癌细胞对该化疗药的增敏[21];在肾癌细胞中,沉默Livin表达后,不仅可以促进细胞自噬性死亡,还可以增加肾癌细胞对DDP的化疗敏感性[22]。本研究通过沉默Livin在喉癌细胞中的表达,也获得了癌细胞对DDP的增敏作用。因此,基于Livin仅在癌细胞中表达、有正常组织中不表达的特点, Livin有望成为肿瘤治疗的一个重要靶点。
Livin促进肿瘤发展的机制十分复杂,目前还未了解清楚。比如,Livin在促进下咽癌发生发展过程中,可能有JNK和AKT信号通路参与[23];乳腺癌中,Livin可能通过p38/GSK3β路径激发上皮间质化过程,从而增强癌细胞的侵袭和转移能力[24]。除了该通路,Livin还可以通过激活NF-κB而诱导结肠癌细胞上皮间质化进程,增强细胞转移能力[25]。因此,Livin促进喉癌细胞DDP耐药的分子机制也十分复杂,需要将来的研究中进一步探索。
综上所述,以Livin为靶点的RNAi能特异性抑制Livin的表达,抑制细胞增殖,诱导细胞凋亡。Livin可作为包括头颈部恶性肿瘤在内的人类多种恶性肿瘤基因治疗的一个潜在靶点。
