三氧化二砷对体外人小肠癌HIC细胞增殖的作用和机制*
2021-03-13杨云洪尹朝晖张汝一颜登国徐伟赵洋李国胜
杨云洪, 尹朝晖, 张汝一, 颜登国, 徐伟, 赵洋, 李国胜
(贵州医科大学附属医院 肛肠外科, 贵州 贵阳 550001)
肿瘤的发生与异常的细胞增殖、分化以及凋亡密切相关,而细胞周期阻滞是导致细胞增殖抑制的主要原因之一[1-2],因此当前肿瘤研究的热点主要与细胞周期阻滞相关周期蛋白的研究有关。三氧化二砷(arsenic trioxide,ATO)作为中药砒霜的主要成分,在多种实体瘤的治疗中得到应用,并取得了良好的效果[3-4]。ATO可以通过多种机制发挥抗肿瘤作用,有研究发现下调细胞周期相关蛋白的表达可以阻滞细胞周期,进而抑制肿瘤细胞的增殖,是ATO发挥抗肿瘤作用的重要机制之一[5-6]。小肠癌是一种少见的消化道恶性肿瘤,可供研究临床资料较少,目前国内外未见与ATO抑制小肠癌细胞增殖及其机制的研究报道,因此本实验将ATO与人小肠癌HIC细胞进行体外培养,观察ATO对小肠癌细胞增殖和细胞周期相关蛋白的表达,研究ATO在体外的抗肿瘤作用及机制,现将结果汇报如下。
1 材料与方法
1.1 材料
1.1.1细胞株及主要试剂 0.25%胰蛋白酶、RPMI-1640培养基均购自美国HyClone公司,人小肠癌HIC细胞株由美国ATCC细胞库提供;兔多克隆抗体糖原合成酶激酶-3(glycogen synthase kinase-3β,GSK-3β)、细胞周期蛋白B1(cyclin B1)、细胞周期蛋白D1(cyclin D1)及骨髓细胞瘤病毒癌基因(cellular-myelocytomatosis viral oncogene,c-Myc)均购自美国Santa Cruz Biotechnology Inc公司,辣根过氧化物酶 (horseradish peroxidase,HRP) 标记的甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)购于康成生物技术公司,HRP标记的羊抗兔二抗单抗购自Santa Cruz Biotechnology Inc公司,显影液、定影液购于美国柯达公司,聚乙烯二氟(polyvinylidene fluoride,PVDF)膜、ECL-Plus 发光试剂及高效显影胶片均购于美国Amersham 公司。
1.1.2主要仪器 倒置显微镜购于日本尼康公司,BIO-RAD Power-pac 3000电泳仪购于美国 BIO-RAD公司,xCELLigence RTCA DP实时无标记细胞分析仪和E-Plate 16检测板均由杭州艾森生物有限公司提供。
1.2 方法
1.2.1细胞培养 复苏冻存的人小肠癌HIC细胞, RPMI-1640培养液(含10%胎牛血清、1%双抗),5%CO2、37 ℃恒温培养。定期更换培养液,取对数期生长的细胞用于本研究。
1.2.2ATO对人小肠癌HIC细胞增殖情况 取生长状态良好的处于对数期的人小肠癌HIC细胞,调整细胞悬液浓度为1×105/mL,50 μL培养基加入E-Plate 16检测板,同时检测其背景阻抗值;将调整好的100 μL细胞悬液(细胞量为5~10×103/孔)加入到E-Plate 16检测板孔中,放置入RTCA仪,在37 ℃恒温5%CO2的条件下培养孵育24 h后,将10、15、20、40及60 μmol/L ATO加入各孔处理后作为实验组;同时加等量磷酸盐缓冲液(phosphate buffer saline, PBS) ,设置为空白对照组。将检测板再次放置入RTCA仪,监控时长设定为120 h,时间间隔设定为30 min,监测记录细胞指数(cell index,CI)值,通过绘制的RTCA 系统动力学变化反应曲线,观察检测板孔中人小肠癌HIC细胞的生长状况。
1.2.3人小肠癌HIC细胞周期相关蛋白cyclin D1、GSK-3β、cyclin B1、c-Myc的表达 取处于对数期的人小肠癌HIC细胞,在5%CO2的37 ℃恒温条件下培养人小肠癌HIC细胞株2 d后,将10、15、20及40 μmol/L ATO加入培养皿中处理作为实验组,另设空白对照组加等量PBS,5%CO2的37 ℃恒温继续培养2 d,收集各组细胞。将各组细胞裂解后,按常规方法提取细胞蛋白,通过BCA法测定各组蛋白浓度。取上述各组蛋白50 μg,适量蛋白加样缓冲液稀释后,95 ℃加热变性10 min。SDS-PAGE电泳分离蛋白,浓缩胶电压80 V,分离胶电压100 V;经半干式电转仪(80 V稳压、4 ℃及2 h)转至PVDF膜上,置于含5%脱脂奶粉的Tris盐酸吐温缓冲液(tris buffered saline tween,TBST)溶液,闭光室温封闭2 h。TBST洗涤后,将膜置于一抗稀释液(兔多克隆抗体GSK-3β、cyclin B1、cyclin D1及c-Myc按照1 ∶500稀释),4 ℃过夜孵育,置于二抗稀释液(HRP标记的羊抗兔二抗按照1 ∶5 000稀释),室温振摇孵育2 h,TBST洗涤3遍,以GAPDH作为内参蛋白,ECL发光液A液和B液等体积混合液处理后,置于暗盒中进行曝光、显影和定影,各组的条带灰度值通过数码图像分析系统进行扫描分析。
1.3 统计学分析
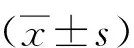
2 结果
2.1 ATO影响人小肠癌HIC细胞的增殖
通过RTCA系统连续监测,其结果显示,实验组经过10、15、20、40及60 μmol/L ATO处理后的人小肠癌HIC细胞CI值均较空白对照组明显下降,其下降趋势随着ATO浓度的增加更明显。见图1。

图1 连续监测不同浓度ATO对人小肠癌HIC细胞增殖的影响Fig.1 Real-time monitoring of cell proliferation of human small bowel cancer HIC by different ATO concentrations
2.2 人小肠癌HIC细胞周期相关蛋白cyclin D1、cyclin B1、GSK-3β及c-Myc的表达
Western blot检测结果显示,10、15、20及40 μmol/L ATO组人小肠癌HIC细胞GSK-3β、cyclin B1、cyclin D1及c-Myc等相关周期蛋白的表达水平均较空白对照组均下降(P<0.05),且随着ATO浓度的增高,周期相关蛋白的表达水平越低。见图2。

注:A为蛋白电泳图,B、C、D及E分别GSK-3β、cyclin B1、cyclin D1及c-Myc的定量表达;(1)与空白对照组比较,P<0.05。图2 不同浓度ATO影响人小肠癌HIC细胞周期相关蛋白的表达Fig.2 Expression of HIC cell cycle-related proteins of colorectal cancer affected by different concentrations ATO
3 讨论
ATO可以通过抑制肿瘤细胞的增殖、诱导肿瘤细胞的凋亡、诱导肿瘤细胞的分化、抑制肿瘤新生血管的形成及下调端粒酶活性等多种途径抑制肿瘤的生长[7-8]。有研究报道[9],ATO可通过降低非小细胞肺癌A549细胞端粒酶的活性,诱导肿瘤细胞的凋亡,抑制肿瘤生长。Tan等[10]在大鼠肝细胞癌模型中发现,ATO可以明显降低肿瘤组织中微血管密度,抑制新生肿瘤血管形成。在本研究中,通过RTCA系统监测经不同浓度的ATO处理后的人小肠癌HIC细胞增殖情况,结果显示ATO可以明显抑制人小肠癌HIC细胞的增殖,表明抑制肿瘤细胞的增殖是ATO抑制小肠癌细胞生长的重要途经。
细胞周期调节失控是肿瘤细胞异常增殖的主要原因,因此抑制肿瘤细胞增殖可以通过阻滞细胞周期实现[11]。细胞周期分为分裂期(M期)和分裂间期,分裂间期又分为DNA合成期(S期)、DNA合成前期(G1期)及DNA合成后期(G2期)[12-13]。Park等[14]研究发现,ATO可以阻滞肿瘤细胞由G1期向S期转化,细胞周期停滞于G1期,S期细胞减少,G2/M期细胞增加,从而抑制肿瘤细胞的增殖。Shao等[15]研究同样证实,ATO可以使MKN 45 细胞停滞于G2/M期,G2/M期细胞明显增多,S期细胞减少。细胞周期的变化是一个复杂的过程,受细胞周期蛋白(cyclin )、细胞周期蛋白依赖性激酶抑制物(cyclin dependentki-naseinhibitor, CDKI)及细胞周期蛋白依赖性激酶CDK三类物质严格的调控[16-17],G1/S、G2/M是该调控过程中主要的关键性限制点[18]。
cyclin D1是目前研究最深入的cyclinD亚型,是控制细胞由G1进入S期的关键蛋白,cyclin D1的持续高表达或异常表达,导致G1期缩短及细胞周期调控紊乱,使肿瘤细胞异常增殖[19-20]。曹琦等[21]证实,cyclin D1的作用是使Rb蛋白磷酸化,后者与转录因子E2F解离后,使细胞进入S期,而ATO可以下调cyclin D1的表达,使肿瘤细胞停滞于G1期,抑制肿瘤的生长。潘洪涛等[22]研究也发现,ATO可以通过下调cyclin D1,阻滞细胞周期,抑制人胆囊癌裸鼠移植瘤的生长。在本研究中,经不同浓度ATO处理后的人小肠癌HIC细胞,通过Western blot检测cyclin D1的表达,结果显示相对于空白对照组,ATO可以明显下调人小肠癌HIC细胞cyclin D1的表达,从而抑制人小肠癌HIC细胞增殖。cyclin B1是调控G2/M期的重要蛋白,与CDK1结合后形成有丝分裂促进分子(mitosis promoting factor,MPF),驱动细胞由G2期进入M期[23]。已有研究证实[24],cyclin B1与肿瘤的发生密切相关,在许多肿瘤组织中异常高表达,如乳腺癌、胰腺癌及卵巢癌等。Park等[14]等报道,ATO可通过下调肿瘤组织cyclin B1的表达,使肿瘤细胞停滞在G2/M期,进而抑制肿瘤增殖。本实验结果发现,经ATO处理后的人小肠癌HIC细胞cyclin B1表达明显下降,表明ATO可以下调人小肠癌HIC细胞中cyclin D1的表达,进而抑制肿瘤增殖。GSK-3β是细胞内多种信号转导通路中的重要成分,可通过结合降解β-catenin从而影响调节Wnt 信号通路[25-26]。有研究发现[27],GSK-3β可以直接抑制β-catenin对cyclin D1的降解,促使肿瘤细胞由G1期进入S期,下调GSK-3β的表达可以抑制肿瘤的生长。本研究将ATO与人小肠癌HIC细胞培养后,检测结果显示GSK-3β表达明显下降,表明ATO可以下调人小肠癌HIC细胞中GSK-3β的表达,进而抑制肿瘤增殖。c-Myc是一种核内磷酸化蛋白,在乳腺癌、结肠癌及宫颈癌等恶性肿瘤组织中高表达,c-Myc可以上调cyclin D和CDK的表达,加速肿瘤细胞的G1/S转换[28-29]。Chen等[30]研究发现,在体外敲除肿瘤细胞中c-Myc基因,使细胞周期停滞,抑制肿瘤细胞的增殖。在本研究中,ATO处理人小肠癌HIC细胞后,发现人小肠癌HIC细胞C-myc均不表达,表明ATO可以通过下调c-Myc的表达,抑制人小肠癌HIC细胞增殖。
综上所述,ATO可以在体外抑制人小肠癌HIC细胞的增殖,同时明显下调细胞周期相关蛋白cyclin D1、cyclin B1、GSK-3β及c-Myc的表达,可能是ATO抑制人细胞增殖的重要机制之一。本研究在细胞及蛋白水平上初步探讨了ATO对体外人小肠癌HIC细胞的作用及其可能的机制,但没有进行动物体内实验,因此下一步打算进行动物体内实验,在基因水平上探究其机制及可能的信号通路。
