家蝇抗真菌肽-1A对人肝癌细胞HepG2抑制作用的机制*
2021-03-13吴坤马晓琳张迎春邓思波黄敏慧吴建伟陈峥宏王涛
吴坤, 马晓琳, 张迎春, 邓思波, 黄敏慧, 吴建伟, 陈峥宏**, 王涛**
(1.贵州医科大学 基础医学院, 贵州 贵阳 550025; 2.贵州省普通高等学校病原生物学特色重点实验室, 贵州 贵阳 550025; 3.济南金域医学检验中心, 山东 济南 250000)
抗菌肽(antimicrobial peptides,AMPs)是广泛存在于生物体内具有抵抗外界微生物侵害的一类小分子多肽,是生物固有免疫系统的重要组成成分[1-2]。研究发现,AMPs除了具有抑制细菌、病毒等病原微生物作用外,对肿瘤细胞也具有较强的抑制活性[3-6],而且对机体正常组织细胞的毒副作用较低[7-8],因此具有抗肿瘤药物开发的潜力。家蝇抗真菌肽-1A (Muscadomesticaantifungal peptide-1A,MAF-1A) 是来源于家蝇幼虫的小分子阳离子活性多肽,由26个氨基酸残基组成[9]。有研究报道,MAF-1A能杀伤真菌、病毒等致病性微生物[10-11];课题组前期实验研究发现,MAF-1A能对人肝癌HepG2产生抑制作用,且对人正常肝细胞LO2和红细胞无明显毒性作用,具有进一步研究开发的价值[12]。但MAF-1A抑制HepG2细胞的作用机制尚不清楚,本研究旨在探讨MAF-1A对HepG2细胞产生抑杀作用的可能因素,为MAF-1A的开发利用提供实验依据。
1 材料与方法
1.1 材料
1.1.1细胞株和主要试剂 人肝癌细胞HepG2由贵州医科大学生物工程实验室惠赠;杜氏改良伊格尔培养基(dulbecco's modified eagle medium,DMEM) 及磷酸盐缓冲液(phosphate buffered saline,PBS;美国GIBCO),胎牛血清(杭州四季青),活性氧(reactive oxygen species,ROS) 检测试剂盒及Annexin V-FITC试剂盒(北京索莱宝),细胞周期检测试剂盒及线粒体膜电位检测试剂盒(上海碧云天)。
1.1.2主要仪器 Novo Cyte流式细胞仪(杭州艾森),H-600-4透射电子显微镜(日本日立高新),XDS-1B倒置显微镜(重庆光学),MCO-5M CO2培养箱(日本三洋)及L500台式低速离心机(湖南湘仪)。
1.2 方法
1.2.1MAF-1A储备液的制备 按文献[13]方法,采用原核载体串联表达MAF-1A,镍柱亲和层析纯化、脱盐浓缩制备MAF-1A,使其储备液浓度为5 000 mg/L,分装后置于-80 ℃冰箱冷藏备用。
1.2.2细胞培养 HepG2细胞培养于DMEM完全培养基,含体积分数10%胎牛血清,培养基添加终浓度100 000 U/L青霉素及100 mg/L的链霉素;将细胞置于5%CO2的37 ℃培养箱中培养,细胞密度达到80%时,按照1 ∶3的比列传代,取处于对数生长期的细胞进行实验。
1.2.3透射电镜观察细胞超微结构 取对数生长期的HepG2细胞以1×105个/孔的密度接种于6孔板,置5%CO2的37 ℃细胞培养箱培养12 h;0、50 及100 mg/L的MAF-1A分别处理24 h后收集细胞,3%戊二醛固定、丙酮逐级脱水、样品包埋,切完片后先后用醋酸铀和枸橼酸染色,于透射电镜(6 000×)下观察细胞的超微结构。
1.2.4流式细胞术测定细胞周期、细胞凋亡及细胞内ROS 取对数生长期的HepG2细胞以1×105个/孔的密度接种于6孔板,每组3个复孔,5%CO2的37 ℃培养箱培养12 h;0、100、200及400 mg/L的MAF-1A分别处理24 h。按试剂盒说明书方法,分别以碘化丙啶(propidium lodide,PI)、Annexin V-PI试剂、DCFH-DA(10 μmol/L)溶液处理细胞后,再用流式细胞仪分别检测HepG2细胞的周期、凋亡及细胞内ROS 水平。
1.2.5JC-1荧光探针检测线粒体膜电位 取对数生长期的HepG2细胞以1×105个/孔的密度接种于6孔板,放入5%CO2的37 ℃细胞培养箱培养12 h; 以终浓度为0、100、200及400 mg/L的MAF-1A处理细胞24 h,加入JC-1染色工作液混匀,37 ℃孵育20 min,不含胎牛血清的培养基洗涤3次,胰酶消化,1 000 r/min离心3 min收集细胞,流式细胞仪检测HepG2细胞线粒体膜电位。
1.3 统计学分析
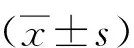
0 mg/L MAF-1A组 50 mg/L MAF-1A组 100 mg/L MAF-1A组注:黑色箭头分别表示细胞膜出芽、核固缩,凋亡小体,白色箭头分别表示染色质出现边集,胞浆固缩、空泡化。图1 不同浓度MAF-1A对HepG2细胞形态的影响(6 000×)Fig.1 Effects of different concentrations of MAF-1A on the morphology of HepG2(6 000×)
2 结果
2.1 电镜观察
透射电镜观察可见,经不同浓度的MAF-1A作用后,HepG2细胞体积较对照组缩小,细胞膜产生出芽现象,核固缩,有凋亡小体形成;染色质出现边集,胞浆固缩、空泡化;而阴性对照组细胞规则,胞膜未见形态变化,未见核固缩、胞浆浓缩等现象。见图1。
2.2 细胞周期
检测结果显示,与0 mg/L组相比,MAF-1A各浓度组中G0/G1期的HepG2细胞比例升高,差异有统计学意义(P<0.01)。见表1。
表1 不同浓度MAF-1A对HepG2细胞周期的影响Tab.1 Effects of different concentrations of MAF-1A on cell cycle of
2.3 细胞凋亡率
100、200及400 mg/L的MAF-1A作用24 h后,HepG2细胞凋亡率较0 mg/L MAF-1A组明显增大,且凋亡率随MAF-1A浓度的升高而增加(P<0.01)。见图2。
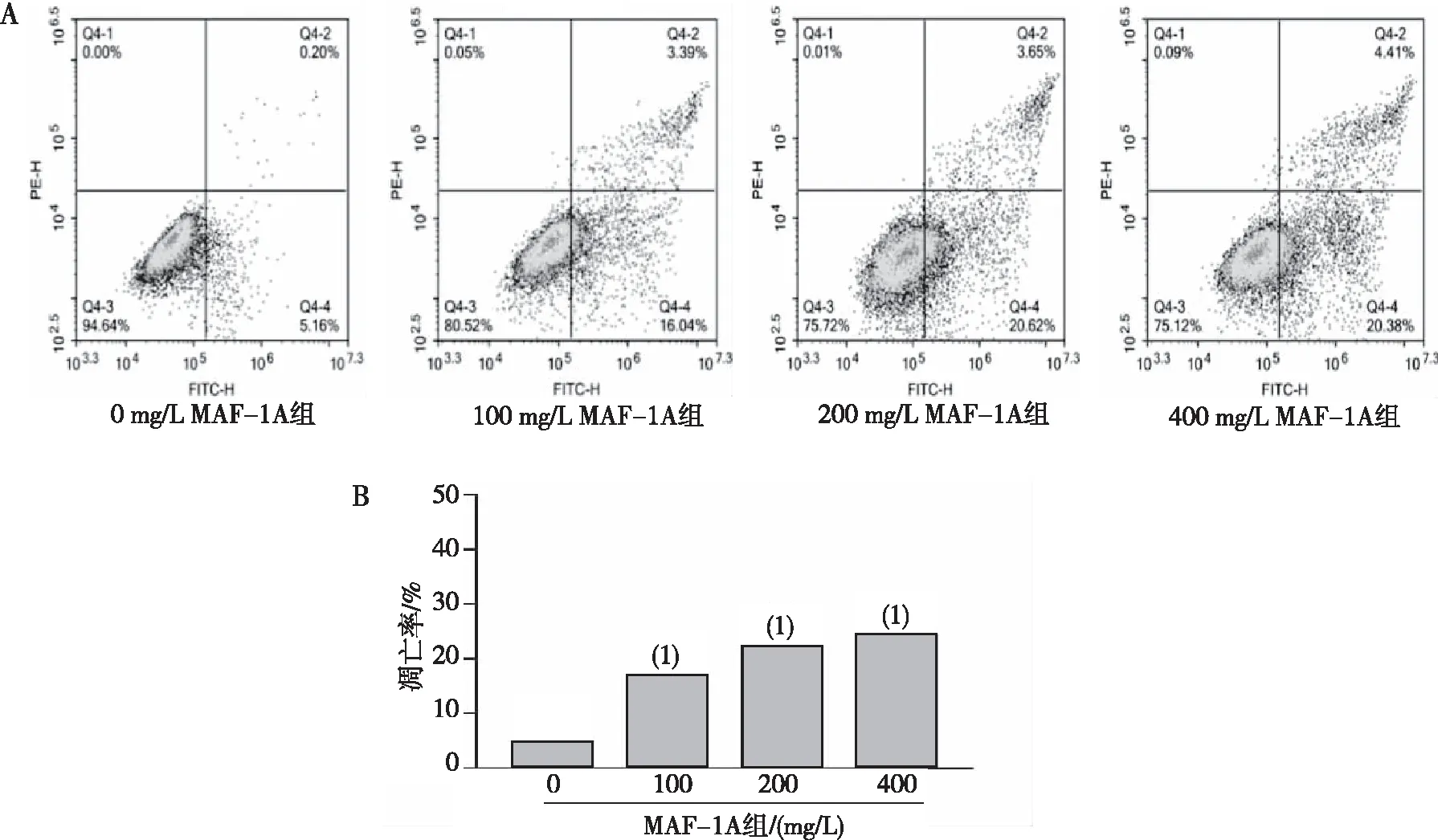
注:A为凋亡细胞检测结果,B为细胞凋亡率的定量结果;(1)与0 mg/L MAF-1A组比较,P<0.01。图2 不同浓度MAF-1A对HepG2细胞凋亡的影响Fig.2 Effects of different concentrations of MAF-1A on apoptosis of HepG2 cells
2.4 线粒体膜电位
100、200及400 mg/L 的MAF-1A分别作用24 h后,与对照组(0 mg/L组)相比,HepG2细胞的线粒体膜电位可降低,并且随着MAF-1A浓度的升高,出现线粒体膜电位下降细胞数的占比逐渐增高。见图3。
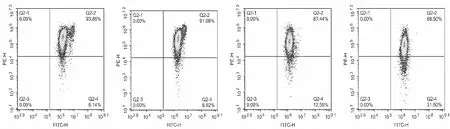
0 mg/L MAF-1A组 100 mg/L MAF-1A组 200 mg/L MAF-1A组 400 mg/L MAF-1A组注: 正常线粒体膜电位细胞分布于右上Q2-2区域,线粒体膜电位下降的细胞分布在右下Q2-4区域。图3 不同浓度MAF-1A对HepG2细胞线粒体膜电位的影响Fig.3 Effects of different concentrations of MAF-1A on mitochondrial membrane potential of HepG2 cells
2.5 ROS
结果显示,与0 mg/L MAF-1A组相比,高浓度MAF-1A(400 mg/L)组HepG2细胞内ROS水平明显升高(P<0.01),但中、低浓度MAF-1A(100和200 mg/L)组ROS水平的差异无统计学意义(P>0.05)。见图4。

注:A为细胞内ROS检测结果,B为细胞内ROS的定量表达;(1)与0 mg/L MAF-1A组比较,P<0.01。图4 不同浓度MAF-1A对HepG2细胞内ROS的影响Fig.4 Effects of different concentrations of MAF-1A on ROS in HepG2 cells
3 讨论
目前研究认为,AMPs的抗肿瘤机制包括诱导细胞凋亡、阻滞细胞周期、抗血管形成、溶膜作用及改变细胞离子通道等[14-17],其中诱导细胞凋亡是AMPs抑杀肿瘤细胞的主要机制之 一[18]。细胞调亡是细胞为更好地适应生长环境而发生的自发的程序性死亡,与肿瘤的发生、发展及治疗密切相关[19-20]。文献报道,细胞在调亡过程中可出现细胞膜皱缩、细胞膜出芽、细胞核边集、细胞器的碎片及染色质的固缩或碎片等特征性的形态学变化[21-22]。本研究的透射电镜检测结果显示,HepG2细胞经MAF-1A作用后,产生了染色质聚集或边集,核固缩,形成凋亡小体等细胞凋亡的特征性变化,提示MAF-1A抑制肿瘤活性机制作用可能与细胞凋亡相关;进一步通过流式细胞术检测细胞凋亡率发现,不同浓度MAF-1A均可促进HepG2细胞的凋亡,且浓度越高,细胞凋亡率越大(P<0.01),表明MAF-1A可诱导HepG2细胞凋亡的发生,提示MAF-1A可以通过诱导HepG2细胞凋亡,从而抑制HepG2细胞的增殖。
细胞凋亡过程受多条信号转导通路的调节,随着对凋亡机制研究的深入,普遍认为线粒体是介导细胞凋亡的执行者,而线粒体膜电位降低是细胞发生凋亡最早期的变化,一旦线粒体膜电位出现降低,细胞进入凋亡程序[23]。有研究认为,ROS是细胞新陈代谢的产物,在细胞凋亡的发生发展过程中起着重要的作用[24]。文献报道,Cecropin A及Tomentosin可通过下调线粒体膜电位和增加细胞内ROS含量诱导HeLa细胞凋亡[25]。本实验研究结果显示,在MAF-1A作用下 HepG2细胞线粒体膜电位降低,且高浓度MAF-1A(400 mg/L)组HepG2细胞内的ROS水平明显升高,表明MAF-1A可以下调HepG2细胞的线粒体膜电位,并且在一定浓度下可诱导细胞内ROS大量产生,提示下调线粒体膜电位及促进细胞内ROS的产生可能是MAF-1A诱导 HepG2 细胞凋亡的原因。
通常认为肿瘤细胞的细胞周期包括2个时期,即有丝分裂间期和有丝分裂期(M期)[26]。有丝分裂间期又可划分为DNA合成前期(G1期)、DNA合成期(S期)和DNA合成后期(G2期),细胞还未进入分裂期时,处于静止的状态称G0期[27]。研究发现,当肿瘤细胞周期中的任何一个时期受到阻滞,可以导致肿瘤细胞增殖受阻[28]。实验研究报道,来源于蜘蛛的毒液肽可通过阻滞细胞周期、诱导细胞凋亡,从而抑制HeLa细胞的生长[29]。本研究的细胞周期检测结果显示,不同浓度的MAF-1A均能使HepG2的G0/G1期细胞所占比例升高(P<0.01),表明MAF-1A可将细胞周期阻滞于G0/G1期。
综上所述,本研究认为MAF-1A可能通过促进线粒体膜电位下调、增加细胞内ROS含量所介导的细胞凋亡,以及阻滞细胞周期来发挥抑制HepG2细胞的作用。
