超声引导下激光消融术治疗乳腺纤维腺瘤的效果研究
2021-03-12周文斌巩海燕
王 慧, 周文斌, 邓 晶, 李 沁, 巩海燕
(南京医科大学第一附属医院, 1. 超声诊断科, 2. 乳腺外科, 江苏 南京, 210029)
乳腺纤维腺瘤是女性最常见的乳腺良性肿瘤,由腺上皮和纤维组织组成,好发于20~25岁女性[1]。研究[2]表明,该病与年轻女性卵巢分泌功能旺盛、体内雌激素水平较高有关。既往研究[3-4]表明,乳腺腺体组织对雌激素敏感性较高或体内雌激素分泌水平较高而导致间质成分和导管上皮成分异常增殖,从而促进纤维腺瘤的形成。既往临床治疗乳腺纤维腺瘤多采用开放手术和微创手术[5]。KOVATCHEVA R等[6]发现超声引导高强度聚焦超声治疗乳腺纤维腺瘤效果显著。GOLATTA M等[7]采取冰冻术治疗乳腺纤维腺瘤。KERBAGE Y等[8]采取激光消融术治疗乳腺纤维腺瘤患者。本研究探讨激光消融术治疗乳腺纤维腺瘤的价值,现将结果报告如下。
1 资料与方法
1.1 一般资料
选取2018年1—8月在本院就诊的乳腺纤维腺瘤患者15例,病灶15个,所有病灶均经病理检查证实为乳腺纤维腺瘤; 年龄25~39岁,平均(31.4±4.4)岁; 所有患者术前均行血常规、凝血功能、心电图、肝功能及肾功能检查,并签署激光治疗知情同意书。激光消融术前及实施消融术1周后,采用常规超声及超声造影检查病灶情况。
1.2 仪器与方法
应用Echo Laser集成激光介入超声系统(Nd: YAG激光,波长1 064.0 nm, Elesta, Florence, Italy)。Esaote MyLab Twice超声诊断仪,探头频率4.0~13.0 MHz。造影剂为意大利Bracco公司生产的Sonovue。
常规超声检查: 探头型号LA523。患者取仰卧位,充分暴露双乳及腋窝,以乳头为中心行放射状扫描检查。记录肿块的位置、大小、形态、内部回声、边缘及血流情况。
超声造影检查: 造影剂为意大利Bracco公司生产的Sonovue干粉剂,加入5.0 mL生理盐水制成六氟化硫混悬液,充分摇匀。切换至造影模式,探头型号LA522, 经肘静脉注射Sonovue 2.4 mL, 启动造影模式,存储动态图像。
激光消融术: 激光消融过程监测使用线阵探头,频率4.0~13.0 MHz。消融采用长度12.0 cm、直径0.3 cm的短光纤。病灶处消毒,局部注射2%利多卡因5.0~10.0 mL, 超声引导下将套管针穿刺进入病灶处,退套管针,导入光纤。启动激光设备,设定单根光纤输出功率4 W为启始激光消融的能量。激光治疗结束后,退出光纤。整个激光消融过程在超声诊断仪的监测下进行。
1.3 图像分析
对超声造影(CEUS)图像进行评分,标准[9]如下: ① 病灶内没有增强,有环状增强。② 病变与周围组织存在等同和同步增强,在CEUS图像中没有清晰的轮廓。③ 与周围组织相比,病变表现出早期增强,均匀或异质,具有明显边缘(偶尔具有环状增强),病变大小几乎等于或小于2D图像中显示的大小,病变的形状是规则的。④ 病变显示早于周围组织的增强,周围组织通常是异质的。CEUS图像中病变的大小大于2D图像中的病变大小,但病变仍然显示出明显的边缘,在病变中有或没有灌注缺陷,没有“蟹爪”状增强,病变的形状总是不规则的。⑤ 病变是异质增强的,其尺寸大于相应的2D图像,可观察到早期的增强,可能存在或不存在灌注缺陷,并且边缘不清的典型“蟹爪”状增强较为明显。
1.4 统计学处理
2 结 果
15例患者病灶显示,最大径均小于2.0 cm, 其中3例为1.0 cm, 6例为1.1~1.5 cm, 6例为1.6~2.0 cm。激光消融术前的病灶常规超声检查结果呈均匀低回声,边界清楚,包膜光整, Alder血流分级0级6例, Ⅰ级6例, Ⅲ级3例; 激光消融术后病灶常规超声呈不均匀回声,边界欠清晰,包膜不光整, Alder血流0级9例, Ⅰ级3例, Ⅱ级3例。激光消融术前病灶CEUS评分2分12例,3分3例,增强影像体积为(1258.4±755.0) mm3; 激光消融术1周后病灶CEUS显示均无造影剂残留, CEUS评分为1分,无增强范围较术前病灶范围增大,增强影像体积为(4 157.6±682.0) mm3, 差异有统计学意义(P<0.05)。见图1。
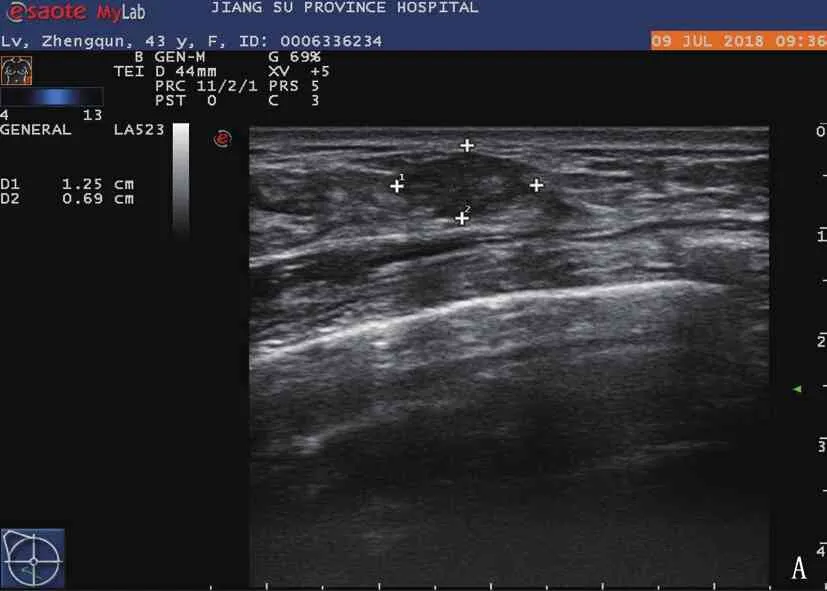
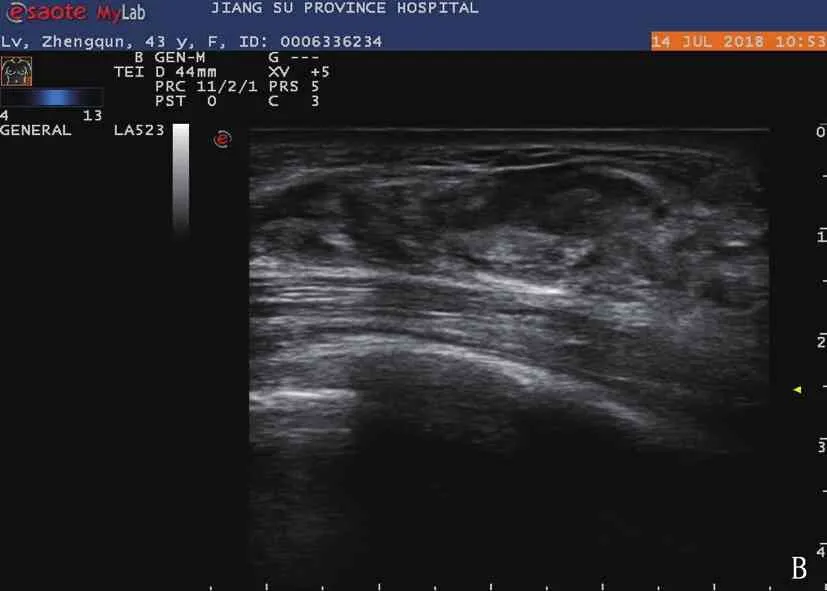
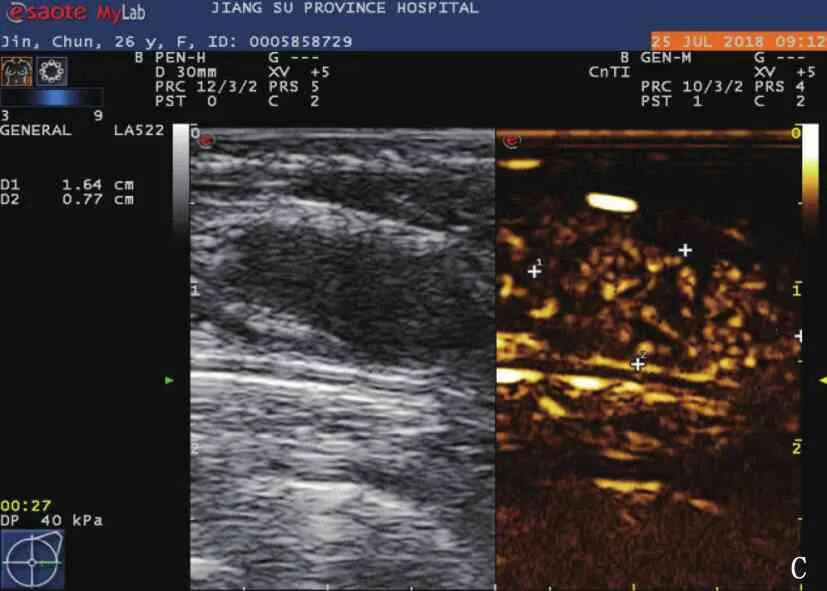


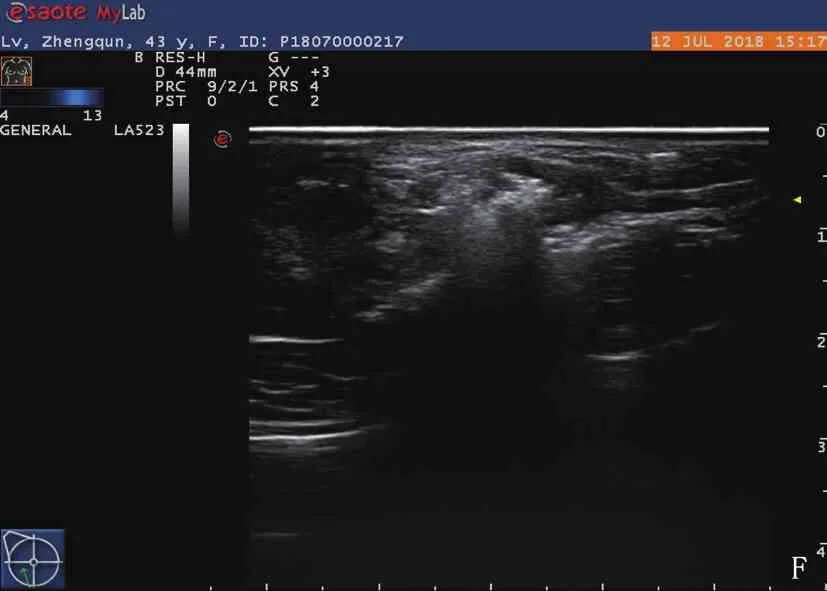
A: 激光消融术前常规超声显示右乳肿块呈低回声,与周围组织分界清晰; B: 激光消融术后常规超声显示该右乳肿块呈不均匀回声,与周围组织无明显界限; C: 激光消融术前超声造影显示左乳肿块呈均匀高增强; D: 激光消融1周后超声造影显示左乳肿块呈无增强,范围增大; E: 超声显示激光消融术前光纤进入病灶; F: 超声显示激光消融术中低回声病灶内部被强回声占据。
3 讨 论
乳腺疾病是威胁女性健康的常见疾病,而乳腺纤维腺瘤又是女性最常见的乳腺良性肿瘤[10]。乳腺纤维腺瘤的病因包括体内雌激素水平相对或绝对升高、局部乳腺组织对雌激素的敏感性增强、高糖高脂饮食、遗传因素、免疫抑制剂的使用等。乳腺纤维腺瘤好发于年轻女性,外上象限多见,患者多于体检或自己无意间触及乳房肿块来院就诊时发现,肿块一般无明显压痛[11-12]。乳腺纤维腺瘤超声表现有: 腺体层内可探及均质的低回声包块; 形态规则,圆形或椭圆形; 包膜纤细完整,与周围组织分界清晰; 后方回声无衰减或有轻度增强; 内部血流不丰富,Alder分级以0、Ⅰ级多见,Ⅱ、Ⅲ级少见; 血管走行自然、规则,无粗大扭曲血管、穿支血管。
目前,乳腺纤维腺瘤的治疗方法包括手术切除和非手术切除,非手术切除主要包括射频消融、微波消融、超声聚焦、冷冻治疗等[13]。射频消融的原理是利用高温使靶组织及其周边小范围区域蛋白质迅速发生变性,病灶区加热到有效治疗温度时可维持一段时间以灭活肿瘤细胞,最终形成瘢痕组织,之后被部分或完全吸收[14]。射频消融的消融范围和功率均较大,在浅表肿瘤尤其是小病灶的应用受到限制[15]。超声高强度聚焦在临床上广泛应用于乳腺癌、肝癌、肾癌及前列腺癌等治疗中,但在乳腺纤维腺瘤中的应用有限[16-17]。激光消融是利用光能聚焦发热使组织产生凝固、碳化及气化形成空腔,对1 cm以下病灶的激光消融效果最好[18-19]。超声引导下激光消融能清晰显示纤维腺瘤的位置、大小、形态、距离皮肤的距离、穿刺的针道,可保证治疗的安全性和有效性[20]。
激光消融过程中,病灶处产生气体样强回声,光纤治疗头末端发射的激光能量传输距离为1 cm, 理论上激光消融对直径≤1 cm病灶的治疗效果最佳。超声监测显示激光消融过程中8~10 s时肿块中心出现强回声, 150~200 s时肿块中心可见放射状的强回声条纹向周围辐射,这是微气泡的作用[21], 300 s时强回声占据了整个肿块。治疗后即刻,超声显示强回声占据了整个病灶,周围可见3~5 mm低回声晕环。激光消融过程中局部会有发热的感觉,随着治疗的结束,热感会逐渐消退,这可能是因为血管对乳腺周围实质的散热作用,这种作用不会出现在恶性肿瘤中[22]。本研究发现, 6例最大直径在1.6~2.0 cm的病灶经激光治疗1周后超声造影显示无造影剂残留,病灶吸收能量后组织的微血管凝固并发生缺血性损伤,病灶完全被破坏[23]。
本研究结果显示,激光消融治疗后,常规超声显示原病灶处呈强弱不均匀回声,内部血流不明显或呈星点状; 病灶与周围组织分界欠清晰,范围增大。这是由于激光消融治疗后病灶周边形成炎性反应带,细胞组织水肿,大量淋巴细胞和中性粒细胞聚集。超声造影是纯血池显像,反映了病变处的微血管灌注[24]。造影剂六氟化硫是一种特殊的微泡,进入血液循环后,在超声波的作用下被破坏,瞬间产生强烈回波信号,在检测微弱血流信号时,较常规超声更为敏感,可有效评估治疗效果。本研究结果显示,激光消融后1周时,超声造影检查发现病灶区域无造影剂残留,呈无增强,微血管凝固坏死,提示病灶被破坏,治疗效果显著。激光消融过程中,细胞死亡过程长达72 h[25]。
本研究的不足有: ① 本研究随访周期较短,仅随访了激光消融1周后的常规超声和超声造影表现,对于后续的常规超声及超声造影表现缺乏跟踪; ② 本研究患者年龄均在40岁以下,因为临床上40岁以上纤维腺瘤患者多采用手术切除; ③ 激光消融对年龄较大的纤维腺瘤患者的疗效有待研究; ④ 本研究的病灶最大径在2 cm以下,使用的是单根光纤,对于体积较大的病灶是否可以使用多根光纤进行激光消融仍有待进一步研究。
综上所述,激光消融术具有操作简单、创伤小、风险低、术后恢复快等优点,可实现对纤维腺瘤的原位破坏,在乳腺纤维腺瘤治疗中有一定的效果。超声造影技术具有操作简单、可重复性强、无电离辐射等优势,可用于激光消融后疗效的评估。
