连续4年施用生物炭对植烟褐土微生物群落结构的影响
2021-03-12殷全玉刘健豪刘国顺杨欣铃李小福张玉兰李阳叶红朝
殷全玉, 刘健豪, 刘国顺, 杨欣铃, 李小福,张玉兰, 李阳, 叶红朝
(1.河南农业大学烟草学院, 郑州 450002; 2.河南中烟工业有限责任公司技术中心, 郑州 450000; 3.河南省烟草公司洛阳市公司, 河南 洛阳 471000)
生物炭是由生物质原料(动物骨骼及残骸、植物残体、农作物废弃物等)在缺氧或无氧的条件下经相对较低的温度(一般不超过700 ℃)热裂形成的高稳定性的富含碳的物质[1]。由于生物炭在有机废弃物资源化、土壤改良、肥料创新和温室气体减排等方面具有重要意义,近年来被广泛研究[2]。生物炭自身多孔、表面积较大,含有较多碳源的性质,能为土壤微生物提供优良的生存空间和营养物质,直接影响微生物生长,也可以通过施入土壤改变土壤各项理化性质(水分、肥力、pH、CEC、EC等)来改变土壤资源储备、土壤非生命成分及固定土壤污染物等方面,间接影响土壤微生物的生活[3]。
生物炭近年来被广泛应用于土壤改良和修复,而微生物作为土壤的重要组成部分,其自身生长代谢的影响受生物炭的影响,在一定水平上反映了生物炭对土壤质量的影响效果[4-5]。生物炭对土壤微生物活性和群落结构组成的改变往往与试验条件、生物炭自身性质、土壤质地及肥力水平等密切相关[6]。已有研究表明,不同原材料(如废弃物[7]、木材[8]、作物秸秆[9]等)对土壤微生物的影响差异显著,这是由于原材料不同的生物炭其自身结构、组分不同,常会被不同的微生物群体所利用[10]。土壤类型也是影响生物炭对土壤微生物作用的重要因素[11],由于我国面积广阔,土壤类型不一,生物炭对不同土壤的影响效果也不同。如生物炭在黑土和红壤中微生物量和群落结构特征影响效果相反[12],在灰漠土和风沙土上对微生物多样性也有差异[13]。适宜的生物炭用量可以促进作物生长,然而过量的生物炭对作物生产不利,且对微生物产生毒性[3,14],如何确定合适的生物炭量来修复土壤,维持土壤微生物环境稳定十分必要。
褐土是华北平原主要的耕地土壤之一,但多分布于丘陵山地,土壤侵蚀现象严峻,具有有机质含量偏低,保肥保水性能较差等特点[15]。目前生物炭对于土壤的修复研究多为短期实验,而关于长期施用生物炭对褐土土壤微生物影响的报道尚不多见。本试验因地制宜,利用当地主要作物花生壳为生物炭原料,通过4年的定位试验,并利用高通量技术检测土壤微生物的主要特征结构,为确定长期使用花生壳生物炭改良褐土微生物群落结构提供支撑。
1 材料和方法
1.1 试验材料
试验于2014—2017年在河南农业大学许昌校区现代烟草农业科教园区(北纬34°01′,东经113°49′)进行,供试土壤类型为褐土,质地中壤,有机质含量12.77 g·kg-1,碱解氮含量81.6 mg·kg-1,速效磷含量14.4 mg·kg-1,速效钾含量61.22 mg·kg-1,pH 7.56。供试生物炭是由河南惠农土质保育研发有限公司提供的在350 ℃条件下加工成的花生壳生物炭,其理化性状如表1所示。供试烟草品种为K326,由本实验室保存。

表1 花生壳生物炭理化性质Table 1 Physicochemical properties of peanut shell biocharcoal.
1.2 试验设计
2014年设4个处理,分别是CK(30 kg·hm-2纯氮)、B1.5(1.5 t·hm-2生物炭+30 kg·hm-2纯氮)、B15(15 t·hm-2生物炭+30 kg·hm-2纯氮),B45(45 t·hm-2生物炭+30 kg·hm-2纯氮),每个处理占地面积333 m2(33.3 m×10 m),设三次重复,采用完全随机区组设计,分为三个小区,每年3月中旬撒施生物炭,4月下旬起垄施化肥,5月1日移栽烟苗,9月底烟叶采收结束,拔除烟杆,犁地耙平,至第二年3月再撒施生物炭。除生物炭用量外,其他田间措施保持一致。
1.3 样品采集
于2018年3月中旬施炭前采集0—20 cm土壤样品,每个小区采用 5 点法取土后混匀,共12个样品,用冰盒带回实验室,每个样品分为2份,其中一份置于-80 ℃冰箱内保存,用于提取土壤DNA,分析微生物多样性;另一份样品室内晾干、过筛,用于土壤基础肥力测试。
1.4 指标测定及分析方法
1.4.1土壤理化指标分析方法 全氮、全炭用全自动CN分析仪(vario MAX CN,德国)测定;硝态氮和铵态氮用全自动化学分析仪(Smartchem140,意大利)测定;土壤pH采用电位法(ZD-型酸度计);有机质采用紫外分光光度法;速效磷含量采用0.5 mol·L-1NaHCO3浸提-钼锑抗比色法;速效钾含量采用NH4OAc浸提-火焰光度计法,碱解氮用全自动化学分析仪(Smartchem140,意大利)测定[16]。
1.4.2土壤样品DNA提取、扩增与测序 本试验将冻存的土壤样品用干冰包装后送至北京诺禾致源生物信息科技有限公司提取样品总DNA,以土壤总DNA为模板,以515F(5′-GTGCCAGCMGC-CGCGGTAA-3′) 和 806R(5′-GGACTACHVGGGT-WTCTAAT-3′)为引物扩增细菌16S V3-V4区DNA序列,以3F(5′-GGAAGTAAAAGTCGTAAC-AAGG-3′) 和4R(5′-GCTGCGTTCTTCATCGAT-GC-3′)为引物扩增真菌ITS1区DNA序列,利用New England Biolabs 公司的NEB Next©UltraTMDNA Library Prep Kit for Illumina构建文库,使用HISeq(HISeq PE300,美国)测序。
1.4.3数据分析方法 使用Cutadapt(V1.9.1)、UCHIME Algorithm对序列进行阅读、处理,去除嵌合体序列得到最终的有效数据。利用Uparse 软件(Uparse v7.0.1001)以97%的相似性将序列聚类,并与SSUrRNA数据库进行比对分析。
使用Qiime软件(Version 1.9.1)计算Chao1、Shannon、Simpson、ACE指数,PCA分析、RDA分析、mantel text检验均使用R软件分析,使用SPSS 22软件进行单因素方差分析与Pearson相关性分析。试验数据处理用 Microsoft Excel 2016 进行整理。
2 结果与分析
2.1 生物炭对植烟褐土理化特性的影响
如表2所示,与对照相比,施用生物炭各处理均显著提高各处理土壤速效磷、速效钾、有机质、pH和含水率,显著降低了土壤容重。随着生物炭量的不断提高,土壤速效钾、有机质、pH和含水率均不断升高,速效磷含量先降低后升高,土壤容重不断降低,且不同处理间各项指标存在显著性差异。T2处理显著提高了土壤铵态氮含量,但其他处理对土壤硝态氮、铵态氮影响均不显著。综上,施用生物炭后土壤的理化性质发生显著改变,且各项指标变化趋势均反映出土壤质量有所提高,不同生物炭量间对土壤理化性质的影响也有不同,其中T2、T3处理效果较好。
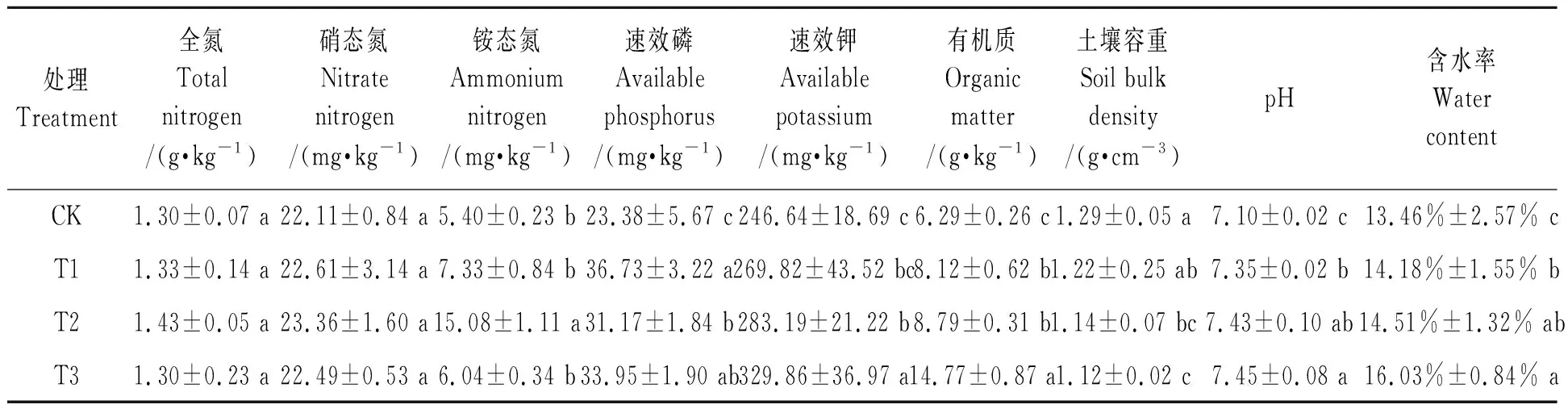
表2 植烟褐土理化特性Table 2 Physicochemical properties of tobacco-growing cinnamon soil.
2.2 样品测序结果分析
各处理样品覆盖度均在97%以上,稀释曲线(图1)已趋于平稳,能够反映样本的真实情况。
共测得细菌16S rRNA基因序列850 439条,每个样品平均序列70 870条。经过对序列进行聚类划分后得到OTU数为4 905,分别归类于47门、51纲、112目、196科、417属、253种。
真菌18S rRNA基因序列985 622条,每个样品平均序列82 135条。经过对序列进行聚类划分后得到OTU数为2 152,分别归类于14门、38纲、85目、156科、254属、263种。
各处理间细菌、真菌OTU数与α多样性指数(表3)均无显著性差异,说明施用生物炭对土壤微生物多样性影响不显著。
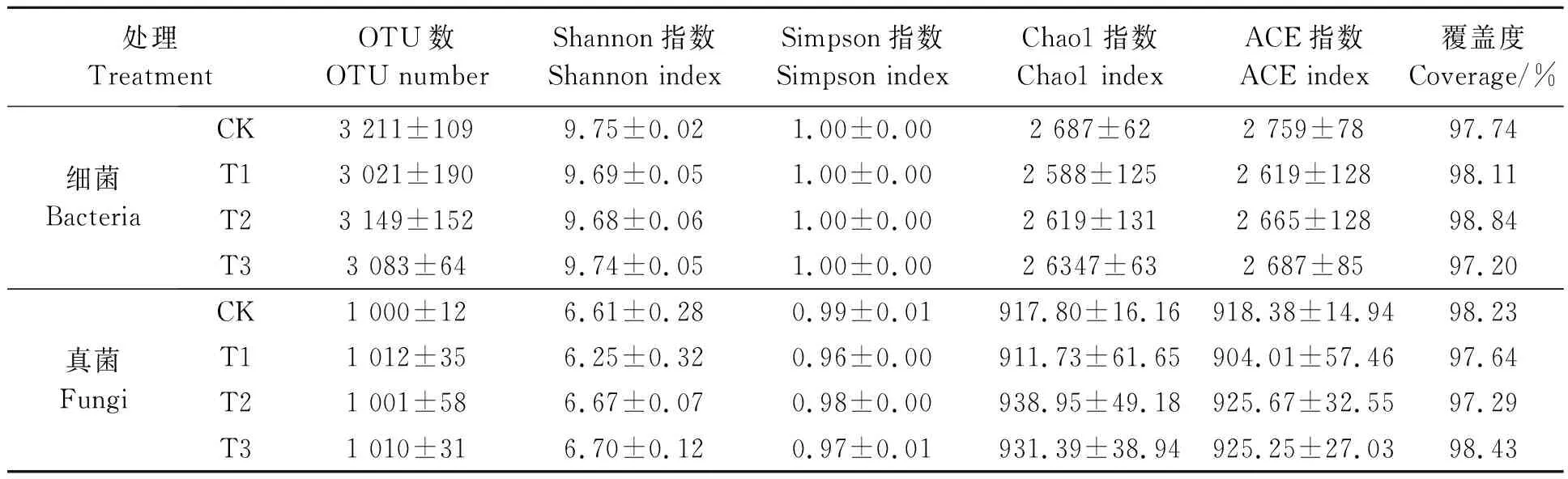
表3 测序结果及α多样性指数表Table 3 Sequencing results and alpha diversity index table
2.3 生物炭对优势菌群相对丰度的影响
图2中,变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)为优势细菌,共占细菌OTU总量的81.62%,各菌种相对丰度分别为28.52%、21.84%、13.24%、11.34%、6.68%。
图2中,子囊菌门(Ascomycota)、被孢霉菌门(Mortierellomycota)、担子菌门(Basidiomycota)为优势真菌,共占真菌OTU总量的50.77%,各菌种相对丰度分别为34.87%、8.30%、7.60%。
与对照处理相比,T2处理对优势细菌、真菌相对丰度影响最为显著,其变形菌门、放线菌门、绿弯菌门、子囊菌门的相对丰度显著提高, 酸杆菌门、拟杆菌门的相对丰度显著降低。T1处理显著降低了子囊菌门的相对丰度,其他处理对菌群影响均不显著。说明适量生物炭对土壤优势菌群影响效果显著,但用量过高或过低对土壤优势菌群影响效果较弱。
2.4 生物炭对群落结构的影响
PCA分析(图3)中,细菌第一、二主成分的方差贡献率分别为14.66、12.09%,真菌第一、二主成分的方差贡献率分别为13.26%、11.08%。各处理所含样品点大多分布较近,且不同处理间有明显的分离现象。说明生物炭改变了土壤细菌、真菌群落结构分布,且不同生物炭量间群落结构也存在差异,低生物炭量对细菌群落结构影响较小,对真菌群落结构影响较大,随着生物炭量的提高,细菌群落结构差异不断增大,而真菌群落结构差异先增大后减小。
2.5 环境因子与不同施炭量下微生物群落的冗余分析
从图4可以看出,细菌RDA分析中第一、二排序轴解释量分别为26.15%、20.19%,真菌RDA分析中第一、二排序轴解释量分别为24.07%、15.58%。各处理均位于不同区域,也表明不同处理群落结构存在差异,不同土壤理化指标指向了不同处理,速效钾、有机质、含水率与T3处理有较强相关性,全氮、铵态氮与T2处理有较强相关性,说明不同土壤理化指标在不同处理下的对微生物群落结构的影响效果并不相同。
2.6 各环境因子与优势菌群相关性分析
2.6.1土壤环境因子与细菌和真菌群落结构相关性分析 由Mantel text检验结果(表4)来看,土壤全氮(r=0.670 1,P=0.001)、铵态氮含量(r=0.740 2,P=0.001)与细菌群落结构有极显著相关关系。土壤铵态氮含量(r=0.283 3,P=0.039)、速效钾(r=0.262 3,P=0.049)、土壤容重(r=0.268 4,P=0.034)与真菌群落结构有显著相关关系。说明氮素含量是影响土壤细菌群落结构的主要因素,而真菌则与土壤多项理化指标影响有关。
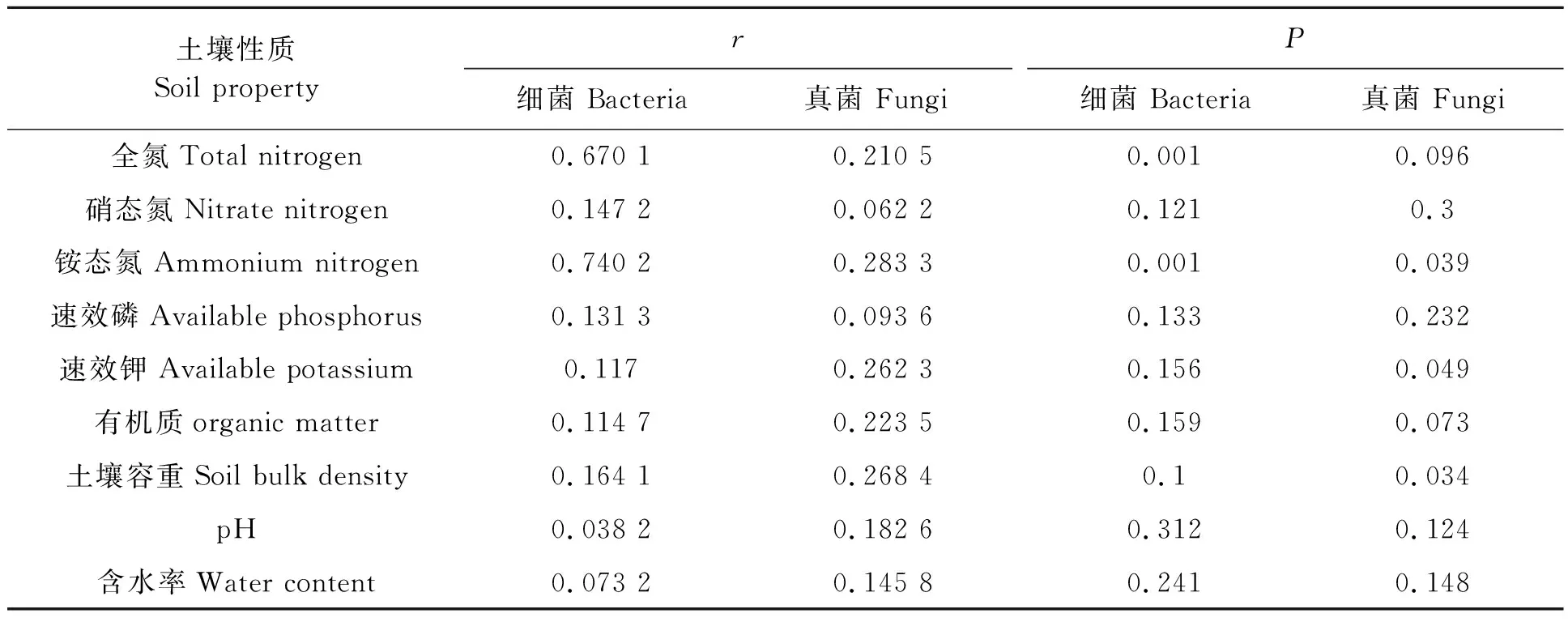
表4 土壤环境因子与细菌和真菌群落结构相关性Table 4 Mantel test of correlation between soil environmental factors and community structure of bacteria and fungi
2.6.2优势菌群与土壤理化性质相关性分析
由皮尔逊相关性分析(表5)表明,Acidobacteria与土壤全氮、铵态氮显著负相关。Actinobacteria与土壤全氮、铵态氮显著正相关。Chloroflexi与土壤全氮、硝态氮显著正相关。Ascomycota与土壤铵态氮、pH显著正相关,与土壤容重显著负相关。Mortierellomycota与土壤容重显著负相关。说明土壤中优势细菌相对丰度主要与土壤全氮、铵态氮含量有显著关系,而优势真菌则受多种土壤理化性质影响,这也与Mantel text检验(表4)结果一致。综上,土壤理化性质与土壤优势细菌、真菌相对丰度以及群落结构密切相关,土壤理化性质的改变能引起土壤优势细菌、真菌相对丰度以及群落结构发生改变。
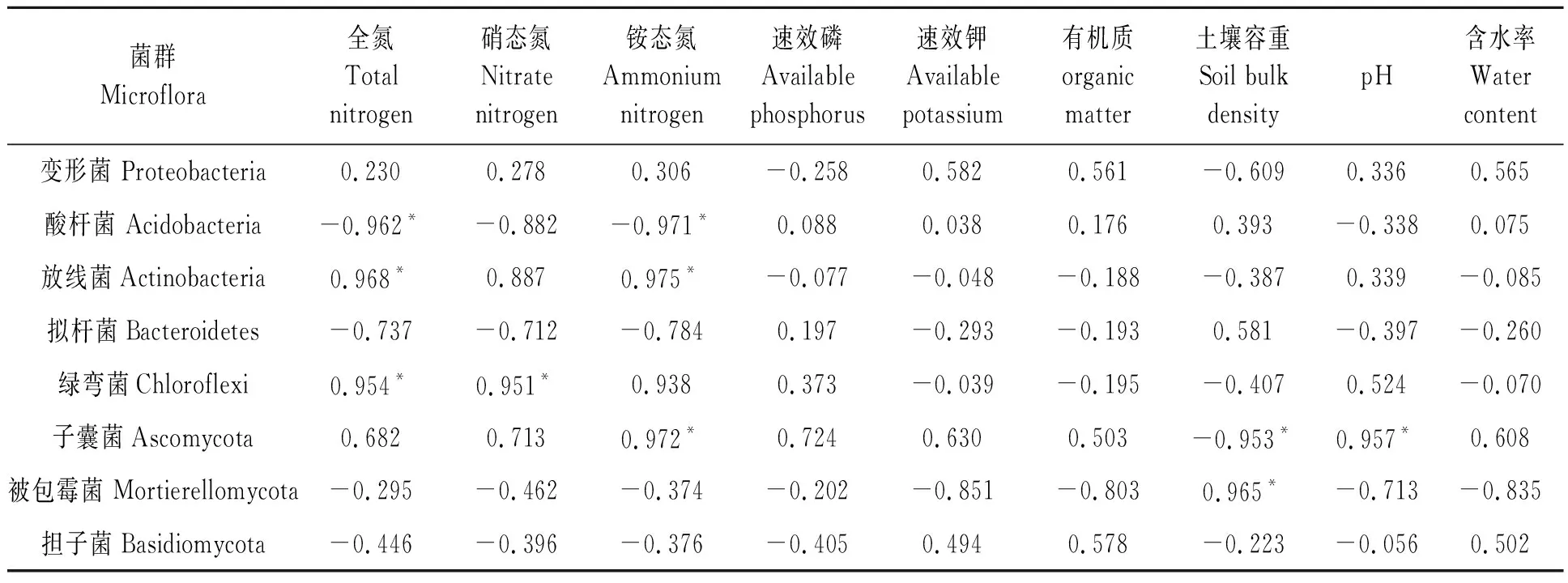
表5 优势菌群与土壤理化性质相关性Table 5 Correlation between dominant microflora and soil physical and chemical properties
3 讨论
3.1 生物炭对土壤理化性质的影响
施用生物炭较对照显著提高了土壤有机质含量,土壤有机质中含有的大量营养元素矿化后可以被微生物利用,从而促进微生物的生长,同时有助于土壤质量的提高,土壤有机碳作为土壤有机质的重要组成部分,对土壤肥力和作物产量至关重要[14]。而生物炭作为富含碳的物质,施入土壤后有助于提高土壤碳含量,从而提高土壤有机质含量。已有研究结果表明,不同生物炭量间对土壤(水稻土、紫土)有机碳影响存在差异[17],而本研究也证明在褐土中,不同生物炭量对土壤有机质影响差异显著,而确定最佳的生物炭量是提高土壤质量的关键。生物炭对土壤pH影响并不显著。这可能与试验地植烟前pH较高有关,杨铁钊等[18]提出,生物炭作为碱性物质可以直接提高土壤pH,但对于碱性土壤影响并不显著,这与本文研究结果一致。生物炭施入土壤显著改变了土壤铵态氮含量,这是由于生物炭可以提高土壤氮肥利用率,同时,生物炭自身较强的阳离子交换能力对土壤中铵态氮具有强烈的吸附作用从而提高土壤中铵态氮含量[19]。
3.2 生物炭对细菌多样性的影响
细菌通常以群落的形式存在,细菌群落结构主要指群落中细菌种群的种类和丰度[20]。本研究结果表明,施用生物炭及不同生物炭量较对照对土壤细菌OTU数量和α多样性指数影响不显著。这主要是由于生物炭自身结构较稳定,其含有的大量芳香烃不易被分解,对土壤微生物影响较缓慢[21]。有研究指出,生物炭对土壤细菌多样性的影响效果具有高度的时间依赖性,新应用生物炭时可以短暂提高细菌多样性和丰度,而随着时间的推移以及重复添加生物炭对细菌群落影响较小[22],本研究距初次施用生物炭已过5年,也印证了重复添加生物炭对土壤细菌α多样性指数影响不大。PCA分析结果显示,与对照相比,施用生物炭后各处理间细菌群落结构存在差异,且差异随着施用生物炭量的提高而提高,说明施用生物炭和不同生物炭量间均能影响细菌群落结构组成。结合本研究RDA分析与Mantel text分析结果来看,土壤全氮、铵态氮是影响细菌群落结构的主要因素。生物炭对土壤微生物的影响主要通过改善土壤理化性质以及自身结构为微生物提供生存环境两方面发挥作用[23],上述结果中提高生物炭显著提高了土壤铵态氮含量,说明在氮素用量不变的条件下,生物炭可以通过改善土壤氮素利用率和提高土壤铵态氮含量来影响细菌群落结构。从门水平优势细菌相对丰度来看,15 t·hm-2处理对优势细菌相对丰度影响显著,变形菌门、放线菌门、绿弯菌门的相对丰度显著提升,酸杆菌门、拟杆菌门的相对丰度显著降低,这可能是由于不同菌群对生物炭的利用能力以及环境因素造成的,放线菌门可以有效地降解生物炭中复杂的芳香类化合物,从而获取更多能量生长繁殖[24]。酸杆菌门是嗜酸性细菌,酸性土壤环境有利于酸杆菌门的代谢活动,生物炭作为碱性物质施入土壤可以提高土壤pH,从而抑制了酸杆菌的相对丰度,而酸杆菌门相对丰度降低是土壤质量提高的信号标志[25-26]。变形菌门的丰度变化规律不同,这可能是由于取材的条件差异和植物根际分泌物的影响[27-28]。陈泽斌等[27]的取土部位为根际土,待烤烟成熟期取样,而本试验的取土时间为移栽前,根系生长尚不完全,烟草根系分泌物影响不显著。也可进一步说明,随着烟株生长,其根系分泌物抑制了变形菌门的生长。绿弯菌门相对丰度提高可以固定土壤碳氮,防止土壤养分流失[29]。结合本研究结果来看,酸杆菌门、放线菌门、绿弯菌门与土壤氮素含量存在显著相关关系,施用生物炭对优势细菌相对丰度的影响对土壤质量提升有一定的促进作用。
3.3 生物炭对真菌多样性的影响
本研究结果表明,施用生物炭及不同生物炭量较对照对土壤真菌OTU数量和α多样性指数影响不显著,这与Lucheta等[30]和阎海涛等[31]研究结果一致。真菌在土壤中大多为分解者,对生物炭中顽固性碳利用能力较强[32],但固性碳性质较稳定,需要一定的时间来分解,结合阎海涛等[31]和Yao 等[33]的研究结果来看,施用生物炭3~5年对土壤真菌α多样性指数影响不显著,还需更多的研究结果来验证生物炭对土壤真菌的影响作用。PCA分析结果显示,与对照相比,施用生物炭后各处理间真菌群落结构存在差异,低生物炭量对真菌群落结构影响较大,随着生物炭量的增加,群落结构差异先增大后减小,表明生物炭量对真菌群落的影响在本试验出来中存在阀值,以致于过高的生物炭量对真菌的影响并不能达到最高。RDA分析与Mantel text分析结果表明,土壤铵态氮含量、速效钾、土壤容重是影响真菌群落结构的主要因子,这与陈坤等[34]研究结果相近,其中土壤容重作为土壤微生物影响的主要因子报道较少,土壤容重的改善与生物炭的特性密切相关,有助于种子的萌发和植物根系的生长[35],本研究施用生物炭后土壤容重显著降低,表明生物炭可以通过降低土壤容重影响真菌微生物群落结构。从门水平优势真菌相对丰度来看,15 t·hm-2处理显著提高了子囊菌门的相对丰度,其他处理对优势真菌相对丰度影响不大,相关性分析结果显示,子囊菌门与铵态氮、pH呈显著正相关关系,与土壤容重呈显著负相关关系,施用生物炭后显著了提高了土壤铵态氮、pH,降低了土壤容重,有利于提高子囊菌门相对丰度。子囊菌门多为腐生菌,可产生抗生素、有机酸、激素、维生素等有益于作物生长,也对分解植物残体和降解土壤有机质具有重要作用[36-37],子囊菌门下的丛赤壳科(Nectricaceae)菌多属于菌生真菌,可以寄生病原真菌[38]此外还有Incertaesedis 27、毛球壳科(Lasiosphaeriaceae)、假散囊菌科(Pseud-eurotiaceae)可能促进土壤中有机物质分解,从而间接促进植株根系生长[39],说明施入生物炭使子囊菌门丰度升高有利于土壤质量。本试验中另一优势真菌被孢霉菌门能分解土壤中的糖类和简单多糖物质,是土壤中有机质和养分含量丰富的标志类群[13]。总体来说,施用生物炭对优势真菌相对丰度影响效果并不明显,表明真菌受生物炭影响效果比细菌小,具体原因还需要今后更深入的研究。
