东方百合‘索邦’的离体培养研究
2021-03-12贾明良方荷芳李同建文锋韩兴杰金洪光徐玲玲廖亮
贾明良, 方荷芳, 李同建, 文锋, 韩兴杰, 金洪光,徐玲玲, 廖亮
(九江学院药学与生命科学学院, 江西 九江 332000)
百合为百合科百合属的多年生观赏植物,其品种丰富,花色多样,具有非常高的观赏价值。东方百合‘索邦’为百合切花市场的知名品种。我国市场的百合鲜切花种源主要有进口和国产两个来源,但国产种球的切花品质要低于进口种球,究其原因,种球质量是其中的重要因素[1]。虽有研究表明,可以通过高山繁育技术来解决种球品质退化的问题[2],但由于传统的百合生产无论是自然繁殖还是鳞茎片扦插繁殖[3],在繁殖过程中都会由于病毒的侵染和积累导致种球品质下降。如何大量得到种球的同时提高种球品质,是提高国产种球质量,满足市场需求的必经之路。
针对病毒的侵染,已有学者进行了茎尖和超低温脱毒研究[4]。利用组织培养技术对东方百合‘索邦’研究获得优质种苗,也有一些报导[5-6],所用到的外植体类型有鳞茎[7-8]、花器官[9-10]、叶片[11-12]等,也有学者进行了射线辐射[13]和转基因[14]等研究。由于东方百合‘索邦’的市场需求量较大,其离体培养技术还有待进一步完善,以期为规模化种苗的生产提供理论和技术基础。本研究利用市售的东方百合‘索邦’鲜切花为材料,取其花器官为外植体,培养得到无菌苗,而后比较组培苗不同部位的愈伤组织诱导率,进一步进行愈伤组织诱导、丛生芽增殖和生根培养等方面研究,为完善东方百合‘索邦’的离体培养体系,进行优质种球的规模化生产提供基础。
1 材料与方法
1.1 试验材料
试验材料东方百合‘索邦’鲜切花购自花店,以含苞待放的花朵为佳,购买后将材料置于采样袋内,喷水保湿后带回试验室。
1.2 试验方法
1.2.1初始诱导外植体的选取 以子房、花梗及花瓣作为外植体,流水冲洗后,75%酒精消毒30 s,无菌水冲洗3次,然后升汞灭菌5 min,无菌水冲洗6次。将子房、花梗和花瓣切成小块,大小0.5 cm左右,接种到 MS+1.0 mg·L-16-BA+0.2 mg·L-1NAA +30 g·L-1蔗糖+6.5 g·L-1琼脂,pH 5.8的培养基中。培养条件为:光照强度1 500~2 000 lx、光照时间12 h·d-1、温度(25±1)℃。25 d后统计污染率、存活率及愈伤诱导率。
1.2.2愈伤诱导外植体比较 将初始诱导的愈伤组织继续培养成苗,培养60 d后,小苗株高为3~5 cm时,取叶片和鳞茎片,将材料分为叶片上部、叶片中部、叶片下部和鳞茎片 4个部分后,接种于 MS+1.0 mg·L-12,4-D +0.5 mg·L-16-BA +30 g·L-1蔗糖+6.5 g·L-1琼脂,pH 5.8的培养基中培养,培养条件同1.2.1。培养45 d后观察统计不同外植体类型的愈伤诱导率、死亡率、丛生芽诱导率等。
1.2.3愈伤诱导培养基筛选 以1.2.2试验中得到的愈伤诱导较好的叶片下部和鳞茎片为外植体,设置5种愈伤诱导培养基,分别为MS+0.2 mg·L-12,4-D(YS1)、MS+ 2.0 mg·L-12,4-D(YS2)、MS+ 0.2 mg·L-16-BA(YS3)、MS+2.0 mg·L-16-BA (YS4)、MS+2.0 mg·L-12,4-D +0.2 mg·L-16-BA (YS5)。接种后培养,培养条件同1.2.1。培养45 d后观察统计愈伤诱导率、丛生芽诱导率、生根率等。
1.2.4丛生芽诱导培养基筛选试验 为方便统计丛生芽诱导的增殖倍数,将诱导得到的不定芽切去叶片,进一步再切成黄豆大小接种到添加不同浓度6-BA、NAA配比的MS培养基中进行丛生芽诱导,包括MS+l.0 mg·L-16-BA +0.l mg·L-1NAA(CSY1)、MS+l.0 mg·L-16-BA + 0.5 mg·L-1NAA(CSY2)、MS+2.0 mg·L-16-BA +0.l mg·L-1NAA(CSY3)、MS+2.0 mg·L-16-BA + 0.5 mg·L-1NAA(CSY4)、MS+5.0 mg·L-16-BA +0.2 mg·L-1NAA(CSY5)。培养条件同1.2.1。培养45 d后观察统计分化率、增殖倍数、丛生芽生长情况等。
1.2.5生根诱导培养基筛选试验 将生长一致且健壮的无菌苗单株切下,如有长根切去根,接种到含有不同浓度NAA的MS培养基中,NAA设定浓度为0.1 mg·L-1(SG1)、0.2 mg·L-1(SG2)、0.5 mg·L-1(SG3)、2.0 mg·L-1(SG4)及5.0 mg·L-1(SG5)。每天观察直至出根,记录出根天数。培养条件同1.2.1。培养45 d后观察统计生根率、出根天数、根数、根长、生根苗状态等。
1.3 数据统计与分析
采用Microsoft Excel 2007和SPSS 18.0软件对试验数据进行统计、分析和绘图。
2 结果与分析
2.1 初始诱导外植体选择
不同花器官部位的愈伤组织诱导结果见表1,可见,相同灭菌条件下,子房外植体的污染率为5.33%,显著低于花梗和花瓣。存活率方面,子房外植体最高,花梗次之,花瓣最低,不同部位之间差异显著。究其原因可能是花梗,尤其是花瓣暴露在外,污染率较高,加上褐化的产生,导致存活率较低。从愈伤诱导率方面看,子房外植体最高,为84.33%,显著高于花梗和花瓣,花瓣的愈伤诱导率最低,仅为5%,可能跟花器官的发育程度以及幼嫩程度有关。因此综合考虑,初始诱导建立无菌体系应选择子房作为外植体。
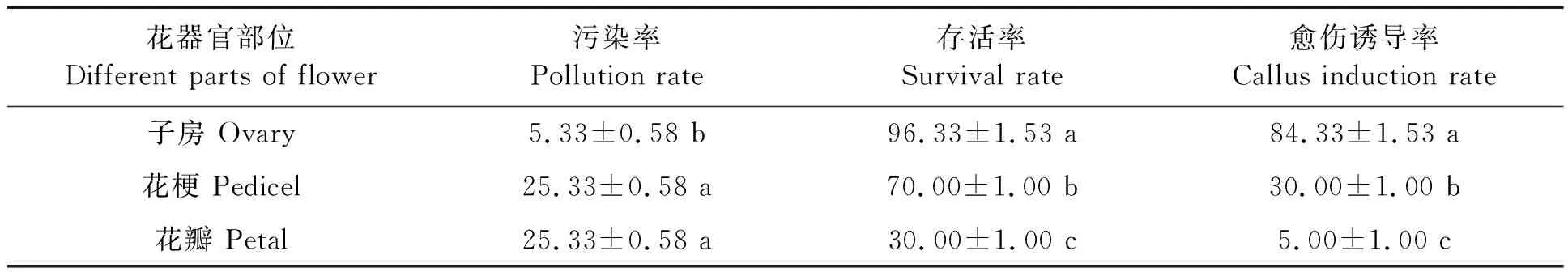
表1 不同花部位初始诱导效果比较Table 1 Comparison of initial induction effect of different parts of flower (%)
2.2 愈伤诱导外植体比较
对无菌苗的不同部位进行愈伤诱导,结果(表2)可见,各部分的愈伤诱导率最高的是叶片下部,为100%;其次是鳞茎片,为93.1%;叶片上部最低,愈伤诱导率仅为6.57%。叶片上部虽有分化能力,但愈伤诱导率极低,死亡率最高,达54.43%;叶片中部愈伤诱导的死亡率也较高,为13.43%;而叶片下部和鳞茎片的死亡率均为0。由于百合愈伤生长和丛生芽生长并无明显界限,因此也统计了丛生芽诱导的情况。不同部位均可诱导产生丛生芽,以叶片下部为外植体的丛生芽诱导率最高,为93.10%,显著高于其他3种外植体;其次为鳞茎片,丛生芽诱导率为79.67%。
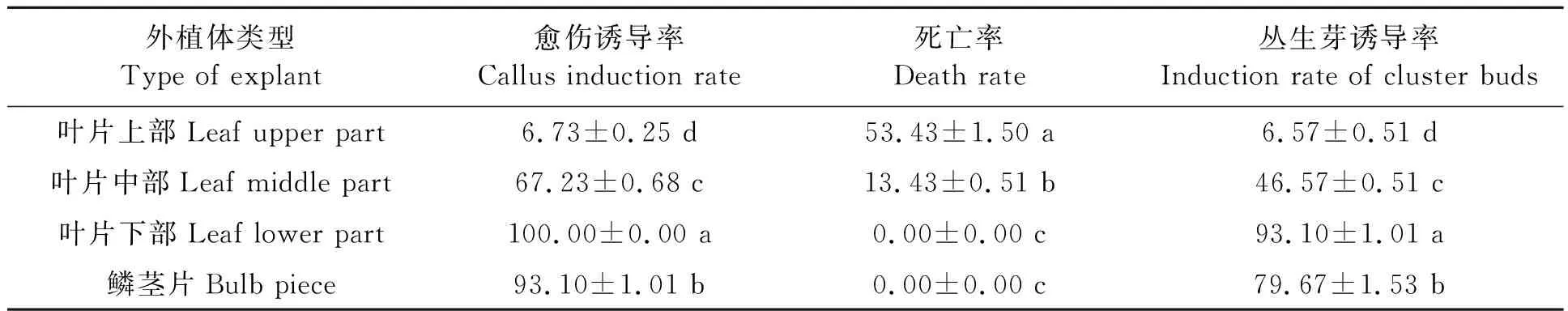
表2 不同外植体的愈伤诱导能力Table 2 Callus induction ability of different explants (%)
无菌苗不同部位诱导的生长情况(图1)显示,叶片下部和鳞茎片得到的愈伤组织及丛生芽呈现黄绿色,生长健壮,而叶片上部和叶片中部诱导的愈伤组织部分发生褐化、死亡,且愈伤组织及丛生芽长势较弱。综合愈伤诱导统计情况及诱导材料生长状况,进行愈伤诱导时适宜选用叶片下部或鳞茎片作为外植体。
2.3 愈伤诱导培养基筛选
不同愈伤培养基的外植体生长情况(表3)可知,培养基YS2和YS5的叶片下部愈伤诱导率显著高于其他3个培养基处理;培养基YS2鳞茎片的愈伤诱导率最高,显著高于其他4个培养基处理,其次为YS5。培养基YS2叶片下部的丛生芽诱导率最高,为99.33%,显著高于其他4个培养基处理,其次为YS5;而培养基YS4和YS5的鳞茎片的丛生芽诱导率显著高于其他3个培养基处理,丛生芽诱导率分别为80.00%和79.00%。综合愈伤诱导率和丛生芽诱导率,叶片下部和鳞茎片的合适愈伤诱导培养基为YS2和YS5。此外,在诱导过程中发现,YS1和YS2培养基中,产生丛生芽的同时还会生根,叶片下部的生根率分别为86.23%和93.43%,鳞茎片的生根率分别为93.43%和100%,而根的存在会影响后续的切割接种。因此,YS5为最合适的愈伤诱导培养基,即MS+2.0 mg·L-12,4-D+0.2 mg·L-16-BA+30 g·L-1蔗糖+6.5 g·L-1琼脂,pH 5.8。
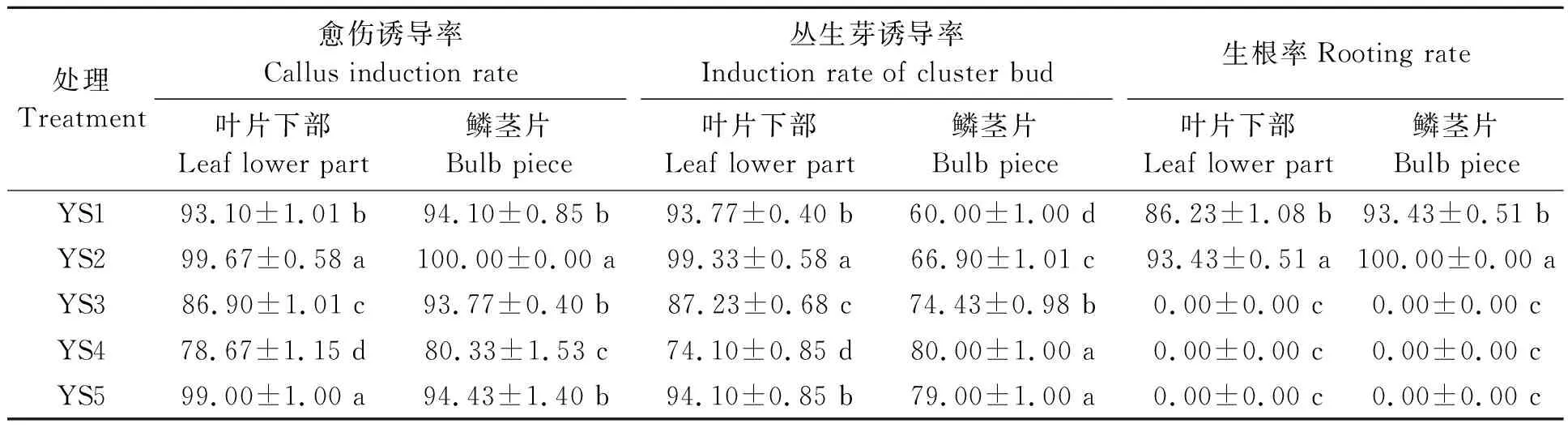
表3 外植体在不同激素组合培养基的生长情况Table 3 Growth of explants in medium with different hormone combinations (%)
2.4 丛生芽增殖培养基筛选结果
不同培养基的丛生芽增殖情况见表4,可见,不同培养基的分化率均为100%,但增殖倍数有所差异,CSY5的增值倍数最高,为3.96倍,其次为CSY3(3.44)和CSY1(3.26),三者间差异显著,增殖倍数最低的为CSY4和CSY2,分别为 3.18和3.14倍,两者无显著差异。从丛生芽生长情况看,CSY5处理虽然能诱导得到较多的丛生芽,但芽的叶片卷曲且有部分玻璃化现象产生。而CSY3处理的丛生芽较为瘦弱,并有一半生根。CSY4除增值倍数较低外,芽较小,叶片出现卷曲玻璃化现象。CSY2的芽弱小、有一半已生根,且增殖倍数较低。综合考虑,选择CSY1(MS+l.0 mg·L-16-BA +0.l mg·L-1NAA +30 g·L-1蔗糖 +6.5 g·L-1琼脂)作为最佳丛生芽诱导培养基,得到的增殖倍数虽不是最高,但其得到的丛生芽比较整齐,叶片宽大,且无根,利于后续增殖切割或进一步进行生根培养操作。
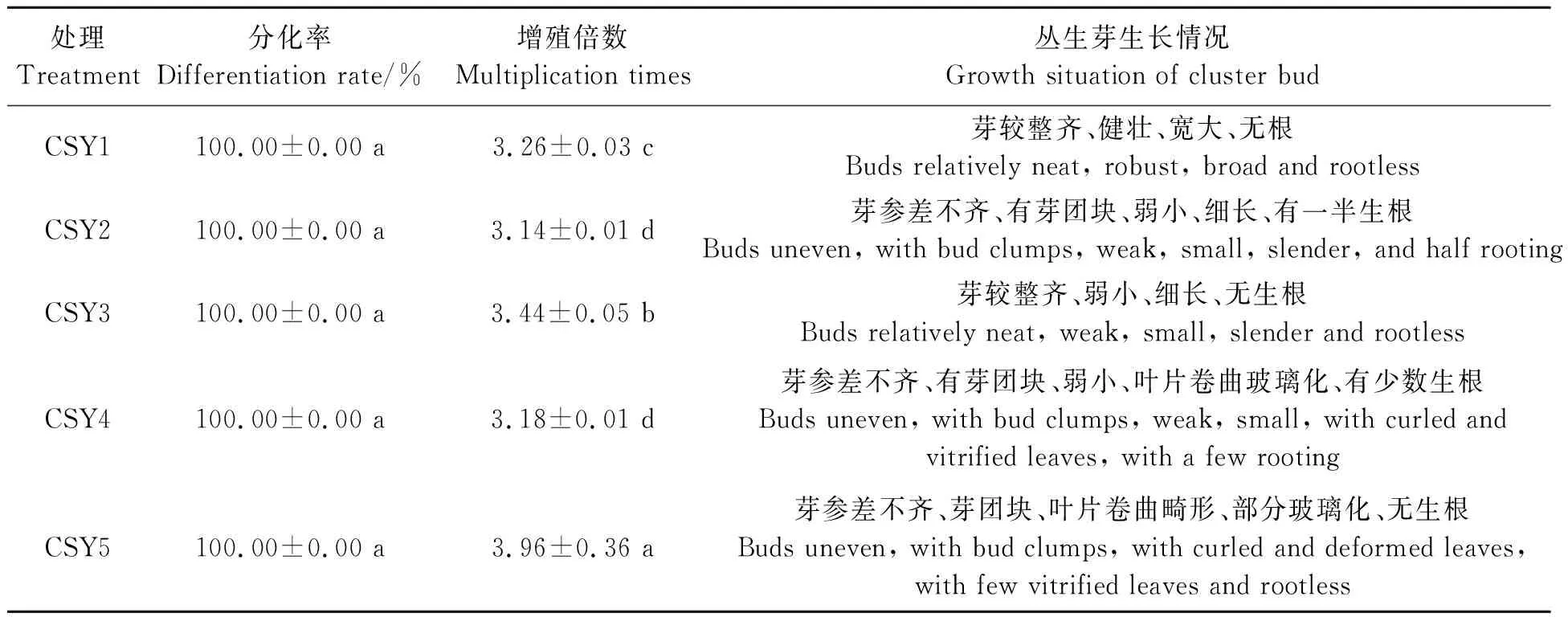
表4 不同激素配比对丛生芽增殖的影响Table 4 Effects of different hormone combinations on proliferation of cluster buds
2.5 生根诱导培养基筛选结果
对不定芽进行生根诱导培养,结果见表5,可见,不同NAA激素水平下,生根率均为100%,出根天数也无差别,均为7 d。根长度方面虽有差别,但无显著差异。从根数量来看,最多的为SG5培养基,根数量达13.77;其次为SG3,根数量为12.53;SG4、SG2和SG1的根数量分别为11.57、10.37和8.5,不同培养基之间均存在显著差异。从根和植株生长状态(表5,图2)来看,生根数量最多的SG5培养基,苗的根粗长,有大量根毛,会粘附培养基,不利于清洗移栽,且植株叶片稀疏(图2F)。而SG3的根数量虽不是最多,但较粗壮,且植株叶片较多,利于后续移栽(图2D)。SG4不仅根数较SG5和SG3少,且根短粗,叶细长稀疏。而SG2和SG1不仅根数少,且根细长,根毛少。因此,选择SG3(MS+0.5 mg·L-1NAA +30 g·L-1蔗糖 +6.5 g·L-1琼脂,pH 5.8)作为生根培养基。

表5 不同激素配比对生根的影响Table 5 Effects of different hormone combinations on rooting
3 讨论
目前,对于东方百合‘索邦’的组织培养,多数采用鳞茎片作为外植体[7-8],鳞茎片作为外植体具有诱导效率高的特点,但由于其生长于地下,因此灭菌有一定难度。也有利用株芽、茎段和叶片等为外植体的报导[15-16]。花器官作为外植体具有品种特征突出,取材方便,灭菌容易等特点,主要取材部位为花瓣、花丝、花托和花梗[9-10]。本研究预试验发现花丝作为外植体发生全部褐化。因此,主要选用花梗、子房和花瓣为外植体。研究发现,应选择子房作为初始诱导的外植体,与潘娟[17]的研究结果一致。
将初始诱导得到的丛生芽进行愈伤诱导增殖时需要进行材料的选择,本研究本着充分利用材料的出发点,将丛生芽分为叶片上部、叶片中部、叶片下部和鳞茎片4个部分进行诱导,发现叶片下部的诱导率最高,其次是鳞茎片,叶片中部和叶片上部较低。这是因为百合的诱导效果具有位置效应,总体来说,诱导效果从下到上依次降低[18],但本研究发现叶片下部诱导效果优于鳞茎片,可能是跟品种不同有关。最佳的愈伤诱导培养基为MS+2.0 mg·L-12,4-D +0.2 mg·L-16-BA +30 g·L-1蔗糖+6.5 g·L-1琼脂,pH 5.8,其中2,4-D的浓度达2.0 mg·L-1,可见高浓度的生长素有利于愈伤组织的产生。在诱导愈伤时发现,愈伤产生后基本都会产生不定芽,表明百合不定芽的发育与愈伤组织生成之间并无显著的阶段分隔,有学者完成了百合外植体直接诱导成苗的研究[19],可见百合的不定芽诱导是较为容易的。本研究在诱导不定芽时依然发现叶片下部显著优于鳞茎片,但在进行百合种苗工厂化扩繁时,还是建议将各类外植体充分综合利用。
在进行丛生芽诱导培养基优化时,本研究发现较高的“分裂素/生长素”比值处理CSY5(MS+5.0 mg·L-16-BA +0.2 mg·L-1NAA )得到的增殖倍数要显著高于较低“分裂素/生长素”比值处理CSY1(MS+1.0 mg·L-16-BA +0.1 mg·L-1NAA)。但CSY1得到的丛生芽比较整齐,叶片宽大,且无根,利于后续增殖切割操作或进一步进行生根培养操作,这与夏九成等[20]和钱琼秋等[21]研究一致。
东方百合‘索邦’的生根诱导相对比较容易,在愈伤诱导以及丛生芽诱导过程中由于添加生长素,加之其内源激素的影响均发现有根长出,这与现有[21-23]研究一致,即IAA、IBA、NAA以及与BA、活性炭等的配合等均能够诱导生根。本研究利用单一NAA作为生根诱导激素,不同浓度下生根均达到100%,但植株生长受到一定影响。综合考虑生根及植株的生长状态,选用SG3(MS+0.5 mg·L-1NAA +30 g·L-1蔗糖+6.5 g·L-1琼脂,pH 5.8)作为生根培养基。炼苗移栽也是百合种苗生产的重要步骤,后续可进一步深入研究,为百合种苗生产提供基础。
