荔枝叶片胚性愈伤组织诱导及其继代增殖研究
2021-03-12
(广东省农业科学院果树研究所,广东 广州 510640)
【研究意义】荔枝(Litchi chinensisSonn.)原产于中国,迄今已有2000 多年的栽培历史,是热带及亚热带地区的重要经济作物。我国拥有世界上最丰富的荔枝种质资源,但由于童期长、多年生、高度杂合等因素的影响,加上荔枝遗传背景研究资料的缺乏,导致荔枝常规育种的进程被限制。荔枝组织培养技术自20 世纪80 年代建立以来,已见花药[1]、幼胚[2]、茎段[3]、原生质体[4]、胚性愈伤组织遗传转化[5]以及胚性细胞悬浮物[6]等作为外植体进行荔枝再生体系研究的报道,这为荔枝遗传转化技术育种提供了基础。【前人研究进展】植物中可诱导出胚性愈伤组织的外植体种类很多,分化程度较低的外植体在植物生长调节剂作用下容易诱导出胚性愈伤组织,如玉米(Zea maysL.)的幼胚[7]、苜蓿(Medicago sativaL.)的子叶和下胚轴[8]等;而分化程度较高的外植体较难诱导,需进行特殊处理,如需光照条件的刺楸(Kalopanax septemlobusT.)叶片[9],需0.5 mg/L TDZ 和2.0 mg/L 2,4-D 配合处理的朱顶红(Hippeastrum vittatumL.)花梗[10]等。研究表明,荔枝组织培养最早是选用花药[1]作为外植体,该方法具有胚性高、诱导率高等优点,但取材困难且受花期限制;花药诱导出的胚性愈伤组织染色体变异频率较幼胚来源的胚性愈伤组织高[11];通过花药获得纯合的单倍体再生荔枝植株极其困难[12]。幼胚作为外植体也受取材困难和操作难度高等因素影响。茎段取材方便,但胚性低、仅能诱导出愈伤组织[3]。研究发现,外源生长素和细胞分裂素的合理搭配在巴西香蕉[13]、番木瓜[14]和小果野蕉[15]胚性愈伤组织的诱导中起决定性作用,2,4-D 对胚性愈伤组织的诱导影响显著,单一添加2,4-D 或搭配其他激素对胚性愈伤组织的诱导有促进作用。另外,添加剂在胚性愈伤组织的诱导与增殖中也有广泛应用,如青海云杉(Picea crassifoliaK.)愈伤组织增殖过程中添加水解酪蛋白、谷氨酰胺和Phytagel 凝胶[16],金煌芒果(Mangifera indicaL.)胚性愈伤组织诱导中添加椰子水、谷氨酰胺和活性炭(AC)[17],杉木胚性愈伤组织诱导中添加茉莉酸甲酯(MeJA)[18]。添加剂在一定程度上可减少组织褐化、促进愈伤组织形成和体胚发生等[19]。胚性愈伤组织在激素条件下长期继代培养,其生长速率逐渐降低、生长状态下降,最终失去胚性成为非胚性组织块[20]。谢玉明等[21]研究表明,除去或降低生长素浓度,利于荔枝胚性愈伤组织的增殖和体细胞胚的发生。【本研究切入点】目前关于荔枝胚性愈伤组织诱导及分化研究所选用的材料主要集中在幼胚和花药,但其花期短、取材困难。叶片作为外植体材料来源较广、取材方便、操作简单,可以保持原有品种的优良性状,其应用更为广泛[19]。【拟解决的关键问题】本研究选取荔枝早、中、晚熟几个代表性品种,以无菌苗叶片为外植体进行胚性愈伤组织诱导,设计3 种不同继代培养基及培养方式进行继代增殖试验,对影响叶片胚性愈伤组织诱导及增殖的植物生长调节剂、基因型和接种方式的若干因素进行研究,以期为建立高效的荔枝叶片离体再生体系提供理论基础和参考依据。
1 材料与方法
1.1 试验材料
供试材料为御金球成年树体叶片,以及早熟品种三月红和妃子笑、中熟品种桂味和糯米糍、晚熟品种御金球的无菌苗叶片。所有品种叶片和果实均采自广东省农业科学院果树研究所果园,无菌苗叶片由该所荔枝栽培与生理研究室培养。
1.2 试验方法
1.2.1 外植体选取与消毒 荔枝叶片的取材时间为2018 年4-6 月晴天上午9:00-10:00,取御金球树体上新抽生1、2、4 周的叶片,放入冰盒中带回实验室。将叶片置于流水中缓慢冲洗10~30 min 后,用蒸馏水润洗1 次。在超净工作台上,将叶片用5% Sanosil 消毒液浸泡消毒5 min,无菌水漂洗1 次;1%多菌灵溶液浸泡消毒5 min,无菌水漂洗3 次。
1.2.2 无菌苗培养 取花后10~11 周成熟果,将果实的果皮、果肉及白色软组织剔除并清洗干净,将清洗后的种子置于超净工作台,用5%Sanosil 消毒液浸泡消毒10 min,无菌水漂洗1次;1%多菌灵溶液浸泡消毒5 min,无菌水漂洗1 次;70%酒精浸泡20~30 s,无菌水漂洗1 次;再放入0.5%升汞溶液中浸泡灭菌10 min,最后用无菌水漂洗3 次。将种子水平接种于WPM 粉(Woody Plant Medium,木本植物用培养基)+Ca(NO3)20.56 g/L+BAP(6-Benzylaminopurine)11 μmol+Kn(Kinetin)2.3 μmol+GA30.6 μmol+蔗 糖30 g/L+CH(Casein hydrolysate)400 mg/L+15% CW(Coconut water)+琼脂6 g/L 培养基上,置于光照强度1500~2000 lx、温度25(±1)℃、16 h 光照/8 h 黑暗培养条件下培养30 d。
1.2.3 叶片胚性愈伤组织诱导 分别以植物生长调节剂和防褐化剂为影响因子进行单因素试验:(1)以MS 为基础培养基,设2,4-D、NAA、KT 3 种植物生长调节剂组合,同时添加蔗糖30 g/L、琼脂7 g/L、肌醇100 mg/L,探讨植物生长调节剂对御金球叶片胚性愈伤组织诱导的影响;(2)选取聚乙烯吡咯烷酮(PVP)、抗坏血酸(Vc)和活性炭(AC)为防褐化剂,每种防褐化剂设100、500、1000 mg/L 3 个浓度梯度,以不添加防褐化剂作为对照,以期筛选防褐化效果最佳的添加剂及其浓度。每个处理3 次重复,每个重复接种10 瓶,每瓶接种外植体6 枚左右。
选择健康生长的培养20 d 的三月红、桂味、糯米糍、妃子笑、御金球的无菌苗,以完全展开的叶片作为外植体,接种于诱导培养基上。将御金球成年树体上新抽生1、2、4 周的叶片与1、2、4 周的无菌苗叶片(时间均以叶片完全伸展后开始计算)接种于诱导培养基上,取材样品见图1。同样地,将御金球叶片切割成1 cm2大小,然后以正面朝上、正面朝下、沿主叶脉垂直方向切两道伤口的前提下叶片正面朝上和正面朝下4 种方式接种于诱导培养基上,诱导培养基为以上单因素试验探索出的最适培养基,探讨基因型、外植体来源及时期、不同接种方式对荔枝叶片胚性愈伤组织诱导的影响。每个处理3 次重复,每个重复接种10 瓶,每瓶接种外植体6 枚左右。

图1 不同来源及时期的荔枝叶片Fig.1 Litchi leaves from different sources and stages
1.2.4 胚性愈伤组织继代增殖培养 以御金球品种诱导出的叶片胚性愈伤组织为试验材料,选取外观黄色或淡黄色、长势较快的胚性愈伤组织转接到含有不同浓度植物生长调节剂组合的培养基上。基础培养基为MS,均添加有蔗糖30 g/L、琼脂7 g/L、PVP 500 mg/L,设计NAA 和6-BA 两个单因素,浓度均为0.5 mg/L 和2.0 mg/L,以不添加任何植物生长调节剂为对照。
设计3种不同继代培养基及继代方式对胚性愈伤组织进行继代培养,以研究不同继代方式对胚性愈伤组织继代增殖的影响。3种继代培养基分别为:MS+蔗糖30 g/L+琼脂7 g/L+PVP 500 mg/L(J1)、MS+2,4-D 1.5 mg/L+NAA 2.0 mg/L+蔗糖30 g/L+琼脂7 g/L+PVP 500 mg/L(J2)、植物生长调节剂减半的J2培养基并添加2.0 mg/L AgNO3(J3)。3种继代方式分别为:(1)只用J2培养基进行胚性愈伤组织继代;(2)J1和J2培养基交替继代;(3)J2和J3培养基交替继代。每瓶培养基接种量大致相同,接种完后记录其鲜重。每个处理3次重复,每个重复接种10瓶。
1.2.5 培养条件 愈伤组织/胚性愈伤组织诱导的条件为黑暗培养、温度25(±1)℃,继代2 次(培养基不变),继代周期为20 d,培养60 d 后统计褐化率和诱导率。继代培养条件为黑暗培养、温度25(±1)℃,培养30 d 后统计增殖率。胚性愈伤组织的判断方法为:黄色或淡黄色,结构疏松,无明显褐化且直径大于0.5 cm 的愈伤组织。
1.3 数据统计
试验数据采用SPSS 19.0 进行变量分析,采用Duncan's进行差异显著性测验。参数计算方法如下:
愈伤组织诱导率(%)=产生愈伤组织数/外植体总数(污染除外)×100
胚性愈伤组织诱导率(%)=产生胚性愈伤组织数/外植体总数(污染除外)×100
褐化率(%)=褐化的外植体数/外植体总数(污染除外)×100
增殖率(%)=30 d 后胚性愈伤的鲜重/接种时胚性愈伤鲜重×100
2 结果与分析
2.1 不同培养基成分对荔枝叶片胚性愈伤组织诱导的影响
2.1.1 植物生长调节剂对荔枝叶片胚性愈伤组织诱导的影响 从表1 可以看出,2,4-D 对荔枝叶片胚性愈伤组织的诱导影响显著,未添加2,4-D的对照和高浓度(10.0 mg/L)2,4-D 处理均难以诱导出胚性愈伤组织,1.5 mg/L 2,4-D 处理诱导率相对较高,为御金球叶片胚性愈伤组织诱导的最佳浓度。未添加任何植物生长调节剂的对照诱导率为0,其叶片材料在初期可诱导出愈伤组织,但几乎为结构致密、颜色整体偏绿并带有白点的块状组织,在后续的继代过程中未能转为胚性愈伤组织。在培养基中添加有2,4-D 的条件下,低剂量NAA 对叶片胚性愈伤的影响不显著,高剂量(2.0 mg/L)NAA 反而产生抑制作用;相比于单独添加2,4-D,附加2.0 mg/L KT 对胚性愈伤的诱导有促进作用,其诱导率最高为46.25%。由此可知,本试验中最适植物生长调节剂组合为2,4-D 1.5 mg/L+KT 2.0 mg/L。

表1 植物生长调节剂对御金球叶片胚性愈伤组织诱导的影响Table 1 Effects of plant growth regulators on the induction of embryogenic callus from Yujinqiu leaves
2.1.2 防褐化剂对荔枝叶片胚性愈伤组织诱导的影响 表2 显示,3 种防褐化剂处理后荔枝叶片褐化率均低于对照,说明外加防褐化剂PVP、Vc、AC 均能在一定程度上抑制外植体褐化。不同防褐化剂效果有显著差异,其中AC 的防褐化效果最好、1000 mg/L AC 褐化率最低为22.64%,Vc 的防褐化效果最差,不同浓度PVP 和Vc 的防褐化效果无显著差异。从诱导率来看,低浓度(100 mg/L)PVP 和Vc 与对照组之间没有显著差异,不同浓度的Vc 对诱导率的影响也无显著差异。而不同浓度PVP 和AC 对诱导率的影响显著,其中PVP 浓度为500 mg/L 时诱导率最高、为45.28%,AC 浓度为1000 mg/L 时诱导率最低、仅4.65%。
表2 防褐化剂对御金球叶片胚性愈伤组织诱导的影响Table 2 Effects of different anti-browning agents on the induction of embryogenic callus from Yujinqiu leaves
2.2 不同基因型对荔枝叶片胚性愈伤组织诱导的影响
以5 个品种荔枝的无菌苗叶片为试验材料,培养20 d 后5 个品种外植体均能诱导出愈伤组织,其中三月红和御金球的诱导效果较好,前者诱导率最高为85.83%;另外3 个品种诱导率较低,最难诱导出愈伤组织的品种为桂味,诱导率仅8.62%(表3)。培养60 d 后,三月红和御金球能诱导出状态较好且可用于后续试验的胚性愈伤组织,御金球诱导率最高(42.50%),其诱导过程如图2A-F;妃子笑诱导率最低(仅3.39%);桂味和糯米糍未能诱导出胚性愈伤组织。可见,基因型对荔枝叶片愈伤组织和胚性愈伤组织的诱导影响显著。
表3 不同基因型对荔枝叶片胚性愈伤组织诱导的影响Table 3 Effects of different genotypes on the induction of embryogenic callus from lichi leaves

图2 御金球荔枝胚性愈伤组织诱导过程Fig.2 Induction process of embryogenic callus of Yujinqiu
2.3 不同外植体来源、时期和接种方式对荔枝叶片胚性愈伤诱导的影响
从表4 可以看出,不同来源及时期叶片对荔枝胚性愈伤组织诱导影响显著。成年树体上叶片无法诱导出胚性愈伤组织(图2G-I),且外植体褐化率高,其原因可能是接种前的消毒作用使叶片受损严重导致外植体活性下降,或是成年树体叶片中酚类物质代谢旺盛,培养基条件不足以抑制或降低酚类物质浓度而导致外植体大量褐化。而2~4 周的无菌苗叶片均能诱导出胚性愈伤组织(图2A-F),尤以叶龄2 周的材料诱导率最高(36.44%),这可能与未经消毒和酚类物质代谢程度低有关。后期试验还发现,随着苗龄增长,苗龄1 年以上的幼嫩叶片诱导出胚性愈伤组织的能力越来越弱甚至无法诱导,而成年树体上不同时期的叶片均无法诱导出胚性愈伤组织。
4 种不同接种方式对荔枝叶片胚性愈伤组织诱导的影响差异显著。其中,“正面朝上”接种的外植体诱导率最低、仅为3.70%;将外植体“沿主叶脉垂直方向切开两道伤口后正面朝下”的接种方式,诱导率最高、为43.40%,这可能是因为当叶片“正面朝上”时,叶片仅有叶缘和少量叶面与培养基接触,而“正面朝下”时有较大叶面积与培养基接触,即叶片正面与培养基的接触面积较背面大,将正面朝下贴于培养基表面更利于植物生长调节剂对叶片胚性愈伤组织的诱导。另外,将叶片正面朝下并在叶片上切两道伤口能显著提高愈伤的诱导率,说明在不使组织受伤过度死亡的前提下,适当增加外植体伤口有助于愈伤的诱导。因此,本试验中最适合叶片胚性愈伤组织诱导的外植体接种方式为沿主叶脉垂直方向切开两道伤口后正面朝下接种。
表4 不同外植体来源及时期对御金球叶片胚性愈伤组织诱导的影响Table 4 Effects of different explant sources and durations on the induction of embryogenic callus from Yujinqiu leaves
2.4 不同植物生长调节剂对荔枝叶片胚性愈伤组织继代增殖的影响
以御金球品种诱导出的叶片胚性愈伤组织为实验材料,利用单因素试验设计6个处理和2个对照,胚性愈伤组织的生长状况和增殖率见表5。表5显示,不同植物生长调节剂组合的增殖率差异显著,在添加1.5 mg/L 2,4-D的情况下,低浓度6-BA和一定浓度NAA对胚性愈伤增殖有促进作用;在较高浓度6-BA培养基上,继代培养中愈伤组织容易褐化,影响增殖和后续体细胞胚的诱导。胚性愈伤组织在含有2,4-D 1.5 mg/L+NAA 2.0 mg/L中增殖率最高、为364%;2,4-D 1.5 mg/L+6-BA 2.0 mg/L处理的增殖率最低、近82%。对比对照可知,胚性愈伤在不添加植物生长调节剂的MS培养基上增殖率较低,其胚性愈伤组织生长良好、无褐化现象,但生长缓慢。因此,本试验中适合叶片胚性愈伤组织继代增殖的植物生长调节剂组合为2,4-D 1.5 mg/L+NAA 2.0 mg/L,其继代培养过程见图3。

表5 不同植物生长调节剂组合对御金球叶片胚性愈伤组织继代增殖的影响Table 5 Effects of different plant growth regulator combinations on subculture proliferation of embryogenic callus from Yujinqiu leaves
3 种继代培养方式的试验结果见表6,从表6 可以看出,只用J2 培养基进行继代培养增殖率最高,但其胚性愈伤组织的生长状态较差,继代过程中有部分组织褐化且有早期体细胞胚产生,胚性愈伤生长的同步性较 差。J1 和J2 培养基交替继代、J2 和J3 培养基交替继代两种方式下胚性愈伤组织生长状态无显著差异,而J2 和J3 培养基交替继代方式的增殖率相对较高,因此本试验中适合叶片胚性愈伤组织继代增殖的方式为MS+2,4-D 1.5 mg/L+NAA 2.0 mg/L+蔗糖30 g/L+琼脂7 g/L+PVP 500 mg/L(J2)和MS+2,4-D 0.75mg/L+NAA 1.0 mg/L+蔗糖30 g/L+琼脂7 g/L+PVP 500 mg/L+AgNO32.0 mg/L(J3)培养基交替继代。
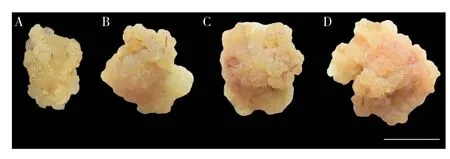
图3 御金球胚性愈伤组织继代培养过程Fig.3 Subculture process of embryogenic callus of Yujinqiu
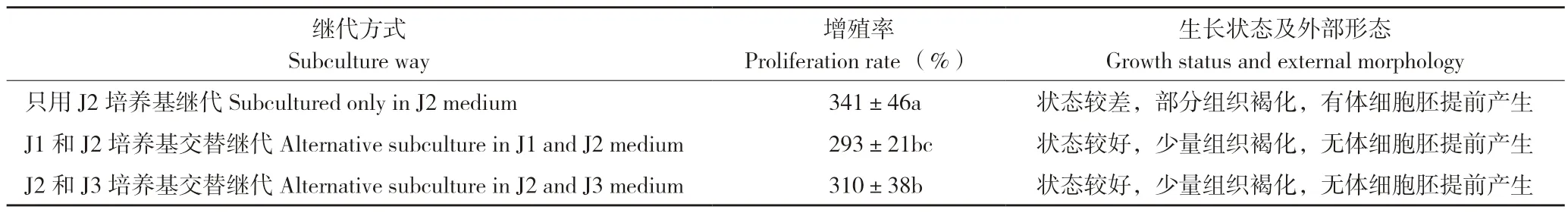
表6 不同继代方式对御金球叶片胚性愈伤组织增殖的影响Table 6 Effects of different subculture ways on proliferation of embryogenic callus from Yujinqiu leaves
3 讨论
3.1 胚性愈伤组织诱导培养的影响因素
胚性愈伤组织培养是体细胞胚发生间接途径所必须经历的中间阶段,也是成功获得体细胞胚并进一步培养成再生植株的重要阶段[22]。胚性愈伤组织的诱导受多种因素的影响,包括植物生长调节剂、基因型、外植体类型、外加添加剂和培养条件等[23]。基因型作为一种主要的内在影响因素,对愈伤组织的诱导、继代能力和增殖能力影响很大。荔枝胚性愈伤组织的诱导频率受基因型影响[24]。本试验以早、中、晚熟5 个代表性荔枝品种为研究对象,其中御金球和三月红成功诱导出黄色、组织疏松、生长状态较好的胚性愈伤组织。
外添不同种类及不同浓度的植物生长调节剂对胚性愈伤组织的诱导影响显著。2,4-D 的添加与否直接影响荔枝胚性愈伤组织能否被诱导[2]。在本研究中,以2,4-D 的常用浓度2~4 mg/L[25]为参考进行预实验发现1.5 mg/L 2,4-D 对愈伤组织的诱导效果较好。另外,添加2.0 mg/L KT 或0.5 mg/L NAA 有较高的胚性愈伤诱导率;刚诱导的愈伤组织呈浅绿色、半透明水润状,此时的愈伤是没有胚性的愈伤组织。在培养基中约继代3 代后,颜色为浅黄/黄色疏松颗粒状胚性愈伤组织从原组织上长出,说明荔枝叶片愈伤组织需进行继代培养后才能诱导出胚性愈伤组织。
荔枝的组织或器官在离体情况下会产生大量酚类物质,使组织褐化坏死。克服荔枝外植体褐化是诱导胚性愈伤组织成功的关键之一[26]。中国李愈伤组织培养中,PVP 的抗氧化能力最强、AC 次之、CA 最差,且同一防褐化剂的不同浓度对褐化影响较大[27]。本研究中,低浓度PVP 和Vc 对荔枝叶片胚性愈伤组织的诱导和外植体的防褐效果都较小,高浓度AC 虽然防褐化效果最好,但其诱导率也最低,这可能是因为AC 在吸附外植体产生的毒害和酚类物质时也吸附2,4-D,从而降低了诱导率。因此,本试验中最适合叶片胚性愈伤组织诱导的防褐化剂为PVP,最适浓度为500mg/L。
3.2 胚性愈伤组织继代培养的影响因素
植物再生体系的关键步骤之一在于体细胞胚的发生,而胚性愈伤组织的生长同步性是否一致、在培养过程中是否保持较高的胚性和增值率是其能否脱分化成为体细胞胚的关键因素。有研究报道,在胚性愈伤组织继代培养过程中,植物生长调节剂和添加剂起到至关重要的作用。将番茄胚性愈伤组织诱导培养基中6-BA 和2,4-D 的浓度降低到50%以下,其胚性愈伤组织胚性化保持效果最好、生长速度最快[28]。2,4-D 浓度减半并添加有10 mg/L AgNO3的培养基可诱导和保持松散型胚性愈伤组织[29]。在樟树胚性愈伤组织诱导培养基中添加200 mg/L 水解络蛋白和200 mg/L环糊精可保持胚性愈伤组织增殖和体细胞胚诱导[30]。本研究中,适合荔枝叶片胚性愈伤组织继代培养的植物生长调节剂组合为2,4-D 1.5 mg/L+NAA 2.0 mg/L,并在与该组合减半、添加2.0 mg/L AgNO3的培养基上交替继代培养保存6 个月,仍具有良好的生长状态。这为荔枝再生体系技术的建立打下了良好基础,也为后续试验提供了优质的原始材料;本试验结果也进一步说明植物生长调节剂和添加剂的重要性,并且胚性愈伤组织的继代培养不是简单的新旧培养基之间的转移,保持好生长同步性和胚性是继代培养过程应当重视的问题。
4 结论
对荔枝叶片胚性愈伤组织诱导及其继代培养条件优化研究结果表明,抽芽后20 d 左右的无菌幼叶在2,4-D 1.5 mg/L+KT 2.0 mg/L 组合下,经2~3 次继代后三月红和御金球品种能诱导出胚性组织;添加500 mg/L PVP 能获得更多胚性愈伤组织。胚性愈伤组织在含有2,4-D 1.5 mg/L+NAA 2.0 mg/L 中继代增殖率最高、达364%;并在上述组合浓度减半、添加2.0 mg/L AgNO3的培养基上交替继代培养保存时间最长、生长状态最好。
