异型葡枝霉感染不同金针菇后防御酶系的活性变化*
2021-03-12李长田贾传文王晓敏吕瑞娜
黄 静,李长田,贾传文,王晓敏,吕瑞娜
(吉林农业大学食药用菌教育部工程研究中心,吉林 长春 130118)
金针菇是我国主要的工厂化栽培食用菌之一,栽培范围广、产量大[1]。但在栽培过程中各类病害也经常发生,其中绵腐病(软腐病)是常见的病害之一[2-3]。其致病菌是异型葡枝霉(Cladobotryum varium),为金黄菌寄生菌Hypomyces aurantius(Pers.)Tulasne的无性型[4]。在上世纪90年代中期金针菇常规生产中第一次出现绵腐病,普遍分布于我国南部和北部温带地区[5]。近年来,随着栽培品种及气候条件的不断变化,绵腐病成为金针菇常规栽培和工厂化栽培的常见病害,对金针菇品质及产量造成严重影响。
异型葡枝霉以孢子形式侵染金针菇子实体;子实体感染初期由白色菌丝从子实体上吸取营养扩繁,致使菌柄变软倒伏、后期变黄变黑至腐烂[6-8]。金针菇生长发育的各个时期均可被侵染,其中搔菌到出芽阶段最易受侵染[9]。目前,对该病菌的防治主要依靠喷施杀菌剂,但长期使用会使异型葡枝霉的抗药性增强且造成环境污染并增加生产成本,同时降低了金针菇鲜品品质[10-11]。
在逆境条件下,植物产生的活性氧自由基会破坏自身细胞膜和蛋白质等大分子物质,进而影响其正常生长发育,同时在逆境条件下植物体内存在的酶保护系统即抗氧化酶系统被激活可将其体内多余的自由基消除[12]。病原菌与寄主相互竞争与相互识别的过程中,寄主体内被迫产生高于正常水平的活性氧,打乱了正常代谢功能。过氧化物酶、超氧化物歧化酶和过氧化氢酶共同组成体内有效的活性氧清除系统,三者协同作用,可有效地清除植物体内过氧化物和自由基[13]。多酚氧化酶可将酚类物质氧化为对病原菌有毒的醌类物质,和植物的抗病性关联密切,苯丙氨酸解氨酶是苯丙烷类代谢途径中的限速酶和关键酶,为合成木质素和植保素提供前体,因此被作为植物抗病性的一个生化指标[14-15]。
目前,对绵腐病的研究主要集中在发生环境、生物学特性及防治等方面[16-17],而对金针菇抗性机制方面却缺少系统性研究。选育对异型葡枝霉具强抗性的金针菇品种是防治病害发生的最有效方法之一,因此深入研究金针菇的抗性机制具有重要意义。结合植物的抗病机制,试验从病原物与寄主互作的角度出发,研究寄主被侵染后不同金针菇品种与4种防御系酶活性变化的关系,以期为金针菇抗病品种选育中生理生化指标的确定提供理论依据。
1 材料与方法
1.1 供试品种
金针菇L3002、L3003、L3005菌株来源于吉林农业大学食(药)用菌教育部工程研究菌种保藏中心,病原菌异型葡枝霉(Cladobotryum varium)JZ-01为长春高榕公司金针菇菇房中具典型病状的子实体分离所得,经柯赫氏法则验证[18],现保存于菌种保藏试验室。
1.2 异型葡枝霉菌悬液的制备
异型葡枝霉菌丝24℃暗光培养5 d,表面产生大量孢子后,用移液枪吸取无菌水置于培养皿内,多次吸打。后吸取1 mL孢子悬浊液于9 mL的无菌蒸馏水中,混匀,后取1 mL于9 mL无菌蒸馏水中,反复此操作,直至血球计数板检测菌悬液的浓度为1×106个/mL[19]。
1.3 接种及取样
按金针菇工厂化的操作流程进行栽培及出菇管理[20],在金针菇子实体长至瓶口时将配制好的异型葡枝霉菌悬液以喷雾式接种于金针菇柄部,以无菌水处理为对照,于接种第1天、第2天、第3天、第4天、第5天、第6天、第7天取样后立即放入液氮中,移入-80℃冰箱中保存备用。
1.4 粗酶液提取与测定
采用试剂盒法(南京建成生物工程研究所:过氧化物酶试剂盒,多酚氧化酶试剂盒,苯丙氨酸解氨酶试剂盒,超氧化物歧化酶试剂盒)对4种酶进行测定,检测方法按试剂盒说明书操作,每次测定重复3次取平均值。
1.5 数据分析
记录所得的数据用SPSS 17.0软件统计分析,将不同处理所得数据进行单因素显著性分析,设定显著性水平P为0.05,均值间不同小写字母表示差异显著。
2 结果与分析
2.1 异型葡枝霉侵染不同金针菇子实体后PAL的活性变化
不同金针菇子实体苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)活性变化见表1、图1。
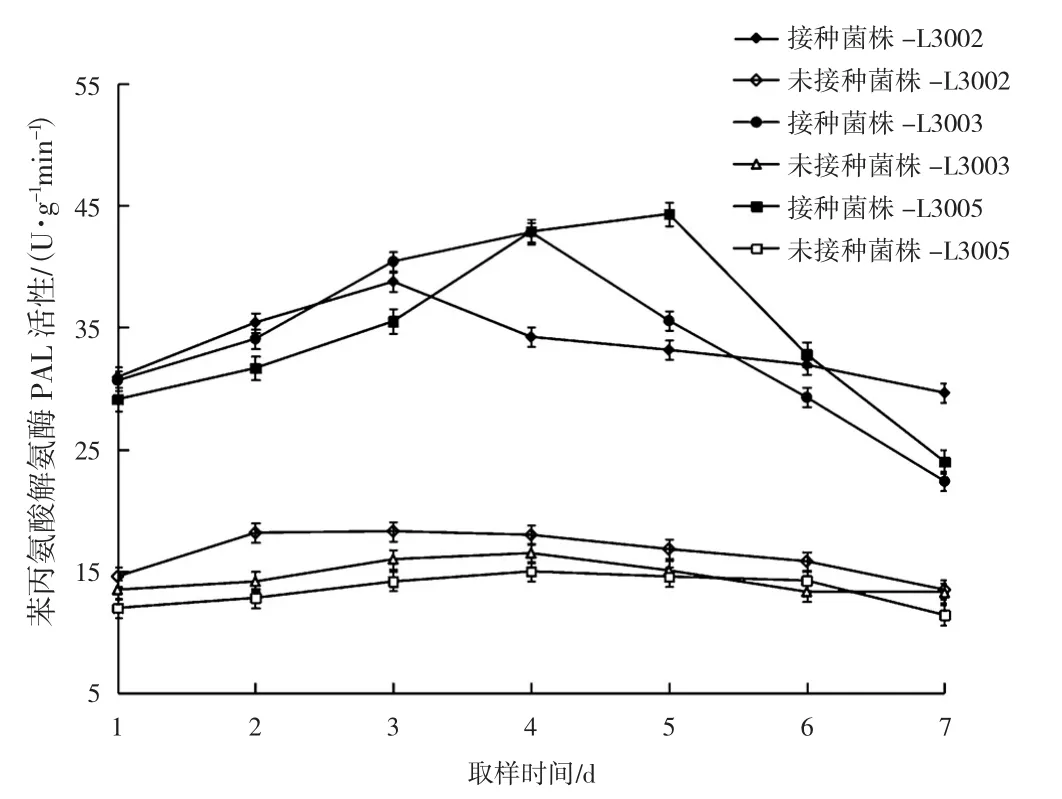
图1 不同金针菇子实体的PAL活性变化Fig.1 Changes of PAL activity in different Flammulina filiformis fruiting bodies
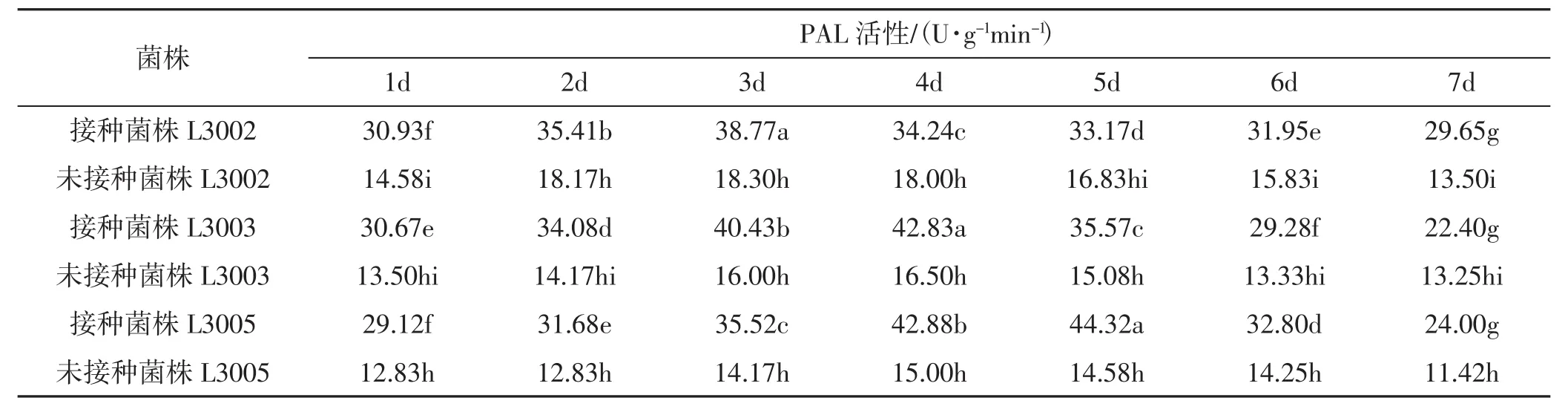
表1 不同金针菇子实体的PAL活性变化Tab.1 Changes of PAL activity in different Flammulina filiformis fruiting bodies
由表1、图1所示,接种病原菌后,不同金针菇菌株的子实体内苯丙氨酸解氨酶PAL的活性均呈上升趋势,且不同菌株上升趋势不同。达到峰值的时间也不同。L3005的PAL最大峰值高于L3002和L3003。L3005的PAL酶活性在第5天时达到最大峰值,随后PAL活性逐渐下降,L3005的PAL活性波动最大,最大酶活为 44.32 U·g-1min-1,是未接种时的3倍;L3003的PAL活性在第4天达到峰值为42.83 U·g-1min-1,是未接种的2.6倍;L3002的PAL活性波动最小,在第3天达到峰值其活性是未接种时的2倍。3个不同金针菇菌株的子实体内PAL活性与接种病原菌后的酶活性差异显著(P<0.05)。
2.2 异型葡枝霉侵染不同金针菇子实体后PPO的活性变化
异型葡枝霉侵染不同金针菇子实体后多酚氧化酶(polyphenol oxidase,PPO)的活性变化见表2、图2。
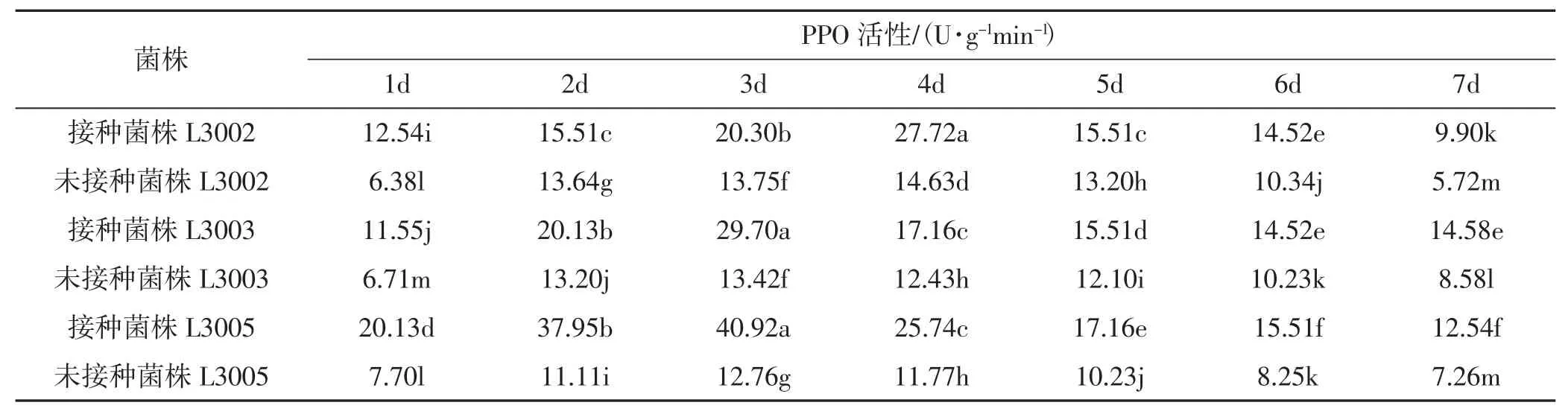
表2 不同金针菇子实体的PPO活性变化Tab.2 Changes of PPO activity in different Flammulina filiformis fruiting bodies
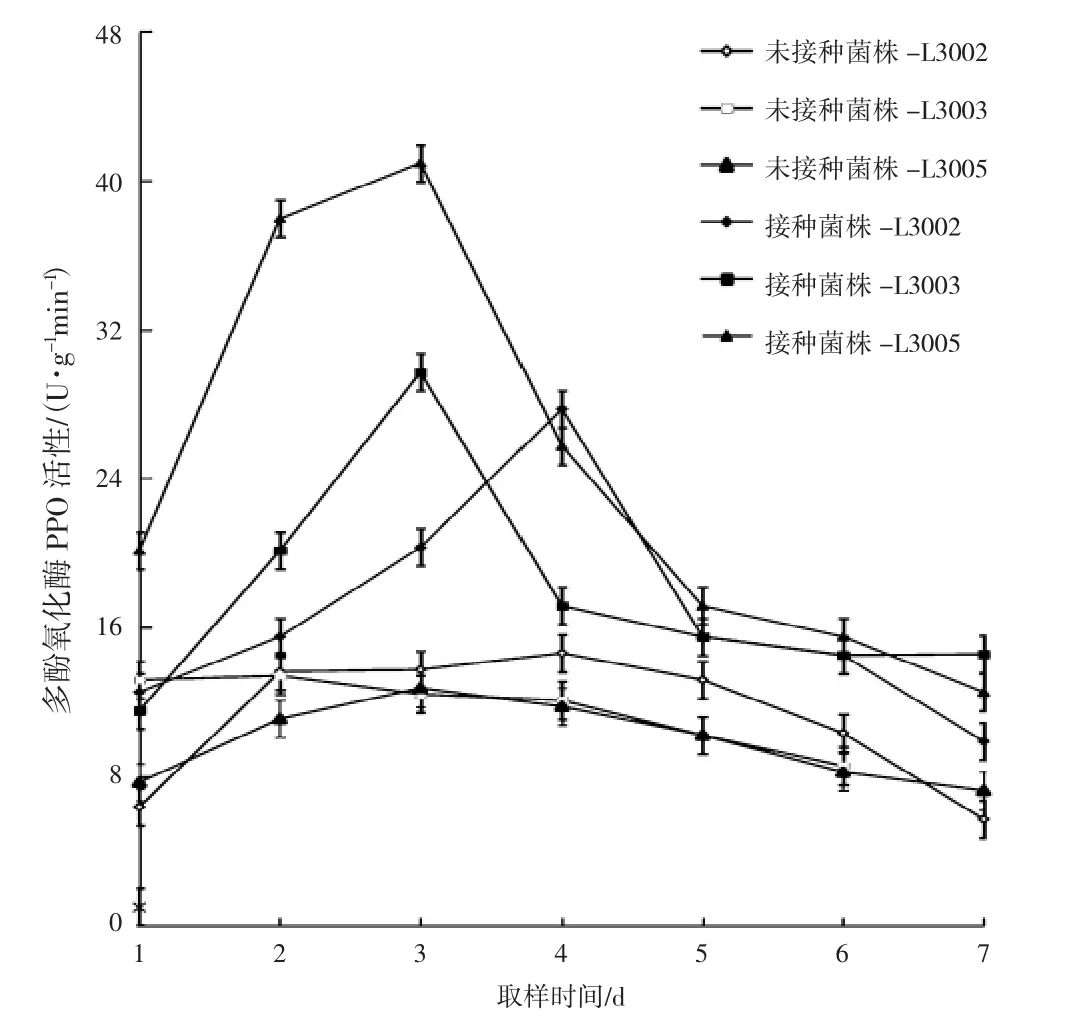
图2 不同金针菇子实体的PPO活性变化Fig.2 Changes of PPO activity in different Flammulina filiformis fruiting bodies
由表2、图2可知,不同金针菇菌株未经过接菌处理其子实体内的多酚氧化酶活性变化不大。接种后,不同金针菇菌株子实体内PPO酶活性均呈上升趋势。接种病原菌后,L3005的PPO活性波动最大,第3天就达到最大峰值,为 40.92 U·g-1min-1,是其对照的 3.2倍;L3002和 L3003的波动相对较小。L3003的PPO活性第3天达到峰值 29.7 U·g-1min-1是其对照的 2.2 倍;L3002的 PPO活性第 4天达到峰值 27.72 U·g-1min-1,是其对照的1.89倍。接种处理后,3个金针菇品种子实体内PPO活性与其对照的酶活性差异显著(P<0.05)。
2.3 异型葡枝霉侵染不同金针菇子实体后POD的活性变化
异型葡枝霉侵染不同金针菇子实体后过氧化物酶(peroxidase,POD)的活性变化见表3、图3。
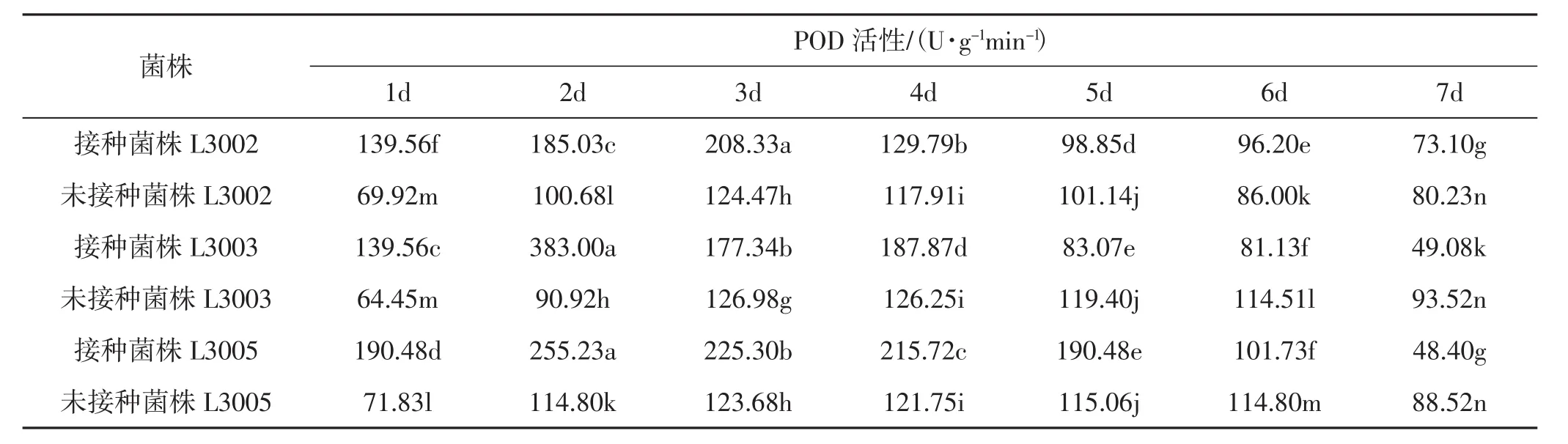
表3 不同金针菇子实体的POD活性变化Tab.3 Changes of POD activity in different Flammulina filiformis fruiting bodie
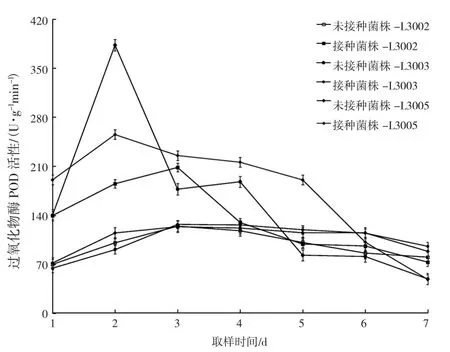
图3 不同金针菇子实体的POD活性变化Fig.3 Changes of POD activity in different Flammulina filiformis fruiting bodies
由表3、图3可知,金针菇未受病原菌侵染时,同一时期生长的3个菌株子实体内的过氧化物酶酶活变化不大,在同一水平上波动。接种病原菌后,金针菇子实体内的酶活发生变化,均呈上升趋势。其中L3005和L3003的POD活性均在第2天达到峰值,L3002在第3天达到峰值。L3005和L3002的POD活性波动较大。L3005的最大酶活达到384.21 U·g-1min-1,是其对照的3.75倍;L3002的最大酶活为 341.57 U·g-1·min-1,是其对照的 3.17 倍;L3003 的POD活性波动相对较小,最大酶活为304.37 U·g-1min-1,是其对照的2.63倍。接种处理后,不同金针菇品种子实体内的POD活性与未接种处理的酶活性差异显著 (P<0.05)。
2.4 异型葡枝霉侵染不同金针菇子实体后SOD的活性变化
异型葡枝霉侵染不同金针菇子实体后超氧化物歧化酶(superoxide dismutase,SOD)的活性变化见表4、图4。

图4 不同金针菇子实体的SOD活性变化Fig.4 Changes of SOD activity in different Flammulina filiformis fruiting bodies
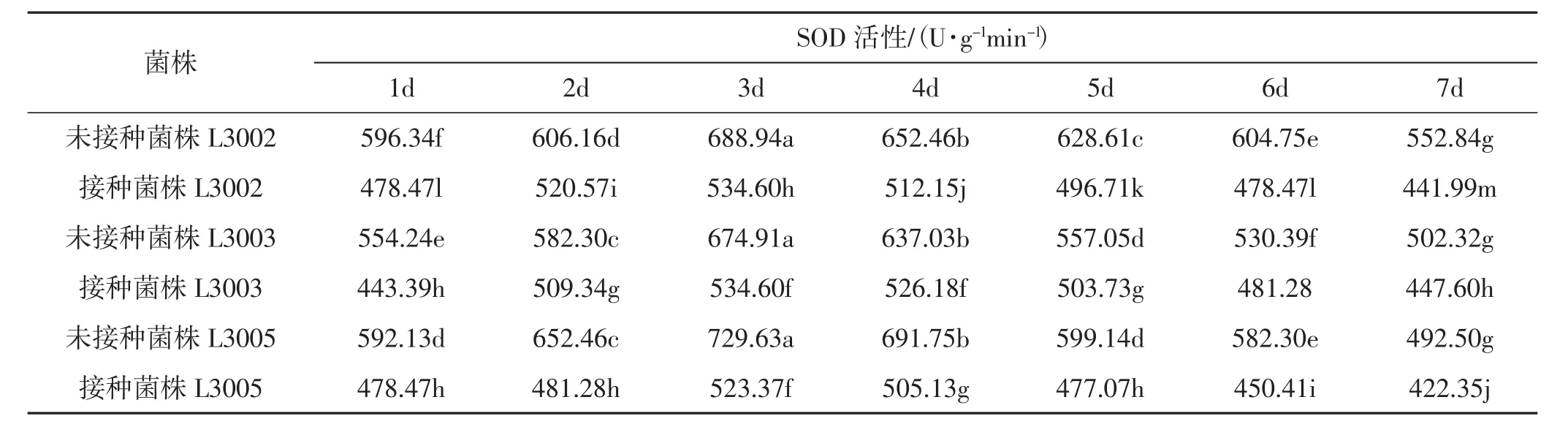
表4 不同金针菇子实体的SOD活性Tab.4 Changes of SOD activity in different Flammulina filiformis fruiting bodies
由表4、图4可知,不同金针菇菌株体内的SOD活性不同,波动不大。接种病原菌后,金针菇子实体内的SOD活性均呈上升趋势。接种病原菌后,3个菌株均在3 d达到了最大峰值。且L3005的SOD活性偏高于L3002和L3003。L3005的SOD活性增幅最大,最大酶活为 729.63 U·g-1min-1,是其对照的 1.4倍;L3002 的最大酶活为 688.94 U·g-1min-1,是其对照的 1.3 倍;L3003 的最大酶活为674.91 U·g-1min-1,是其对照的1.26倍。接种处理后,3个金针菇菌株子实体内SOD活性与未接种处理的酶活性差异性显著 (P<0.05)。
3 讨论
当生物被各类外源病原物侵染后,寄主细胞会调整自身体内生理生化和组织结构来适应外源物刺激以达到生存的目的,其中以参与各种代谢的防御酶类的活性变化最为明显[21]。苯丙氨酸解氨酶(PAL)、多酚氧化酶(PPO)、过氧化物酶(POD)、超氧化物歧化酶(SOD)均属于寄主防卫系统的相关酶类,在某种程度上诠释了寄主对病原菌的抗病程度,因此可以作为寄主抗病性的一个生理指标[22]。
异型葡枝霉菌侵染金针菇后,激活金针菇体内的主要防御酶系,使PAL、PPO、POD、SOD四种防御系酶的活性明显增高。这与周春元[23]对双孢蘑菇受湿泡病菌侵染后,双孢蘑菇体内的酶活性升高结果一致,也和大多前人对其他作物的研究结果一致[24-25]。接种异型葡枝霉菌后,相比对照未接种的3个金针菇菌株子实体内的防御酶活性均有变化,出现最大峰值。其中,金针菇菌株L3005的PAL、PPO、POD、SOD活性均高于L3003和L3002。不同金针菇品种体内防御酶活性变化不同,说明4种防御酶在不同金针菇品种受异型葡枝霉侵染的抗性机制中发挥了一定作用。可通过对不同金针菇品种防御酶活性的测定,为筛选金针菇抗性品种提供一定的科学依据。
4 结论
同一生长时期金针菇子实体体内防御性酶活性差异不大,且酶活性波动趋势相同。接种病原菌后,金针菇体内的酶活均有不同变化,且被病原菌侵染后一定时间内4种防御性酶的活力值均可达到峰值。金针菇接入病原菌后,其体内的酶活性与正常金针菇体内的酶活性差异显著(P<0.05)。其中,金针菇L3005的酶活性变化幅度均大于L3002和L3003,其活力值也偏高于二者。即金针菇L3005品种对异型葡枝霉菌的抗性更强。表明金针菇棉腐病的抗性和防御酶系之间相连密切,产生峰值前后时间可以作为金针菇抗病性的一个重要生理生化指标。
