糖皮质激素治疗IgG4相关自身免疫性胰腺炎缓解1例报告
2021-03-11王会敏韩际奥马英杰刘璨宇
王会敏,韩际奥,2,马英杰,2,刘璨宇
1.新乡医学院附属郑州人民医院,河南 郑州 450000;2.郑州消化病研究所,河南 郑州 450000
自身免疫性胰腺炎(AIP)是一种由免疫介导引起的特殊类型的胰腺炎,其发病率较低,在我国约占同期慢性胰腺炎的3.6%~9.7%[1]。ICDC 根据组织病理学特征[2]将其分为两种类型:I型,即淋巴浆细胞硬化性胰腺炎(LPSP), Ⅱ型,即特发性导管中心性胰腺炎(ICDP)。I 型AIP 属于IgG4相关疾病(IgG4-RD)的范畴,是IgG4-RD 的胰腺表现,因此此型又称为IgG4 相关性胰腺炎。由于本病累及胰腺,进而引起胰腺内外分泌功能障碍,故该病可以糖尿病或糖耐量受损为首发表现入院,也可引起消瘦、食欲减退、消化不良等消化系统症状。现就新乡医学院附属郑州人民医院消化内科收治的一例IgG4相关性胰腺炎经激素治疗后缓解的病例做简要报告。
1 病例介绍
患者男性,66岁,主因“食欲不振、乏力、困倦伴消瘦1 月”于2016 年2 月收入院。1 月前患者无明显原因出现食欲不振,进食量较前下降约1/2,伴乏力、困倦,体重下降约5 kg,无腹痛、腹胀、腹泻,无恶心、呕吐、黑便,无反酸、烧心,无发热、心悸、胸闷,发病以来,患者神志清、精神尚可,饮食差,睡眠一般,大小便未见异常,体重下降如前述。既往患“糖尿病”5 年,平素服用二甲双胍(0.5 g,每天一次),自诉控制尚可,患“高血压病”8 年,最高血压160/105 mmHg(1mm Hg=0.133kPa),平素服用非洛地平缓释片(10 mg,每天一次),自诉控制尚可,22 年前患“急性乙型黄疸型肝炎”,治愈,否认“结核”等传染病史。查体:体温36.5℃,血压105/65 mmHg,脉搏76次/分,呼吸18次/分,皮肤、巩膜中度黄染,未见蜘蛛痣及肝掌,双肺呼吸音清,未闻及干湿性啰音。心率76次/min,律齐,各瓣膜听诊区未闻及杂音,腹部无压痛、反跳痛及肌紧张,肝脾肋下未触及,Murphy征(-),移动性浊音(-),双下肢无水肿。入院后辅助检查:随机血糖:21 mmol/L,糖化:10.9%;血清脂肪酶307 U/L、胰淀粉酶187 U/L;血沉(ESR):51 mm/h;C 反应蛋白(CRP):11.4 mg/L;血 清 肿 瘤 标 志 物CA199、CEA、CA125、AFP、CA153、NES、CYP211、PSA 均正常;降钙素原正常;血常规、肝功、肾功、血脂、血电解质、甲功三项均正常。上腹部MRI 平扫+增强示(见图1):(1)胰头部结节影,胰体尾部肿大,伴脾动静脉受累,多考虑自身免疫性胰腺炎可能,建议结合临床及实验室检查,必要时短期复查以排除肿瘤性病变可能。(2)少量腹水。(3)肝顶部小囊肿。(4)左肾窦区异常信号,考虑复杂囊肿可能(肾盂旁囊肿伴出血?),建议必要时复查。(5)腹膜后多淋巴结可见或轻度增大。
为明确诊断进一步行抗核抗体谱、免疫球蛋白、补体、自身免疫性肝炎检测,结果回示:除抗核抗体(ANA)1:100 外,抗中性粒细胞抗体(ANCA)、抗环瓜胺酸肽抗体测定(CCP)、抗心磷脂抗体测定(ACA)、RA33抗体测定、抗核提取物抗体测定(抗ENA 抗体)、抗双链DNA测定(抗dsDNA)均为阴性;免疫球蛋白三项:IgM 0.46(0.6-5 g/L),IgG、IgA 正常;免疫球蛋白亚类测定:IgG4>8.73 g/L(正常值<2.01 g/L),补体正常。IgG4 较正常值升高4 倍,结合MRI 检查,考虑自身免疫性胰腺炎的可能性大,故经患者及家属同意后行CT 引导下经皮穿刺活检,并进一步送检细胞学及病理检查。胰头部穿刺病理结果回示(见图2):正常腺泡结构消失,残存导管上皮未见异型,间质弥漫炎细胞浸润伴纤维化,浸润炎细胞以浆细胞为主,不除外IG4 相关的自身免疫性疾病,请临床结合血清学等检查资料综合判断。补做免疫组化(2017 年4 月,见图2):CK 上皮+,CgA 胰岛+、Syn 胰岛+、CD56 胰岛+、Ki67 少量炎细胞+、CD38 浆细胞+、CD138 浆细胞+,IgG4(+)、IgG(+)、IgG4/IgG>40%,IgG4>10个/HPF。
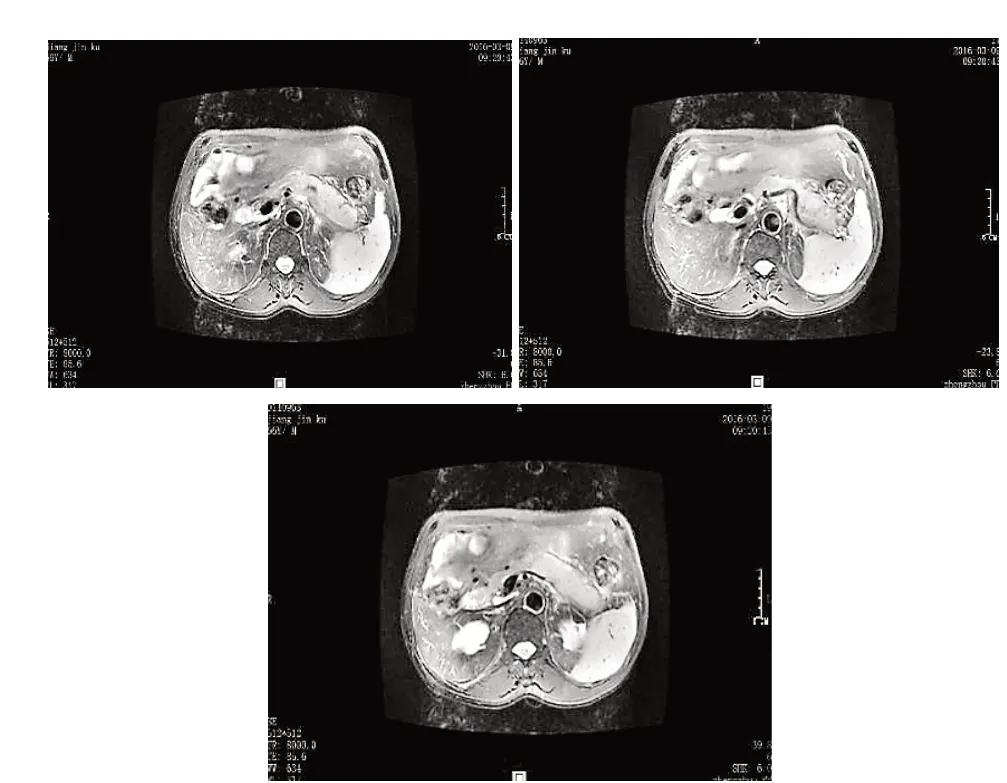
图1 胰腺MRI平扫+增强

图2 穿刺胰腺组织病理及免疫组化
2 讨论
IgG4相关自身免疫性胰腺炎是一类免疫介导的罕见的胰腺慢性炎症,患病率为4.6/10 万人[3-4]。由于该病较为罕见、缺乏特异性的临床症状、影像学表现不典型、临床医生对该病的认识不足及IgG4检查尚未普及等原因,在临床工作中容易出现漏诊,甚至常被误诊为胰腺癌,造成患者进行不必要的手术及抗肿瘤治疗。因此,早期诊断对于指导临床治疗和改善预后至关重要。本例患者为中老年男性,临床表现为食欲不振、乏力、短期内体重明显减轻,查体示皮肤巩膜中度黄染,结合MRI、血清IgG4升高及病理学结果回示均符合ICDC 对I 型AIP 的诊断标准[2],可明确诊断。患者明确诊断后,依据日本AIP 的治疗共识[5]给予口服糖皮质激素治疗,后分别于2016 年4 月、2016 年6月、2017 年10 月、2018 年8 月、2019 年10 月复查,病情稳定,未出现加重或复发迹象(分别见下图3、图4、图5、图6、图7)。并于2020 年5 月13 日再次复查发现胰腺结构正常(见图8),无胰腺外受累情况,IgG4 正常,已符合日本共识指南中AIP完全缓解的标准[5]。

图3

图4
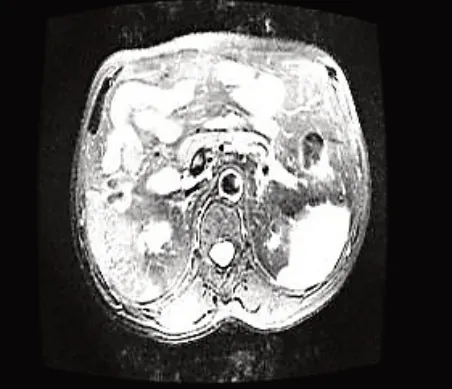
图5

图6

图7

图8
早在1995 年,吉田等人[6]首次提出了“自身免疫性胰腺炎”(AIP)一词。根据病理类型分为Ⅰ型与II 型,两者在病理学、临床表现、血清IgG4、流行病学等方面存在着很大的差异,与II 型相比,临床上Ⅰ型更为常见,目前对Ⅰ型AIP 的研究也更深入,本例报道的也是Ⅰ型AIP 患者。Ⅰ型AIP 常发生于中老年男性,平均年龄为66岁,男女比例为3.2∶1[7],本例患者符合流行病学特征。有研究发现IgG4 相关性疾病(包括IgG4 相关性胰腺炎)与职业暴露因素有关,一项关于牛津大学的44 名确诊的IgG4-RD患者的队列研究中,发现61%的患者是蓝领工人,他们回忆有长期接触潜在有害化合物的情况,此结果表明,长期暴露于溶剂、工业粉尘和金属粉尘等群体对IgG4-RD 有潜在的致病作用[8]。本病最见的临床症状是梗阻性黄疸,部分患者也常出现体重减轻、腹痛及腹部不适[9]。一项IgG4相关自身免疫性胰腺炎的回顾性分析发现黄疸发生率为64.9%,腹痛发生率为63.4%,体重减轻发生率为39.1%[10]。目前采用的是ICDC[2]的诊断标准,主要包括影像学、血清学(IgG4升高)、胰腺病理、胰腺外器官受累及对糖皮质激素治疗敏感性5 个指标。其中IgG4 是诊断本病的唯一血清学指标,也是诊断该病的重要指标。Ngwa 等认为在IgG4相关胰腺炎患者中IgG4升高超过正常值上限的2倍更为常见[11]。 组织病理学是诊断该病的金标准,也是与其他疾病鉴别,如胰腺癌、Ⅱ型自身免疫性胰腺炎、胆管癌的主要手段。ICDC[2]指出IgG相关自身免疫性胰腺炎的主要病理表现包括席纹状纤维化、闭塞性静脉炎、IgG4阳性浆细胞浸润等,本例患者病理学检查结果符合ICDC的诊断标准[2]。免疫组织化学染色的主要特征为大量IgG4 阳性浆细胞浸润,IgG4 阳性与IgG 阳性细胞比值>40%[12],本例符合,见图2。
对于该病明确诊断排除禁忌症后,首选糖皮质激素治疗,大部分患者可实现临床缓解。但是目前仍缺乏国际公认的激素治疗剂量与疗程。 日本专家共识[13]推荐在2~3个月内逐渐减至维持剂量,影像学及血清学改善后维持治疗3 年。国内经验是诱导缓解后逐渐减至最小剂量维持2~3 年。而欧洲及北美地区则倾向于在缓解后完全终止激素治疗[14]。本例患者一开始给予口服泼尼松初始剂量为40 mg/日,疗程4周,后以每1~2周减量5 mg 的速度逐渐减量,疗程2个月,至每日5 mg转为维持治疗,总疗程已达3 年。激素治疗对缓解临床症状、改善胰腺组织结构、减轻胰腺外器官的受累等具有较好的疗效。有日本的一项多中心研究显示,I型AIP的患者经激素治疗后缓解率可达98%~100%[15]以及另一项关于对684 例的国际多中心研究发现其缓解率为99.6%[16]。
IgG4相关的自身免疫性胰腺炎诊断较困难,对于疑似病例尽可能说服患者做病理学检查,以免误诊为胰腺癌,因为两者在治疗和预后上完全不同,病理学确诊可以减少不必要的手术治疗,改善预后。本病大部分患者预后良好,然而长期预后尚不明确。目前其发病机制、长期预后等尚缺乏大规模的临床资料;对于病理学检查不典型、影像学检查难以与胰腺癌区分时,能否应用激素试验性治疗;复发患者常见的危险因素仍不明确;关于AIP 伴有糖尿病的患者如何判断两者是继发的还是共病关系;关于这些尚待解决的问题仍需要进一步研究。
