核盘菌菌丝内POD 和SOD 活性与其对大豆致病力关系初探
2021-03-11李易初石凤梅马立功刘佳孟庆林
李易初,石凤梅,马立功,刘佳,孟庆林
(黑龙江省农业科学院植物保护研究所,哈尔滨 150086)
大豆是人类主要粮食作物之一,具有高营养价值、高生理活性和广泛工业用途的宝贵农业资源[1]。大豆菌核病的病原菌是核盘菌(Sclerotinia sclerotiorum(Lib.)de Bary),隶属于子囊菌门、盘菌纲、柔膜菌目、核盘菌科、核盘菌属[2]。核盘菌在全球范围内可危害400 多种植物,是一种世界性分布、寄主众多,极具破坏性的植物病原真菌[3-4]。大豆菌核病在我国黑龙江、内蒙古等地发生较为严重,病害流行年份可造成大豆减产20%~30%,严重地块损失达50%以上。菌核病不仅能造成大豆产量的严重损失[5],还会影响大豆的蛋白质、油分含量和外观品质[6]。
研究发现核盘菌生长繁殖过程中,H2O2与菌核的形成密切相关,菌丝内H2O2含量达到一定水平后,核盘菌才能由营养菌丝生长阶段转变到菌核形成的Initial 阶段[7]。阻止核盘菌H2O2积累,会影响菌核形成,核盘菌更多以菌丝形态存在,菌丝体可直接侵染寄主植物,是核盘菌常见的侵染方式,H2O2参与核盘菌的侵染、繁殖及抗逆过程。超氧化物歧化酶SOD(superoxide dismutase)普遍存在于生物体内,它是一种参与氧代谢的酶[8];过氧化物酶POD(Peroxidase)是一种活性较高的氧化还原保护酶[9]。生物体内POD及SOD 是参与氧化还原反应的关键酶,POD 主要以H2O2为电子受体催化底物氧化;SOD 能催化超氧阴离子转化成H2O2和O2[10]。研究表明当病原入侵寄主植物时,寄主植物会释放O2-和H2O2[11],核盘菌侵染寄主时,H2O2被相关酶快速分解,会影响植物初期防御抗性;H2O2被快速分解后能阻止核盘菌形成菌核,未萌发成子囊盘的菌核无法释放子囊孢子侵染寄主,而核盘菌菌丝具有侵染性,分解H2O2的酶类活性会影响核盘菌菌株的致病力。目前,关于核盘菌致病机理的研究主要集中在病原菌侵染时产生的各种酶类及草酸毒性[12-14],国内外鲜见病原菌自身氧化酶活性差异与致病力强弱关系的研究报道,致病力强弱与POD 及SOD 活性关系尚未明确。因此,试验针对这一问题开展初步研究,通过强弱致病力差异菌株自身POD 和SOD 活性比较,分析核盘菌致病强弱与POD 和SOD 活性的关系,明确POD 及SOD 活性对核盘菌致病力的影响,为揭示核盘菌致病力机制提供新的思路,为进一步揭示核盘菌致病力差异和致病机理提供理论支持。
1 材料与方法
收集黑龙江省不同地区不同地块的大豆菌核病样本,根据采集地点编号。菌核浸泡在75%乙醇溶液30 s 表面消毒,无菌水冲洗干净,用手术刀切取菌核薄片,滤纸吸干菌核薄片水分,摆放在PDA 平板25 ℃条件培养,试验物品提前消毒灭菌,所有操作均在无菌条件下进行[15]。按照上述方法分离得到大豆菌核病菌株10 份(见表1),4 ℃保存备用。

表1 供试菌株编号及采集地点Table1 The strains numbers of S.sclerotiorum on soybean and collecting locations
1.1 核盘菌菌株致病力分化
选择室内离体叶片接种法进行菌株间致病力差异试验[16],根据培养相同时间侵染形成的病斑大小,判断菌株致病力强弱。盆栽播种感病大豆品种农青豆,28 d 后摘取植株最新一片完全展开的健康三出复叶进行试验。供试菌株在PDA 平板活化72 h,沿菌落外缘打取R=0.5 cm 菌块。菌碟摆放于复叶的中间叶片,注意避开主叶脉,接种时将着生菌丝一面贴合在叶面上,轻压菌块贴紧叶面不掉落[17]。每个供试菌株设3 次重复,对照处理组接种同等大小的纯PDA 块。试验过程中延长离体叶片存活时间,摘取叶片时保留叶柄,接种后叶柄包裹湿润脱脂棉保湿。接种叶片集中摆放在铺有湿润纱布的平盘中,保鲜膜覆盖包裹平盘,25 ℃恒温保湿培养,所有试验用品提前灭菌消毒。72 h 调查发病情况并测量病斑直径,十字交叉法测量病斑直径,每个病斑在3 个不同不位置测量直径取平均值。
1.2 酶粗液的提取
1.2.1 POD 酶粗液的提取
灭菌冷凝的PDA 平板上平铺一层灭菌的玻璃纸,核盘菌PDA 平板活化72 h,外缘5 mm 菌块摆放在玻璃纸中心25 ℃培养,每个菌株培养3 皿,培养时间和致病力试验时间一致72 h。粗酶液提取方法结合酶活测试盒推荐方法并在实际操作过程中略有改动[18]。刮取3 皿玻璃纸的菌丝存放在5 mL 离心管,用液氮迅速冷冻保存备用。取0.6 g 菌丝加入5 mL 50 mmol·L-1预冷的 PBS 缓冲液(pH=7.4),在预冷的研钵研磨充分(或用匀浆器匀浆),样本保持温度2~8 ℃,离心 0.34 h(3 000 r·min-1),收集上清液,即为粗酶液。每个样品取1 mL 粗酶液待检测,其余粗酶液分装冷冻备用。粗酶液提取后尽快试验,若不能马上试验,需将标本放置在-20 ℃冰箱保存,试验过程中避免反复冻融。
1.2.2 SOD 酶粗液的提取
SOD 粗酶液提取方法与POD 酶粗液提取方法相同。
1.3 酶活性的测定
1.3.1 POD 酶活性测定
按照POD 测试盒48 T(购自上海酶联生物技术有限公司)说明书的方法测定酶活性。根据试剂盒说明设置标准品孔、空白对照孔及待测样品孔。标准品孔各加不同浓度的标准品50 μL;空白对照孔不加样品及酶标试剂,其余各步操作相同;待测样品孔中先加样品稀释液40 μL,然后再加待测样品10 μL(样品最终稀释度为5 倍)。加样时需将样品加于酶标板孔底部,轻轻晃动混匀,加样过程中尽量不触及孔壁。每孔加入酶标试剂100 μL,空白孔除外。用封板膜封板置37 ℃温育1 h,揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30 s 后弃去,如此重复5 次,拍干。每孔顺次加入显色剂A 50 μL,显色剂B 50 μL,轻轻震荡混匀,37 ℃避光显色 0.25 h。每孔加终止液50 μL,终止反应(此时蓝色立转黄色)。加入终止液0.25 h 后,以空白孔调零,450 nm 波长依序测量各孔的吸光度(OD 值)。标准物的浓度为横坐标,OD 值为纵坐标,根据样品的OD 值由标准曲线查出相应的浓度;再乘以稀释倍数,即为样品的实际浓度。
1.3.2 SOD 酶活性测定
按照SOD 活性测试盒48 T(购自上海酶联生物技术有限公司)说明书方法测定SOD 活性,试验原理与步骤与POD 活性测定试验相同。
1.4 数据分析
用SPSS 22.0 软件分析试验数据。
2 结果与分析
2.1 核盘菌致病力差异
接种72 h 用十字法测量叶片病斑直径,供试菌株侵染得到病斑直径数据见表2,按照病斑直径从小到大顺序排列供试菌株。菌株BQI033 接种72 h 后,PDA 菌块气生菌丝生长缓慢,与叶片贴合处未见菌丝侵染,接种处大豆叶片完好,无病斑形成,仅记录接种菌块直径;BQI031 接种菌块气生菌丝生长延伸至大豆叶片表面,菌块最外圈接触的叶片部位颜色发生变化,病部叶片颜色变深、水浸状,记录病斑直径0.6 cm;QD003 接种处褪绿,可见不规则病斑,病部叶片呈橄榄绿色,病斑直径为1.0 cm。QA009 接种菌块着生白色菌丝团,接种处病斑较大、病部叶片深褐色,黄晕明显,病斑扩大不受叶脉限制;TY058 侵染致病面积最大,接种菌块缩小变薄,琼脂颜色变深,病斑黑色圆形外缘有黄晕,病斑处组织湿腐伴有白色菌丝生长(如图1)。菌株BQI033、BQI031 和QA001 接种叶片未见明显病斑,仅观察到接种菌块菌丝生长;菌株 QD003、MS010、BQ025 和 QA009 侵染形成病斑直径≥1.0 cm,发病部位叶片颜色变深,接种处出现菌核病发病初期特征性水浸状病症;菌株 QA009、HG011、BA007 和 TY058 形 成 病 斑 直径≥1.5 cm,病部近圆形,病斑黑褐色,外圈颜色发黄。
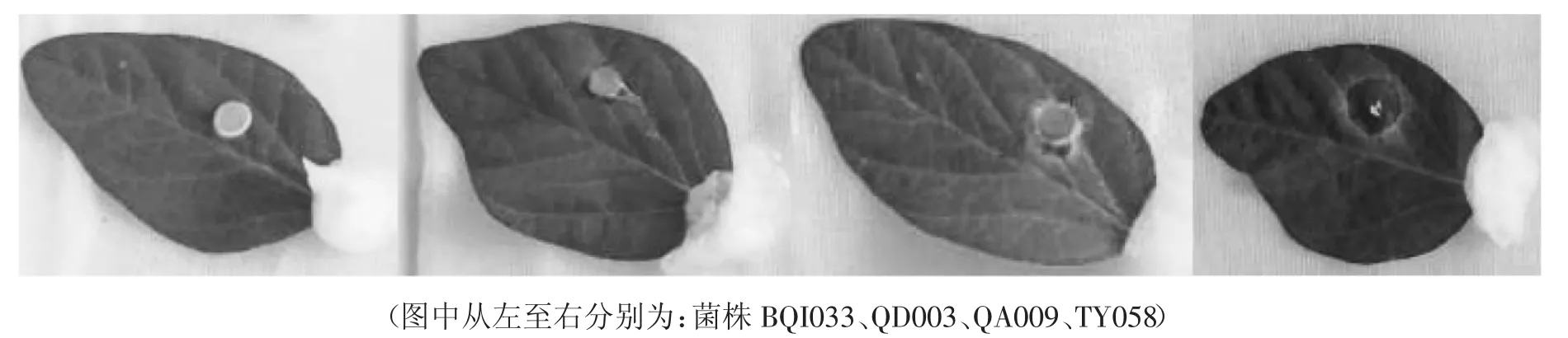
图1 接种不同菌株形成的差异病斑(72 h)Fig.1 The disease spot different after inoculated with different strains(72 h)
SPSS 22.0 分析数据可知,10 个菌株接种后得到的病斑直径差异较大,差异极显著。试验数据进行单因素方差分析,供试菌株的致病力差异在P<0.05 水平差异极显著。根据供试菌株病斑直径差异可知试验核盘菌的菌株间致病力存在差异,接种后病斑较小其致病力较弱,病斑较大其致病力较强。结合病样采集地点,致病力较弱菌株BQI033、BQI031 均来自双鸭山市宝清县;同来自绥化市庆安县的菌株QA0013 和QA009,虽病样采集地点相同,但致病力差异较大,病斑直径差0.87 cm;菌株BQI031 和QA001 病斑直径差异较小仅为0.03 cm,但样品采集地点不同,分别来自宝清县和庆安县。试验结果表明:黑龙江省内核盘菌菌株间致病力存在较大差异,致病力强弱差异与采集地点无相关性。菌株来源相同,存在致病力分化;来源不同的菌株,致病力表现也有相同。

表2 致病力分化试验结果(72 h)Table 2 The test results of differentiation pathogenic( 72 h)
2.2 核盘菌体内POD 及SOD 酶活性关系
菌株按照致病力从弱到强顺序排列,记录POD 和SOD 酶活试验结果见表3:BQI033 的SOD 酶活值为642.16 U·g-1,是供试菌株中 SOD 酶活最低值,其菌内POD 酶活值1.15 U·g-1也为最低值;菌株TY058的SOD 酶活值是1 493.34 U·g-1,在供试菌株SOD酶活值中最高,其POD 酶活值也为最高值2.61 U·g-1。10 个菌株中有4 个菌株体内POD 与SOD 活性排序相同,分别为菌株 BQI033、BQI031、BQ025 和TY058,占总体菌株的40%;3 个菌株体内二种酶活在总体排位相近仅差一位,分别是QA001、QA009 和BA007,占总体菌株的30%。余下3 个菌株体内中POD 与SOD 酶活性表现略有差别,QD003 菌株SOD 活性偏弱,SOD 活性较强;MSO10 体内 SOD 活性较强,在所有菌株SOD 活性中排在第二位是1 052.37 U·g-1,而POD 酶活性偏低,是总体菌株的第七位;HGO11 的POD 活性较高,排在所有菌株POD 酶活性的第二位,其SOD 活性只排在第五位。试验发现单菌株体内的POD 及SOD 两种酶活性存在相似性,POD 活性强,SOD 活性也强,SOD 在生物体内主要是清除其体内的氧自由基;POD 酶起到催化过氧化氢、氧化酚类和胺类并消除其毒性的作用,两种酶在功能上相辅相成。70 %供试单菌株体内两种酶活性在总体菌株的排序位置相同或相近,核盘菌菌株体内SOD 和POD 酶活性表现相似。通过试验结果可知,POD 和SOD 两种酶的活性强弱随着核盘菌菌株不同存在个体差异,两种酶在同一菌株中的活性表现相同或相近,活性强弱相似,仅有少数菌株中SOD 和POD 酶活性存在差异。
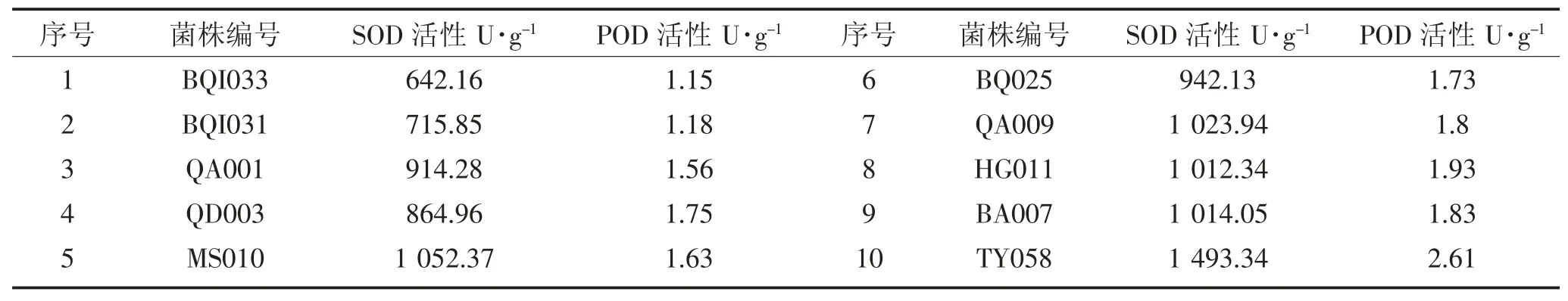
表3 核盘菌供试菌株内SOD 及POD 酶活性Table 3 The relationship between SOD and POD enzyme activity in strains
2.3 核盘菌POD 活性比较
按致病力强弱顺序排列供试菌株样品并对比POD 活性测定结果,菌株 BQI033、BQI031 和 QA001的致病力较弱,侵染形成的病斑直径均<1.0 cm,上述3 个菌株体内的 POD 酶活值均<1.6 U·g-1;菌株QD003、MS010、BQ025、QA009、HG011 和 BA007 侵染得到的病斑直径在1.0~2.0 cm 之间,POD 活性测试结果在 1.6~2.0 U·g-1之间;菌株 TY058 的致病力最强,POD 活性亦最强,病斑直径为2 cm,POD 酶活值为2.61 U·g-1(如图2 所示)。试验结果可知,供试菌株中大部分菌株的菌内POD 活性与菌株的致病力正相关,菌株致病力强,其体内POD 活性也强,随着不同菌株致病力的增强,不同菌株体内POD 活性值也增大。其中,供试菌株 QD003 的 POD 活值是 1.75 U·g-1,相邻菌株 MS010 的 POD 酶活性为 1.63 U·g-1,QD003 较MS010 的致病力弱,而POD 酶活性却略强于 MS010;菌株 BA007 的 POD 活性是 1.83 U·g-1,而致病力稍差的HG011 体内POD 活性却高于BA007是 1.93 U·g-1。菌株 QD003 和 BA007 的 POD 酶活性未完全与菌株的致病力强弱正相关,推测原因可能是相邻菌株间致病力差异较小,POD 活性变化不明显。由结果初步推测:核盘菌内不同菌株致病力不同,致病力强的菌株,菌株体内POD 活性强。随着供试菌株致病力从弱到强顺次排序,不同菌体内POD酶活值逐渐增大,10 个菌株的酶活值总体趋势递增。

图2 病斑直径与菌株内POD 酶活性的关系Fig.2 The relationship between spot diameter and POD enzyme activity in strains
2.4 核盘菌SOD 活性比较
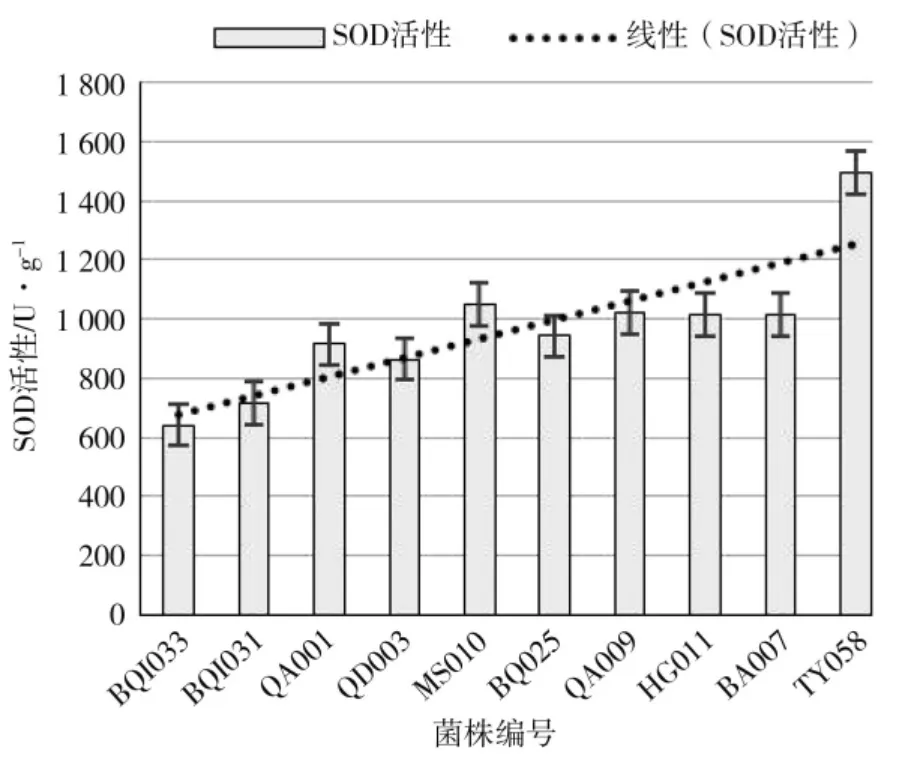
图3 病斑直径与菌株内SOD 酶活性的关系Fig.3 The relationship between spot diameter and SOD enzyme activity in strains
菌株QA009 到TY058 的致病力较强,侵染形成的病斑直径≥1.5 cm,SOD 酶活性均高于1 000 U·g-1;菌株BQI033 和TY058 致病力差异最大,两株菌株对应的SOD 酶活性之差>800 U·g-1,酶活性分别为642.16 U·g-1和 1 493.34 U·g-1;其中 QA001 和MS010 较致病力相似的相邻菌株的SOD 酶活性高,未与趋势线完全吻合。菌株BQI033、BQI031、QA001的致病力逐渐增强,3 个菌株内的SOD 酶活数值亦依次递增;从菌株BQ025 到TY058,不同菌体内SOD酶活性值大小与菌株致病力强弱关系一致。观察所有供试菌株SOD 活数值,不同菌株间SOD 酶活值总体趋势与菌株致病力强弱变化相关。菌株之间QA001、QD003 和 MS010 的 SOD 酶存在波动,两个菌株的SOD 活性未完全与菌株致病力变化一致。
综上所示,同属一个菌株的POD 及SOD 酶活性变化趋势相同,不同菌株间POD 及SOD 酶活性存在差异;SOD 酶活试验结果与POD 酶活结果总体表现一致,随着菌株致病力的增强,菌株体内SOD 及POD 酶活性也较致病力弱的菌株的酶活值大,不同菌株间酶活性变化趋势与菌株致病力强弱变化表现一致。从菌株内SOD 和POD 活性趋势及与致病力强弱的关系等不同角度分析,发现少数菌株间酶活性和致病力关系存在差异,供试菌株中酶活性未完全按照致病力增强而增大的菌株均出自菌株QA001、QDOO3 和MS010。推测此种情况出现的原因,菌株个体存在差异或因菌株间致病力差异较小,酶活变化不明显所致。具体原因有待下一步试验证明,核盘菌的致病力与其体内POD 及SOD 酶活性的关系仍需进一步验证。
3 讨论
通过试验发现黑龙江地区大豆菌核病致病菌株间致病力差异显著,存在核盘菌致病力分化现象,并明确致病力分化与菌株来源地无明显相关性,此研究结果与刘春来等[19]研究结果一致。也有试验发现不同采样地点的大豆菌核病病原菌,它们的菌落形状和生长速率差异极显著,核盘菌存在区域专化性[20]。大豆菌核病生物学特性研究存在区域转化性,而致病力强弱却受地理因素影较小,核盘菌菌丝的生长速度与致病力强弱密切相关,近几年黑龙江省大豆种植面积减少且不集中,菌核样品采集数量有限,对核盘菌致病机制仍需继续研究。
研究报道发现核盘菌中菌丝体与死体营养体菌核的形态转变与其体内的氧含量有关,核盘菌菌株体内氧含量增高时,菌丝体向死体营养体菌核变化;反之,核盘菌内SOD 和POD 酶活性大,可快速分解催化体内的过氧化氢和氧自由基[21],菌株体内氧含量少,核盘菌仍处在可直接侵染寄主的菌丝体状态,具有较强的致病力。当病原菌侵染寄主植物时,寄主在调动体内最早期的防卫反应时会产生大量的活性氧[22],妨碍病原菌的定殖侵染。菌株体内的POD 及SOD 活性较强,在侵入寄主体内时,不断进行氧化还原反应催化活性氧转变成O2和H2O,阻断信号传导并减弱寄主的抗性反应,寄主易被侵染,因而菌株表现为致病力较强。核盘菌菌态与致病力的关系和核盘菌侵染过程中阻断信号传递与致病力的关系两方面分析,菌株体内POD 和SOD 活性均与菌株致病力相关,试验得到核盘菌菌内参与氧化还原酶活性与致病力正相关结果一致。通过试验初步推断,核盘菌致病强弱与菌株体内POD 和SOD 酶活性呈正相关,菌株致病力越强,菌株体内POD 及SOD 酶活性越强。由于核盘菌致病机理研究中对病原菌本身氧化还原酶活性研究较少,分析比较的报道较少,核盘菌菌体内POD 和SOD 活性与致病力关系需进一步试验,同时仍需不同来源地核盘菌试验验证。
4 结论
黑龙江地区大豆菌核病菌致病力分化较大,同地区核盘菌菌株存在致病力分化现象,且此种分化与菌株来源地无相关性。试验初步发现核盘菌菌内POD 活性与SOD 活性表现相近,同一菌株体内POD酶活性强,则SOD 活性亦强;核盘菌致病强弱与菌体内POD 及SOD 酶活性呈正相关,核盘菌致病力越强,POD 及 SOD 活性越强。
