育雏早期应用氟苯尼考对禽腺病毒感染雏鸡病情的影响
2021-03-10孟凡亮刘蒙昊宋一诺曹龙龙焦秋林肖一红刘思当
孟凡亮,刘蒙昊,宋一诺,张 慧,李 焱,曹龙龙,焦秋林,肖一红,刘思当*
(1.山东农业大学 动物科技学院 山东省动物生物工程与疾病防治重点实验室/山东省畜禽疫病防制工程技术研究中心,山东 泰安 271018;2.武汉大学 药学院,湖北 武汉 430072)
氟苯尼考(florfenicol,FLO)为目前动物专用的广谱抗菌药物。该药最初于20世纪90年代被研发成功,作为氯霉素和甲砜霉素的替代药物而被广泛应用于畜禽和水产养殖[1]。该药进入细菌菌体后可以与其核糖体50S大亚基上的A位点紧密结合并影响肽链延伸过程中肽酰转移酶的转肽反应,使肽链的延长被终止,最终达到抑制细菌蛋白质生成和抗菌的目的[2]。但近年来,其毒副作用开始受到人们的关注且相关报道也越来越多。截至目前,已被报道的FLO的毒副作用包括造血和免疫毒性[3-5]、基因毒性[6]及胚胎毒性[1]等。研究表明,FLO考虽然不会造成机体的再生障碍性贫血,但能够导致机体较强的免疫抑制。
禽腺病毒(fowl adenovirus,Fadv)是无囊膜的双股DNA病毒,根据其抗原性的不同,禽腺病毒被分为3个群(Fadv-Ⅰ~Ⅲ),Ⅰ群禽腺病毒又分为5个亚群(A~E)、12个血清型(Fadv-1~11,其中Fadv-8又分为a和b 2个型)[7-9]。1987年,巴基斯坦的安卡拉第1次发生了心包积液综合征(HPS),所以又有“安卡拉病”之称[10],该病由Ⅰ群的血清4型禽腺病毒(Fadv-4)所引起,主要病变是心包腔内有清亮或胶胨样积液和肝脏出血性坏死及形成核内包涵体。之后,HPS在世界各地多有发生的报道,包括韩国[11]、日本[12]、波兰[13]和匈牙利[14]。自2015年以来,该病在我国暴发流行,使养鸡业遭受巨大的经济损失。
本试验通过对Fadv-4感染SPF雏鸡并应用饮水给药,监测死亡及排毒情况,并对免疫器官干扰素相关基因及细胞因子基因表达情况进行检测,综合评价应用FLO对禽腺病毒感染雏鸡病情的影响,进一步认识FLO的毒副作用,为临床合理使用氟苯尼考提供参考。
1 材料与方法
1.1 试验动物及主要试剂SPF鸡胚及雏鸡购自山东省农业科学院家禽所;FLO粉剂(含量≥98%)购自浙江国邦药业有限公司;TRIzol试剂购自TaKaRa宝生物工程 (大连) 有限公司;DMEM培养基购自HyClone公司;胎牛血清 (FBS) 购自北京全式金生物技术有限公司;反转录试剂盒、SYBR Green qPCR试剂盒购自东洋纺公司。
1.2 试验设计将90羽1日龄SPF雏鸡随机分为3组,即对照组、Fadv-4组、Fadv-4+FLO组,每组30只。雏鸡3日龄时进行颈部皮下注射攻毒,每只鸡107TCID50/0.2 mL,同时用药组3日龄开始饮水给药FLO(100 mg/L),连续给药5 d。其中,每组10只鸡用来统计死亡情况,每天观察各组雏鸡状态并进行记录。每组另外20只鸡采集泄殖腔棉拭子进行排毒情况检测,采集脾脏、法氏囊及胸腺3种免疫器官进行免疫器官指数测定及基因表达情况检测。
1.3 病毒滴度测定选取9日龄鸡胚分离原代肝脏细胞,用排枪将消化好并且混匀的100 μL细胞接种于96孔板,待细胞生长至80%时,进行10倍梯度接毒,病毒选用本实验室前期分离纯化的血清4型禽腺病毒,37℃、5%CO2恒温培养箱培养5 d后,根据Reed -Muench方法计算毒株的TCID50。
1.4 引物设计与合成根据文献报道,设计合成Fadv引物[15]、管家基因β-actin及目的基因IRF-7、2′-5′OAS、MX1[16]、IFN-γ[17]、IL-6[18]及TNF-α[19]引物,经Blast验证,初步判定引物具有较好的特异性。引物冻干品由上海生工生物工程技术服务有限公司合成,用前用DEPC处理的灭菌超纯水稀释为10 μmol/L的浓度,分装后于-20℃冰箱冻存备用。
1.5 样品核酸提取棉拭子病毒DNA使用北京全式金EasyPure Viral DNA/RNA Extraction Kit提取病毒核酸,免疫器官总RNA用TRIzol法进行提取。
1.6 反转录及qPCR反转录过程参照东洋纺ReverTra Ace qPCR RT Master Mix with gDNA Remover试剂盒的说明书操作,qPCR体系参照东洋纺SYBR®Green Real-time PCR Master Mix试剂盒说明书进行。
1.7 数据处理与分析采用SPSS 20.0软件对试验数据进行生物统计分析,用GraphPad prism 7.0软件绘制图。数据的分析运用ANOVA单因素分析和LSD假定方差齐性分析来进行各试验组之间的差异性比较,并以P<0.05判定为差异显著。
2 结果
2.1 不同处理组雏鸡死亡情况比较分析结果对3个组的雏鸡死亡情况进行统计分析发现,2个攻毒组都是在攻毒后4 d开始出现死亡,攻毒后5 d达到死亡高峰,Fadv-4+FLO组在攻毒后7 d雏鸡全部死亡,Fadv-4组最后仍有20%的存活率,对照组全程无死亡情况(图1A)。对每天的病死率进行统计分析发现,Fadv-4+FLO组每天的病死率基本都显著高于Fadv-4组(图1B)。

A.不同组雏鸡生存曲线;B.攻毒雏鸡病死率。*.P<0.05; **.P<0.01;***.P<0.001。下同
2.2 泄殖腔排毒情况监测结果在攻毒后1~5 d采集2个攻毒组的泄殖腔棉拭子,用qPCR方法对2个攻毒组的排毒情况进行检测。结果显示,在攻毒后1~3 d Fadv-4+FLO组的排毒量略低于Fadv-4组,但差异不显著;攻毒后 4,5 d,即死亡高峰期时,Fadv-4+FLO组的排毒量开始高于Fadv-4组,差异也不显著(图2)。
2.3 病理学变化攻毒后5 d对不同组雏鸡进行剖检观察,可见Fadv-4组(图3A,B)及Fadv-4+FLO组(图3D,E)均具有典型的血清4型禽腺病毒感染病变,表现为心包积液及肝脏变性肿胀及出血病变;肝脏组织切片可见肝脏细胞呈现颗粒变性和空泡变性,多见灶状坏死,并见大量淋巴细胞与巨噬细胞浸润,肝细胞核内有嗜酸性或嗜碱性包涵体(图3C,F),并且Fadv-4+FLO组的病变更加严重。
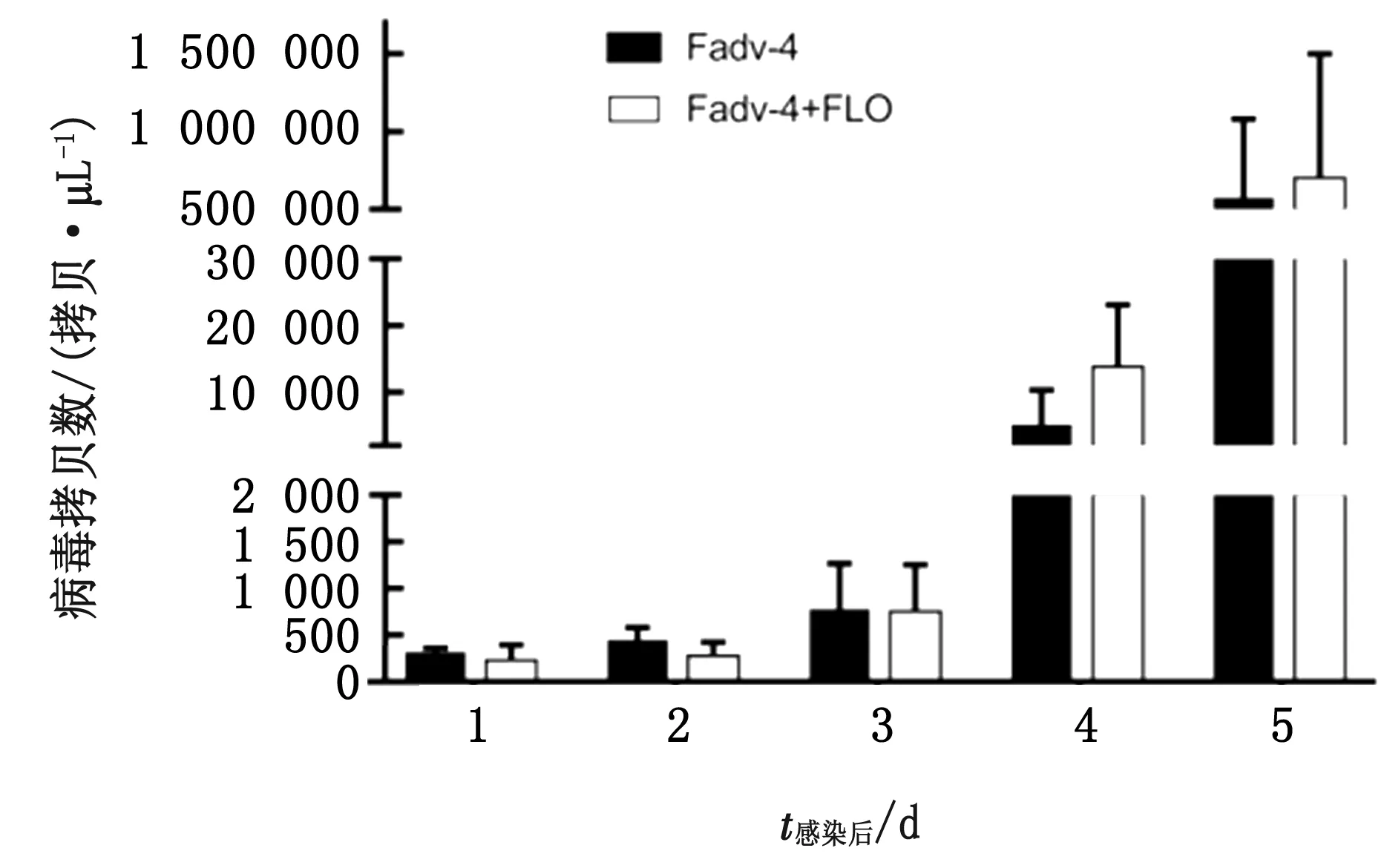
图2 排毒情况
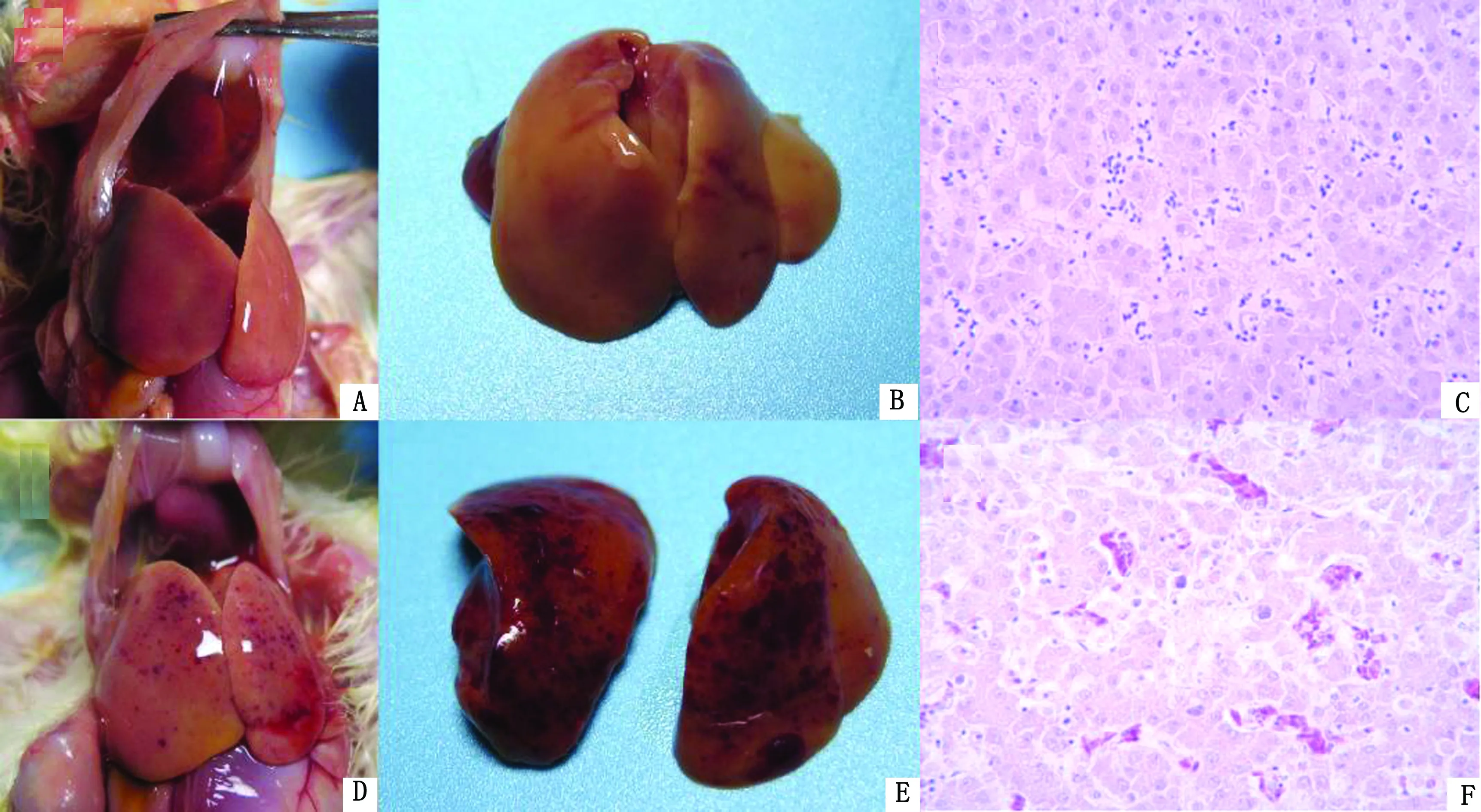
A~C.Fadv-4组雏鸡剖检及肝脏镜检病变;D~F.Fadv-4+FLO组雏鸡剖检及肝脏镜检病变
2.4 免疫器官指数比较结果对不同处理组脾脏、法氏囊及胸腺等3种免疫器官的器官指数进行了测定,发现2个攻毒组的脾脏器官指数在攻毒后3 d略低于对照组,但差异不显著;攻毒后5,7 d,2个攻毒组的脾脏器官指数均高于对照组,但是Fadv-4+FLO组低于Fadv-4组(图4A)。2个攻毒组的法氏囊器官指数在攻毒后3 d略高于对照组,在攻毒后5,7 d,2个攻毒组显著低于对照组,并且Fadv-4+FLO组低于Fadv-4组,但差异不显著(图4B)。2个攻毒组的胸腺器官指数均低于对照组,并且Fadv-4+FLO组低于Fadv-4组,且在攻毒后7 d时差异显著(图4C)。
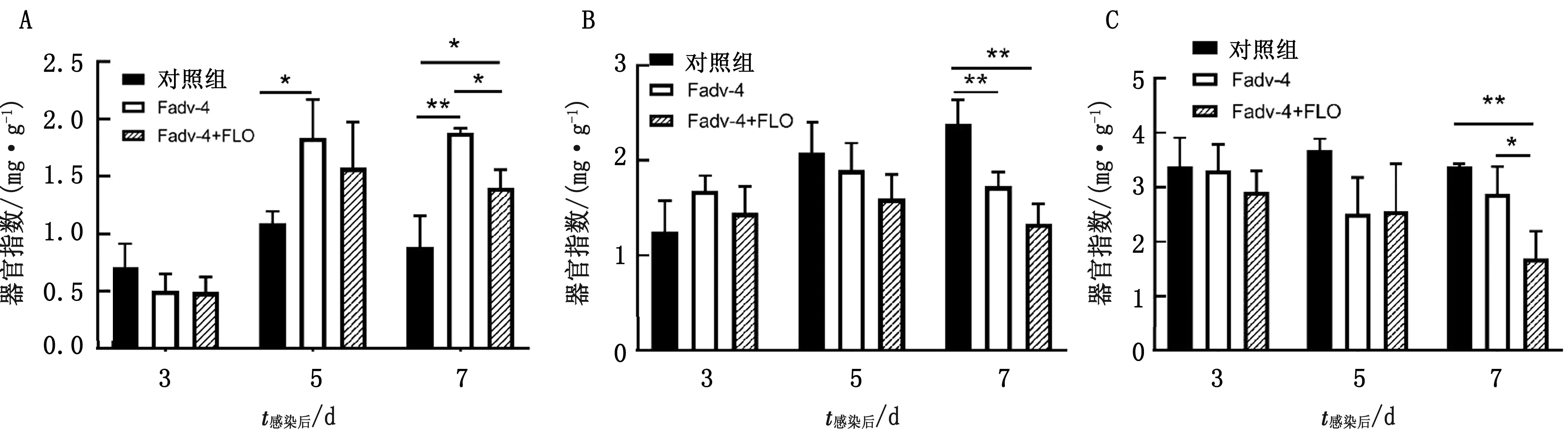
A.脾脏;B.法氏囊;C.胸腺
2.5 干扰素相关基因表达情况比较分析结果用qRT-PCR的方法对攻毒后5 d 3种免疫器官中的干扰素相关基因表达情况进行了检测分析,结果显示在脾脏中Fadv-4+FLO组的IRF-7的表达量显著低于Fadv-4组及对照组,2个攻毒组2′-5′OAS及MX1的表达量均显著高于对照组,并且Fadv-4+FLO组低于Fadv-4组(图5A);在法氏囊中IRF-7的表达量3个组无明显差异,2个攻毒组2′-5′OAS及MX1的表达量均显著高于对照组,并且Fadv-4+FLO组显著低于Fadv-4组(图5B);在胸腺中2个攻毒组IRF-7、2′-5′OAS及MX1的表达量均显著高于对照组,并且Fadv-4+FLO组IRF-7及2′-5′OAS表达量显著低于Fadv-4组(图5C)。
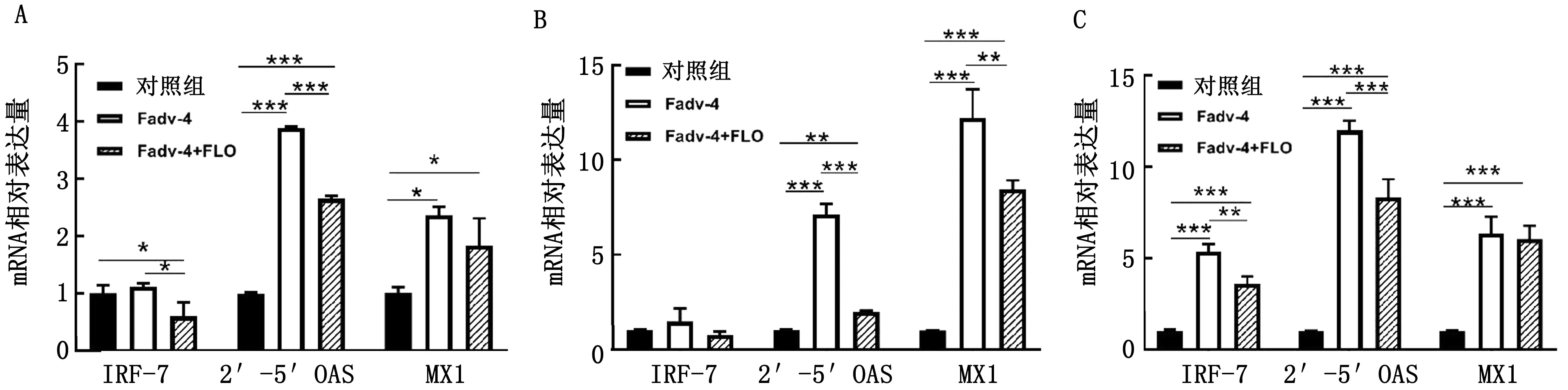
A.脾脏;B.法氏囊;C.胸腺
2.6 细胞因子基因表达情况比较分析结果对攻毒后5 d 3种免疫器官中的细胞因子基因表达情况进行了检测分析,结果显示在脾脏中2个攻毒组IL-6及IFN-γ的表达量均显著高于对照组,并且Fadv-4+FLO组显著低于Fadv-4组,3个组中TNF-α的表达量无明显差异(图6A);在法氏囊中2个攻毒组IL-6、IFN-γ及TNF-α的表达量均显著高于对照组,并且Fadv-4+FLO组显著低于Fadv-4组(图6B);在胸腺中2个攻毒组IL-6及IFN-γ的表达量均显著高于对照组,并且Fadv-4+FLO组IL-6及TNF-α的表达量均显著低于Fadv-4组(图6C)。
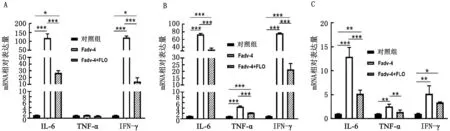
A.脾脏;B.法氏囊;C.胸腺
3 讨论
近年来,随着FLO在兽医临床及水产养殖中被广泛应用,尤其是作为开口药被大量用于家禽养殖。关于FLO毒副作用的研究报道也越来越多[1,20-22],尤其是FLO的免疫毒性被高度关注[23-25]。但是FLO导致的免疫抑制对于病毒感染的影响尚未见报道。2015年开始,HPS的病例在中国不断出现,呈现大面积暴发[26-28],禽腺病毒感染已成为养禽业中日益严重的问题。本试验通过构建血清4型禽腺病毒雏鸡感染模型,并模拟FLO的临床用药,通过检测相关指标探讨FLO用药对感染禽腺病毒雏鸡病情的影响。
本试验发现,雏鸡感染Fadv-4后同时使用FLO可以显著增加雏鸡死亡率,通过监测感染后1~5 d的排毒情况,发现用药组的排毒量要高于只感染组,并且剖检病变也更加严重。孙芹芹[15]研究发现,感染Fadv-4组的雏鸡脾脏器官指数高于对照组,而胸腺及法氏囊器官指数则低于对照组,本试验结果与其报道相似,并且本试验发现Fadv-4+FLO组的3种免疫器官指数均低于Fadv-4组,可能与FLO所导致的免疫抑制有关[29-30],具体机制仍需进一步研究。
病毒侵入机体后,通过诱导Ⅰ和Ⅲ型IFNs激发机体细胞产生成百上千种ISGs,进而发挥抗病毒作用。ISGs所表达的蛋白不仅能够直接抑制病毒的复制,而且能够反馈调节IFNs的表达量间接发挥抗病毒作用[31]。许多病毒刺激Ⅰ型IFN系统,激发数以百计的干扰素诱导基因如2′-5′OAS、MX1和PKR以及转录调节因子如IRF-7转录。据报道,雏鸡感染Fadv-4可以使IL-6、TNF-α等细胞因子mRNA表达水平显著升高[32]。本试验发现,FLO用药组免疫器官中干扰素诱导基因IRF-7、2′-5′OAS及MX1和细胞因子基因IL6、IFN-γ及TNF-α的转录水平显著低于只攻毒组。推测用药组的雏鸡高死亡率以及排毒量的增加可能与用药组抑制了相关干扰素及细胞因子基因的表达有关,但具体机制仍需进一步探讨。
本试验通过对FLO用药组与攻毒组的临床相关指标进行检测分析,发现雏鸡应用FLO会导致更严重的发病情况,提示临床雏禽应用FLO时如果有病毒感染的情况,可能会促进相关病毒病的发生,因此在临床用药时应充分考虑FLO的免疫抑制作用。本研究进一步认识了FLO的毒副作用,为临床合理用药提供了相关数据支持,为进一步对该药物毒副作用的研究奠定基础。
