YAP对梅花鹿鹿茸间充质细胞增殖与分化的影响
2021-03-10黄吉成岳占碰杨占清
张 静,柳 舒,黄吉成,岳占碰,杨占清,郭 斌
(吉林大学 动物医学学院,吉林 长春 130062)
鹿茸角是哺乳动物唯一失去后可完全再生的附属器官,可年周期性的脱落和再生。在快速生长期,鹿茸角的生长速度远超过癌细胞的增殖速度,可达2.75 cm/d,但却能精确调控而不发生癌变,因此是研究创伤修复及器官再生的理想动物模型[1]。在鹿茸角生长过程中,各种细胞不断增殖与分化,处在一个动态平衡中,维持着鹿茸角的生长发育[2]。
YAP (Yes-associated protein,即yes相关蛋白)是Hippo信号通路中的关键效应因子,可促进细胞生长并抑制细胞凋亡[3]。在小鼠胚胎干细胞中,YAP高表达有助于促进干细胞增殖并保持未分化状态[4]。在小鼠间充质干细胞中,YAP过表达可抑制其向软骨细胞分化[5]。然而,有关YAP对鹿茸间充质细胞增殖与分化的影响,目前尚未见报道。活性氧 (reactive oxygen species,ROS) 在多种生命过程中扮演重要的角色,如细胞增殖、分化、凋亡、坏死等。当机体内过量的ROS不能被及时清除时就会导致氧化应激[6]。有研究表明,ROS能够影响干细胞的分化,抗氧化剂治疗可抑制间充质干细胞和造血干细胞分化为功能细胞[7]。但有关YAP对鹿茸间充质细胞中ROS水平的影响目前尚不清楚。
本试验以梅花鹿为研究对象,分离培养鹿茸间充质细胞,添加YAP抑制剂Verteporfin,采用流式细胞术、荧光定量PCR等方法,研究YAP对鹿茸间充质细胞增殖与分化的影响,并探讨其调节机理,研究结果将为进一步探明鹿茸角发育与再生的分子机理、充分开发和利用我国的梅花鹿鹿茸资源等提供理论依据。
1 材料与方法
1.1 实验动物试验所用2~3岁的雄性梅花鹿取自长春市世友梅花鹿养殖场,割取生长约60 d的茸角用于试验。
1.2 主要试剂胰蛋白酶(Amresco公司产品);PI/RNase Staining Buffer(BD Biosciences公司产品);Ⅰ型胶原酶(Gibco公司产品);DMEM/ HIGH GLUCOSE培养基(HyClone公司产品);胎牛血清(Clark公司产品);荧光定量试剂盒(Roche公司产品);MitoSOXTM红色荧光染料(Invitrogen公司产品);Verteporfin(R&D Systems);BeyoClickTMEdU-488细胞增殖检测试剂盒、活性氧检测试剂盒、超氧化物阴离子荧光探针(Dihydroethidium,DHE)、谷胱甘肽(glutathione,GSH)、N-乙酰半胱氨酸(N-acetylcysteine,NAC)购自碧云天生物公司。
1.3 鹿茸间充质细胞的分离培养取鹿茸尖端长约5 cm的鹿茸组织,75%酒精消毒,置入添加双抗的PBS中清洗,在超净台分离鹿茸间充质组织,切成碎块,用不含血清的DMEM高糖培养基清洗,加入Ⅰ型胶原酶消化、离心后,获取鹿茸间充质细胞,将其放于37℃、5%CO2的培养箱中培养。
1.4 EdU检测细胞增殖鹿茸间充质细胞经Verteporfin处理36 h后,于10 μmol/L EdU中孵育2 h;去除培养液,经4%多聚甲醛固定、洗涤后,于含0.3% TritonX-100的PBS中室温孵育15 min;添加Click Additive Solution,通过流式细胞仪检测细胞的增殖活性。
1.5 流式细胞术检测细胞周期鹿茸间充质细胞经血清饥饿后与Verteporfin孵育36 h,将细胞消化并1 200 r/min离心,弃上清,PBS重悬细胞后,4℃固定于70%冰乙醇,经 PI/RNase染色缓冲液染色15 min,通过流式细胞仪检测细胞周期变化。
1.6 荧光定量PCR根据NCBI中相关基因序列设计引物(表1),提取细胞总RNA并进行反转录,在LightCycler®96荧光定量PCR仪中进行PCR反应。
1.7 ROS的检测细胞内ROS水平按照碧云天活性氧检测试剂盒说明书进行测定。
1.8 超氧阴离子的检测细胞中超氧阴离子水平通过碧云天超氧化物阴离子荧光探针进行测定,按照说明书步骤操作。
1.9 细胞线粒体中ROS的检测MitoSOXTM红色荧光染料具有活细胞渗透性,可快速靶向线粒体,高度选择性地检测活细胞线粒体中的超氧化物,进入线粒体后,可被氧化并显示红色荧光。参照试剂盒说明书检测细胞线粒体中ROS水平。
1.10 数据统计分析试验数据表示为平均值±标准误,用SPSS 19.0软件包进行数据处理。单因素方差分析(ANOVA)用于比较不同组的平均值。两组之间比较用t检验,P<0.05为显著性差异。

表1 PCR引物序列及产物片段大小
2 结果
2.1 YAP对鹿茸间充质细胞增殖的影响为了检测YAP对细胞增殖的影响,鹿茸间充质细胞血清饥饿后添加YAP抑制剂Verteporfin作用36 h,通过流式细胞术检测细胞的增殖活性。结果显示,与对照组相比,添加Verteporfin后可显著抑制鹿茸间充质细胞的增殖(图1)。
2.2 YAP对鹿茸间充质细胞增殖周期的影响为了研究YAP对细胞增殖周期的影响,鹿茸间充质细胞经血清饥饿后,与YAP抑制剂Verteporfin孵育36 h,PI染色后,通过流式细胞仪检测。结果显示,与对照组相比,添加Verteporfin后鹿茸间充质细胞滞留在G0/G1期,导致G0/G1期细胞数量增多,S期细胞数量明显减少(图2)。
2.3 YAP对细胞周期蛋白及蛋白激酶在鹿茸间充质细胞中表达的影响有研究证实,细胞周期蛋白及蛋白激酶与细胞增殖周期进程密切相关[8]。本试验应用荧光定量PCR方法检测了Verteporfin对细胞周期蛋白CCND1、CCND2、CCND3、CCNE1以及细胞周期蛋白激酶CDK2、CDK4、CDK6表达的影响。结果显示,与对照组相比,Verteporfin可显著降低CCND1、CCND2、CCND3、CCNE1、CDK2、CDK4和CDK6在鹿茸间充质细胞中的表达(图3)。
2.4 YAP对鹿茸间充质细胞分化的影响为了研究YAP对鹿茸间充质细胞分化的影响,将分离培养的间充质细胞与含有YAP抑制剂Verteporfin的间充质干细胞成软骨诱导分化完全培养基孵育12,24,36,48,72 h后,通过荧光定量PCR检测了软骨细胞标志性分子COLⅡ、SOX9和AGC表达的变化。结果显示,与对照组相比,Verteporfin显著提高了COLⅡ、SOX9和AGC mRNA水平,并且随着时间的增加,COLⅡ、SOX9和AGC的表达量也在增加(图4)。
2.5 YAP对鹿茸间充质细胞中ROS含量的影响ROS可参与细胞中的信号传导,进而影响细胞的增殖、分化和凋亡等过程[9]。为了研究YAP对间充质细胞中ROS含量的影响,分离培养鹿茸间充质细胞后,添加Verteporfin作用24 h,装载荧光探针DCFH-DA,通过流式细胞术检测细胞中ROS含量的变化。结果显示,与对照组相比,添加Verteporfin后间充质细胞中ROS的含量显著上升(图5)。
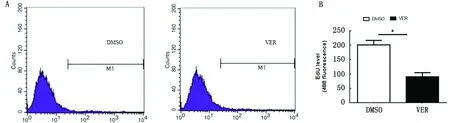
A.流式细胞图;B.YAP对鹿茸间充质细胞增殖的影响柱状图。*P<0.05;DMSO.对照组;VCR.试验组。下同

A.流式细胞图;B.YAP对鹿茸间充质细胞细胞周期的影响柱状图
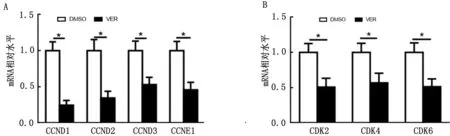
A.Verteporfin对细胞周期蛋白CCND1、CCND2、CCND3和CCNE1表达的影响;B.Verteporfin对细胞周期蛋白激酶CDK2、CDK4和CDK6表达的影响
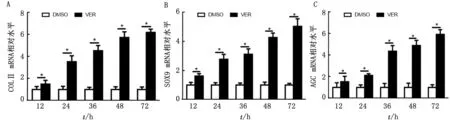
A.YAP对间充质细胞中COLⅡ表达的影响;B.YAP对间充质细胞中SOX9表达的影响;C.YAP对间充质细胞中AGC表达的影响

A.流式细胞图;B.YAP对鹿茸间充质细胞中ROS含量的影响柱状图
2.6 YAP对鹿茸间充质细胞中超氧阴离子的影响超氧阴离子(O2-)是细胞中主要的ROS,可与其他酶相互作用,产生其他的ROS[10]。为了研究YAP对间充质细胞中O2-含量的影响,添加Verteporfin作用24 h后,装载荧光探针Dihydroethidium,通过流式细胞术检测细胞中O2-含量的变化。结果显示,与对照组相比,添加Verteporfin后间充质细胞中O2-含量显著升高,与ROS的变化趋势一致(图6)。

A.流式细胞图;B.YAP对鹿茸间充质细胞中O2-的影响柱状图
2.7 YAP对鹿茸间充质细胞中线粒体ROS的影响ROS的主要来源之一是线粒体,称为线粒体ROS(mitochondrial ROS,mtROS)[11]。为了研究YAP对间充质细胞中mtROS含量的影响,添加Verteporfin作用24 h,与MitoSOXTM红色荧光染料孵育后,通过流式细胞术检测mtROS含量的变化。结果显示,与对照组相比,添加Verteporfin后间充质细胞中mtROS的含量显著上升(图7)。

A.流式细胞图;B.YAP对鹿茸间充质细胞中mtROS的影响柱状图
2.8 YAP可通过ROS来调节鹿茸间充质细胞的分化GSH和NAC是常用的抗氧化剂,可清除细胞中的ROS[12]。为了研究YAP是否可通过ROS来调节鹿茸间充质细胞的分化,先用YAP抑制剂Verteporfin处理间充质细胞2 h后,再分别添加GSH和NAC作用24 h,通过实时荧光定量PCR检测软骨细胞标志性分子COLⅡ、SOX9、AGC表达的变化。结果显示,GSH和NAC可显著降低COLⅡ、SOX9和AGC mRNA在Verteporfin处理鹿茸间充质细胞中的表达(图8)。
3 讨论
鹿茸角是哺乳动物唯一在失去后可完全再生的附属器官,鹿茸角的再生是基于干细胞的增殖与分化过程。众所周知,鹿茸角的生长中心位于其顶端。鹿茸角的快速生长主要是通过保留在间充质层中的细胞增殖来实现的,一些细胞传导途径和细胞因子参与了鹿茸角的再生过程[13]。

A.NAC减弱Verteporfin对间充质细胞分化的影响;B.GSH减弱Verteporfin对间充质细胞分化的影响
细胞增殖、凋亡和分化之间的平衡对于准确地形成和维持组织器官至关重要。Hippo信号通路在器官发育、肿瘤发生、组织再生和干细胞自我更新中发挥重要的作用[14]。YAP是Hippo信号通路中的转录共激活因子,当YAP活跃时,可进入细胞核,与TEAD转录因子家族结合,诱导涉及细胞增殖、存活和迁移的多种基因的表达[15]。但是,YAP对鹿茸间充质细胞增殖与分化的影响尚不明确。因此,本试验以梅花鹿为研究对象,通过流式细胞术和荧光定量PCR等方法研究了YAP对鹿茸间充质细胞增殖与分化的影响。
为了研究YAP对鹿茸间充质细胞增殖的影响,通过EdU法检测了间充质细胞的增殖情况,结果显示Verteporfin抑制了间充质细胞的增殖。细胞的增殖过程分为以下4个阶段: G1期、S期、G2期和M期。参与细胞周期调节的关键机制能够协调细胞增殖过程。调节该机制的关键成分是细胞周期蛋白,它们可结合并激活细胞周期蛋白依赖性激酶并向细胞周期蛋白依赖性激酶提供底物,从而促进细胞的增殖[16]。为了进一步证实YAP对鹿茸间充质细胞增殖的影响,在鹿茸间充质细胞中添加Verteporfin,通过流式细胞术检测间充质细胞细胞周期的变化,同时通过荧光定量PCR检测CCND1、CCND2、CCND3、CCNE1、CDK2、CDK4和CDK6的表达水平。结果显示,Verteporfin处理后间充质细胞G0/G1期细胞数量增多,S期细胞数量明显减少。CCND1、CCND2、CCND3、CCNE1、CDK2、CDK4和CDK6 mRNA水平也显著下降。这进一步证实了Verteporfin对鹿茸间充质细胞增殖有抑制作用。最近的研究表明,YAP是小鼠间充质干细胞成软骨细胞分化的负性调控因子,YAP过表达会抑制其向软骨细胞分化[5]。为了研究YAP对鹿茸间充质细胞分化的影响,在鹿茸间充质细胞中添加Verteporfin处理12,24,36,48,72 h,通过荧光定量PCR检测了软骨细胞的标志性分子COLⅡ、SOX9和AGC的表达水平。结果显示,添加Verteporfin后间充质细胞中COLⅡ、SOX9和AGC mRNA水平均显著上升,72 h时表达水平最高。这与已有研究结果相一致。
目前,对于氧化应激的研究越来越多。研究发现,Hippo/YAP通路与氧化还原稳态的调节有关,在特异性缺失YAP的小鼠心脏中ROS的含量升高[17]。但是,在SCC(肺鳞状细胞癌)中,YAP激活会导致ROS积累升高。为了探究YAP对鹿茸间充质细胞中ROS含量的影响,在间充质细胞中添加Verteporfin后,通过流式细胞术检测间充质细胞中ROS的含量。结果显示,添加Verteporfin后,与对照组相比,间充质细胞中ROS含量升高。O2-是组成ROS的主要成分[18],通过流式细胞术检测了间充质细胞中O2-的含量。结果显示,添加Verteporfin后,间充质细胞中O2-含量升高,与ROS变化趋势一致。线粒体是ROS的重要来源[19],通过流式细胞术检测了间充质细胞中mtROS的含量。结果显示,添加Verteporfin后,间充质细胞中mtROS含量升高,进一步明确了YAP对间充质细胞中ROS的作用。ROS是能对细胞生物分子造成氧化损伤的反应性物质,同时ROS还充当细胞信号转导的第二信使以介导细胞氧化还原信号传导,从而产生特定的生理反应[9]。为了研究ROS与间充质细胞分化间的关系,在添加Verteporfin后,又添加了抗氧化剂GSH和NAC,通过荧光定量PCR检测了间充质细胞中COLⅡ、SOX9和AGC mRNA水平变化。结果显示,添加GSH和NAC后,Verteporfin处理的间充质细胞中COLⅡ、SOX9和AGC mRNA水平显著降低,这说明YAP可通过ROS来调节鹿茸间充质细胞的分化。
综上所述,YAP可促进鹿茸间充质细胞的增殖,抑制其向软骨细胞分化,进而参与梅花鹿茸角的再生。
