高表达线粒体融合蛋白2(MFN2)可抑制高BHBA活化的奶牛肝细胞NF-κB炎性通路
2021-03-10左冉坤董记红李心慰刘国文刘焕奇
左冉坤,迟 良,董记红,李心慰,王 哲,刘国文,刘焕奇*
(1.青岛农业大学 动物医学院,山东 青岛 266109;2.吉林大学 动物医学学院,吉林 长春 130062)
围产期(通常是指产前3周和产后3周)是奶牛泌乳周期中非常关键的一个时期。产后奶牛由于干物质摄入减少,泌乳启动,导致能量需求增加,使奶牛机体处于能量负平衡状态,进而动员脂肪,脂肪分解增加,导致高非酯化脂肪酸(non-esterified fatty acid,NEFA)血症。当肝细胞吸收大量NEFA,超过了自身代谢能力时,可造成NEFA不完全被氧化,产生大量酮体,如β-羟丁酸(β-hydroxybutyrate,BHBA)、乙酰乙酸和丙酮,造成酮病的发生[1]。研究表明,酮病奶牛肝脏炎性水平显著增加,肝脏NF-κB炎性通路显著激活,炎性细胞因子TNF-α和IL-1β等浓度显著升高[2-3],与酮病奶牛的高BHBA血症密切相关。
线粒体融合蛋白2(mitofusin 2,MFN2),是定位于线粒体外膜的高度保守的GTP酶,能参与线粒体外膜的融合,对线粒体功能的发挥起着重要的作用[4-6]。而线粒体是脂肪酸氧化的主要场所[7-8],并且线粒体的功能与NF-κB通路的活化有关[9],然而,MFN2对奶牛肝细胞NF-κB通路的影响尚未见报道。因此,本研究采用Western blot和qRT-PCR技术检测NF-κB炎性通路关键分子的蛋白和基因表达,探讨高表达MFN2对高BHBA活化的NF-κB通路的影响,为奶牛酮病临床病理学研究提供理论依据。
1 材料方法
1.1 主要试剂双抗(青链霉素)、Tris和地塞米松均购自Sigma公司;胎牛血清和RPMI-1640购自Gibco公司;Trizol和Premix Ex-Taq购自TaKaRa公司。
1.2 奶牛肝细胞的分离与培养采用两步灌流法分离原代肝细胞[10]。手术切除荷斯坦犊牛肝尾状叶,用灌流液A (140 mmol/L NaCl,10 mmol/L HEPES,6.7 mmol/L KCl,0.5 mmol/L EDTA,2.5 mmol/L 葡萄糖;pH7.2~7.4,37℃)灌注肝脏12 min,流速为50 mL/min。然后用灌流液B (140 mmol/L NaCl,30 mmol/L HEPES,6.7 mmol/L KCl,5 mmol/L CaCl2,2.5 mmol/L 葡萄糖;pH7.2~7.4,37℃)灌注肝脏3 min,流速50 mL/min,直至液体澄清。随后,以20 mL/min的流速用胶原酶Ⅳ溶液(0.1 g胶原酶Ⅳ溶解在0.5 L灌注溶液B中,pH7.2~7.4,37℃)消化肝脏15~20 min。消化后将肝脏放入无菌平板中,加入100 mL胎牛血清终止消化。切开肝脏后取出血管和结缔组织,用100目和200目的细胞筛依次过滤,得到单个肝细胞。在六孔板中培养72 h后,换成含有不同浓度BHBA(0.0,1.2,2.4,4.8 mmol/L)的RPMI-1640培养基进行培养。转染腺病毒空载体(Ad-GFP)或MFN2过表达腺病毒(Ad-MFN2),用RPMI-1640培养基培养7 h后,换成生长培养基培养41 h。
1.3 蛋白的提取和Western blot收集六孔板上的细胞,加入适量(由细胞量决定)的RIPA裂解液进行裂解,按照蛋白浓度测定试剂盒(上海生工生物科技有限公司)说明书测定蛋白浓度。用15%SDS-PAGE凝胶电泳分离蛋白,然后转移到聚偏二氟乙烯膜(PVDF)上。将膜在3%BSA/Tris缓冲盐水/Tween(TBS-T)缓冲液中常温封闭4 h,再分别将膜放在IKBα、p-IKB、NF-κB p65、p-NF-κB p65和MFN2的一抗中孵育过夜,随后用TBS-T清洗膜,与辣根过氧化物酶标记的抗兔或抗小鼠免疫球蛋白室温孵育45 min,使用Protein Simple成像仪对条带成像。
1.4 总RNA提取和实时荧光定量PCR根据说明书使用TRIzol收集细胞,总RNA提取试剂盒提取总RNA,应用cDNA合成试剂盒合成cDNA。利用TaKaRa荧光定量试剂Premix Ex Taq和7500 Real-time PCR System检测IL-1β、IL-6、TNFα和MFN2的mRNA水平。反应条件:94℃初始变性2 min,扩增35个循环(94℃变性10 s,60℃退火15 s,72℃延伸30 s),然后在72℃下延伸5 min。用ABI PRISM 7500型荧光定量PCR扩增仪进行荧光定量PCR,使用2-△Ct法进行计算。

2 结果
2.1 不同浓度BHBA对奶牛肝细胞NF-κB炎性通路的影响奶牛肝细胞经过不同浓度的BHBA刺激后,检测NF-κB炎性通路相关蛋白(IKBα、p-IKBα、NF-κB p65和p-NF-κB p65)和炎性细胞因子(IL-1β、IL-6和TNFα)mRNA的表达量。结果显示,随着BHBA浓度的增加,p-IKBα和p-NF-κB p65蛋白的相对表达量显著增加(图1A,B,C),IL-1β、IL-6和TNFα的mRNA水平显著升高(图1D,E,F),表明BHBA可激活奶牛肝细胞NF-κB炎性通路。
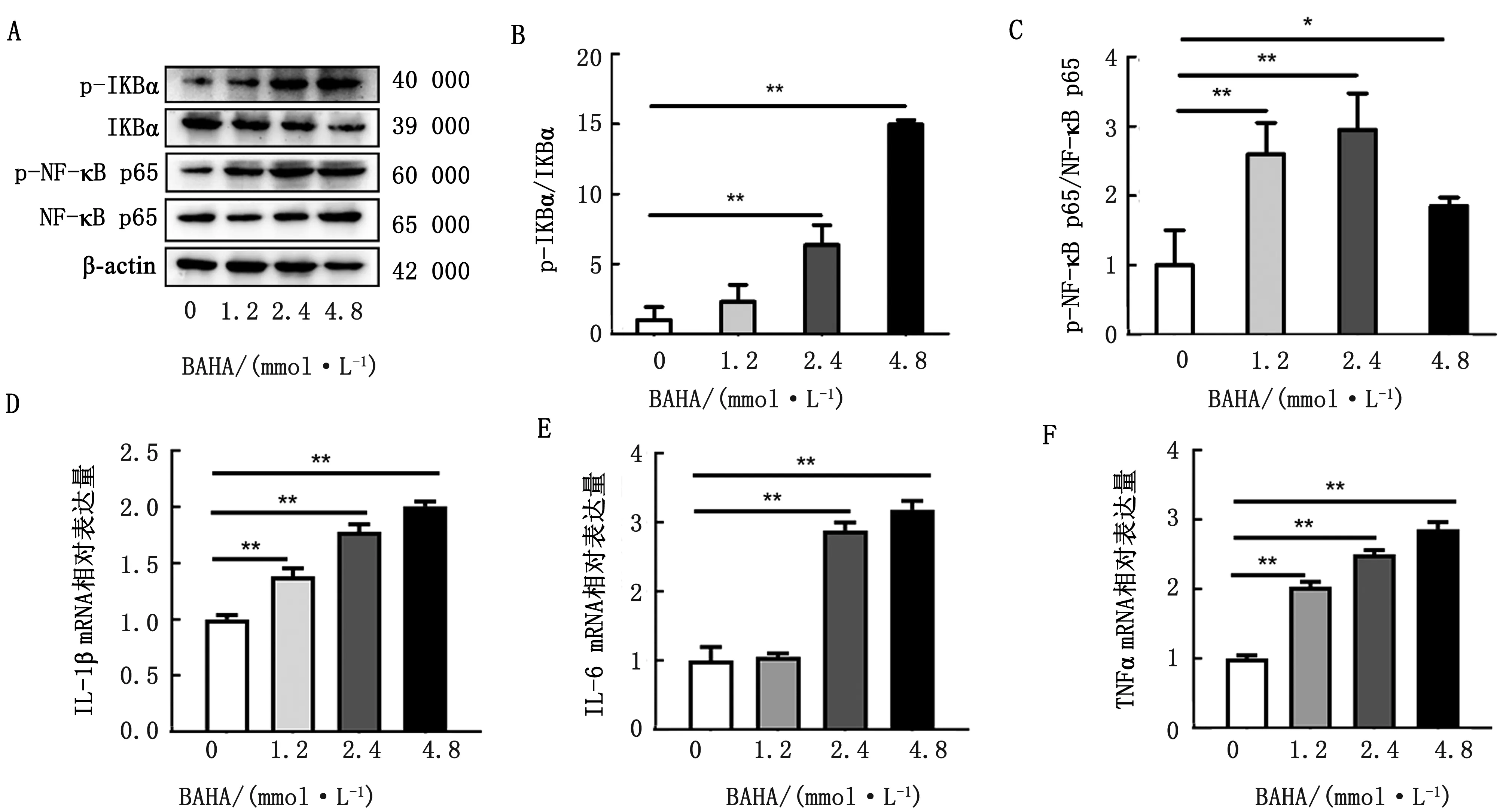
A.NF-κB炎性通路相关蛋白的表达;B.p-IKBα/IKBα;C.p-NF-κB p65/NF-κB p65;D.IL-1β的mRNA表达;E.IL-6的mRNA表达;F.TNFα的mRNA表达
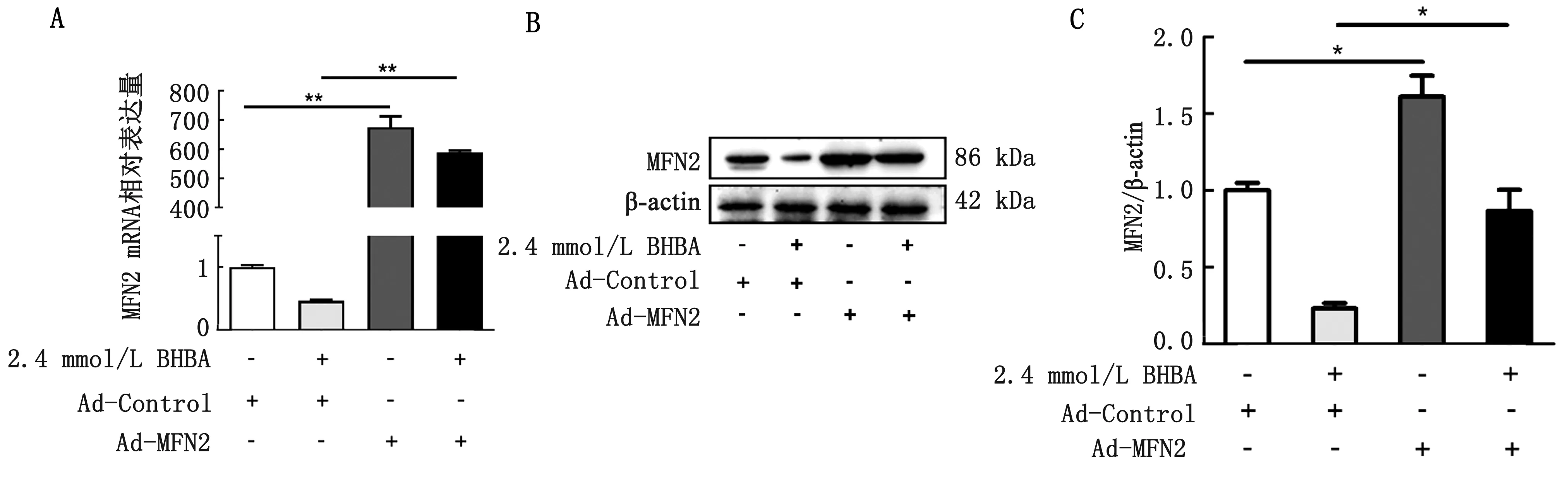
2.2 不同浓度BHBA对MFN2表达的影响不同浓度BHBA刺激牛肝细胞后,检测MFN2的mRNA和蛋白的表达情况,来判定不同浓度的BHBA对奶牛肝细胞MFN2表达的影响。结果显示,MFN2的mRNA和蛋白的表达水平随着BHBA的浓度的增加而显著降低,表明BHBA在体外会降低奶牛肝细胞MFN2的表达水平(图2A,B,C)。

A.MFN2 mRNA的表达;B.MFN2蛋白的表达;C.MFN2/β-actin
2.3 过表达MFN2后细胞内MFN2的变化采用MFN2过表达腺病毒(Ad-MFN2)转染奶牛肝细胞,检测MFN2过表达情况。结果显示, Ad-MFN2处理组与Ad-GFP处理组相比,MFN2的mRNA和蛋白的表达量显著升高,AD-MFN2+BHBA处理组MFN2的mRNA和蛋白表达量也显著高于Ad-GFP+BHBA处理组(图3A,B,C),这表明MFN2在奶牛肝细胞内成功过表达,能逆转BHBA对MFN2表达的抑制作用。
2.4 过表达MFN2对BHBA活化的NF-κB炎性通路的影响采用腺病毒过表达MFN2后,检测IKBα、p-IKBα、NF-κB p65和p-NF-κB p65蛋白的表达量,以及IL-1β、IL-6和TNFα mRNA的表达水平。结果显示,与Ad-GFP处理组相比,Ad-MFN2处理组p-NF-κB p65蛋白的表达水平显著降低(图4A,C),IL-1β、IL-6和TNFα mRNA的表达水平也显著降低(图4D,E,F)。而Ad-MFN2 + BHBA处理组的p-IKBα和p-NF-κB p65蛋白的表达水平与Ad-GFP + BHBA处理组相比显著降低(图4A,B,C),IL-1β、IL-6和TNFα mRNA的表达水平相比也显著低于Ad-GFP+BHBA处理组(图4D,E,F)。结果表明,过表达MFN2可抑制奶牛肝细胞BHBA引起的NF-κB炎性通路活化。
A.MFN2的mRNA表达;B.MFN2的蛋白表达;C.MFN2/β-actin

A.NF-κB炎性通路相关蛋白的表达;B.p-IKBα/IKBα;C.p-NF-κB p65/NF-κB p65;D.IL-1β mRNA的表达;E.IL-6 mRNA的表达;F.TNFα mRNA的表达
3 讨论
奶牛酮病是围产期奶牛常发的一种代谢性疾病,围产期奶牛干物质摄入减少,能量需求增加,导致脂肪动员,致使奶牛体内堆积大量酮体,引发代谢障碍而产生酮病[11-12]。酮病奶牛表现出高NEFA和高BHBA血症[13],并且存在系统性的非感染性炎症,血液中炎性细胞因子TNF和IL-6水平显著升高[14]。NF-κB和NLRP3炎性通路是调节炎性细胞因子TNF-α、IL-6和IL-1β产生的主要调节通路,而奶牛酮病的发病过程中肝脏NF-κB和NLRP3信号通路过度的活化[3],所以NF-κB和NLRP3介导的炎性因子的升高与NEFA和BHBA的升高相关。史晓霞等[15]研究发现,体外添加NEFA处理奶牛原代肝细胞,可以促进NF-κB炎性通路的活化,促进炎性细胞因子的合成。本试验结果表明,在体外培养的奶牛肝细胞中添加高浓度的BHBA会促进NF-κB相关蛋白及炎性细胞因子(TNF-α、IL-6和IL-1β) mRNA的表达,能量负平衡产生的高BHBA和NEFA血症可激活肝细胞NF-κB炎性通路的活化,加剧酮病的发生和发展。
MFN2是线粒体膜上的蛋白,它可以参与线粒体融合,当其表达受到抑制时,会损害线粒体的功能[16]。在患有非酒精性脂肪肝炎的人和奶牛肝脏内均出现线粒体功能障碍,MFN2蛋白和mRNA表达显著降低[16-17]。DONG等[18]研究发现,脂肪肝奶牛肝脏MFN2表达水平显著降低。所以MFN2的表达降低可能与高浓度BHBA的脂毒性有关,MFN2的低表达可能参与了奶牛肝脏炎性通路的活化和肝脏能量代谢紊乱的发生。本试验结果表明,高浓度BHBA可以显著抑制MFN2基因和蛋白的表达,这说明高浓度的BHBA可显著抑制MFN2的表达,损伤线粒体功能,进而可能进一步活化炎性信号通路,加剧酮病的产生。
在大鼠肝脏缺血再恢复灌注造成的炎性损伤中,线粒体损伤随缺血时间的延长而加重,MFN2蛋白和mRNA的表达也随之降低,同时表现出大量的炎性细胞浸润[19],这说明MFN2的表达与炎性水平有关。但关于MFN2的低表达是否参与了BHBA诱导的NF-κB炎性通路活化尚未见报道。本试验通过在奶牛肝细胞内转染腺病毒发现,MFN2过表达后,可抑制由BHBA引起的p-NF-κB p65和p-IKBα蛋白及炎性细胞因子TNF-α、IL-6和IL-1β的mRNA表达水平升高,表明BHBA诱导的NF-κB炎性通路的活化被过表达的MFN2显著抑制,说明MFN2可作为奶牛酮病的治疗靶点,通过过表达MFN2一方面改善肝细胞线粒体功能,另一方面抑制肝细胞炎性通路的活化,起到防治酮病病理损伤的作用。
综上所述,BHBA在体外培养的奶牛肝细胞中可以诱导NF-κB炎性通路的激活,而过表达MFN2可以逆转BHBA引起的奶牛肝细胞炎性通路的激活,提示MFN2有望成为围产期奶牛酮病疾病治疗靶点。
