人参茎叶总皂苷联合亚硒酸钠对猪伪狂犬病灭活疫苗免疫的增强作用
2021-03-10MAQBOOLBabar崔雪梅袁丽佳胡松华
MAQBOOL Babar,王 勇,崔雪梅,袁丽佳,胡松华
(浙江大学 动物科学学院,浙江 杭州 310058)
伪狂犬病(pseudorabies,PR)是由伪狂犬病病毒(pseudorabies virus,PRV)引起的一种高度接触性动物传染病,主要感染猪、牛、羊、犬、猫、兔等动物[1]。猪是PRV的唯一自然宿主,15日龄以内仔猪感染PRV后的病死率可达100%,断奶仔猪感染发病后的病死率为10%~20%,此病给养猪业造成了巨大的经济损失[2]。长期以来,预防此病的方法主要通过给猪接种gE基因缺失弱毒疫苗。然而,近些年一些猪场免疫了弱毒疫苗后出现PRV变异株流行暴发情况[3]。与弱毒疫苗比较,灭活疫苗具有更好的安全性。但灭活疫苗主要诱导动物产生体液免疫,而对细胞免疫作用不大[4]。动物在抵御PRV感染过程中,主要是细胞免疫发挥保护作用。因此,研究提高疫苗免疫效果的方法,增强动物的抗病能力具有重要的临床意义。
研究表明,从中药人参(PanaxginsengC.A.Meyer)茎和叶中提取的人参茎叶总皂苷(GSLS)对许多动物疫苗的免疫具有增强作用。马艳粉等[5-6]报道,口服GSLS能够显著性提高口蹄疫(FMD)疫苗免疫小鼠的特异性IgG及其亚类水平。据报道,饮水口服GSLS对鸡免疫新城疫(ND)灭活疫苗和禽流感(AI)灭活疫苗均有免疫增强作用[7-8]。硒是一种人和动物必需的微量元素,具有增强机体免疫力的作用,以亚硒酸钠(Na2SeO3,简称Se)的形式在畜牧业生产中应用广泛[9-10]。本试验拟研究动物口服GSLS联合在疫苗中添加Se对 PRV灭活疫苗免疫的增强作用,为临床上如何采用中药提高灭活疫苗的免疫效果提供参考。
1 材料与方法
1.1 实验动物雌性ICR小鼠(18~22 g),购自上海斯莱克实验动物有限责任公司。饲养于实验室IVC独立送风饲养笼具,自由采食与饮水,室内温度为(25±1)℃,湿度为(50±10)%,饲养1周后开始试验。
1.2 细胞、病毒和疫苗猪肾传代细胞系PK-15由浙江大学动物科学学院中兽医实验室保存;伪狂犬病病毒野毒株(fPRV),由浙江省农业科学院惠赠,分离自PR病死猪,用于PK-15细胞扩增和TCID50检测;猪PR灭活疫苗,购自武汉科前生物股份有限公司(批号:180416)。
1.3 主要试剂和药品猪PRV gB抗体检测试剂盒,购自美国IDEXX公司;胎牛血清,购自浙江天杭生物科技股份有限公司;人参茎叶总皂苷(GSLS),购自吉林宏久生物科技股份有限公司;亚硒酸钠(Na2SeO3,Se)购自上海今品化学技术有限公司;刀豆蛋白(ConA)、脂多糖(LPS)和MTT,购自Sigma公司;胰酶消化液(0.25% 胰酶+0.02% EDTA),购自杭州吉诺生物医药有限公司;HRP标记标记山羊抗小鼠IgG1、IgG2a抗体,购自Santa Cruz公司;红细胞裂解液,购自北京索莱宝生物科技有限公司;Mouse IFN-γ、IL-2、IL-4和IL-6 ELISA检测试剂盒,购自杭州联科生物科技有限公司。
1.4 主要耗材与仪器MCO-15AC CO2细胞培养箱,购自日本SANYO公司;Multiskan MK3酶标仪,购自美国Thermo公司;XDS-1B 倒置显微镜,购自重庆光电仪器有限公司;5810R离心机,购自德国Eppendorf公司。
1.5 疫苗免疫剂量的筛选ICR小鼠随机分成4组,每组6只,分别肌肉注射免疫0.1 mL用生理盐水稀释10,50,100倍和未稀释的PRV灭活疫苗,免疫后2周采血,检测血清特异性PRV gB抗体水平,筛选出合适的疫苗免疫剂量。
1.6 动物分组与处理ICR小鼠随机分成5组,每组6只。第1组为空白组(non-immune),不免疫;第2组,PRV灭活疫苗对照组(PRV);第3组,免疫前灌胃GSLS(0.5 mg/d),连续给药4 d,然后注射PRV灭活疫苗(GSLS/Pre+PRV);第4组,在PRV灭活疫苗添加30 mg/L的Se(Se+PRV);第5组,免疫前灌胃GSLS(0.5 mg GSLS),连续给药 4 d,然后注射添加Se(30 mg/L)的PRV灭活疫苗(GSLS-Se+PRV)。小鼠肌肉注射疫苗2次,每次注射疫苗0.1 mL,间隔2周。加强免疫后2,3,4周采血,制备血清,最后一次采血后处死小鼠并分离脾淋巴细胞。用ELISA方法检测血清gB抗体及亚类水平,脾淋巴细胞用于检测淋巴细胞增殖水平及细胞因子水平。
1.7 血清特异性PRV gB抗体及其亚类检测根据PRV gB抗体检测试剂盒说明,用阻断ELISA法检测血清中特异性PRV gB抗体水平。抗体阻断率=[1-S(样品D值)/N(阴性对照D值)]×100%。使用同样的ELISA检测试剂盒,向试剂盒包被板每孔加入100 μL待检测血清(1∶2稀释),置于18~26℃ 孵育60 min后用洗涤液洗板3~5次;将板拍干,随后每孔加入100 μL 1∶1 000稀释的HRP标记的山羊抗鼠IgG1或IgG2a抗体,置于37℃孵育60 min后用洗涤液洗板3~5次;将板拍干后每孔加入100 μL TMB底物溶液,置于18~26℃ 孵育,15 min后每孔加入50 μL终止液,于D450 nm读数。
1.8 淋巴细胞增殖试验将小鼠断颈处死,用75%酒精浸泡5~10 min,无菌操作取脾脏,加入5 mL完全Hank's液,用研钵研磨后过200目铜网,滤液离心(1 500 r/min,10 min),弃上清。加入3 mL红细胞裂解液裂解红细胞,静止3 min后离心,弃上清。使用完全Hank's液清洗细胞并计数,用RPMI-1640培养基调整细胞浓度至5×106/mL。将细胞加入至96孔板中(100 μL/孔),后加入100 μL ConA(终质量浓度5 mg/L)、LPS(终质量浓度5 mg/L)或PRV抗原(经56℃、30 min处理后的fPRV野毒,5×105TCID50),轻轻混匀后,培养板置于37℃、5%CO2细胞培养箱中培养48 h。培养结束前4 h加入20 μL MTT(5 g/L)。离心培养板(1 800 r/min,10 min)并小心倒去细胞培养液,再向每孔加入150 μL DMSO,避光振荡溶解结晶后置于酶标仪上测量D570 nm。刺激指数(SI)的计算公式如下:SI=(D刺激孔-D空白孔)/(D未刺激孔-D空白孔)。
1.9 细胞因子检测按1.8中方法收集脾细胞,调整细胞浓度至5×106/mL,使用PRV抗原(经56℃ 30 min处理后的fPRV野毒,5×105TCID50)刺激,于37℃、5%CO2细胞培养箱中培养48 h后,收集细胞上清液,按ELISA试剂盒说明书操作步骤,检测Th1(IFN-γ,IL-2)和Th2(IL-4,IL-6)型细胞因子的分泌水平。
1.10 攻毒保护试验小鼠加强免疫后2周,腹腔注射致死剂量的fPRV(5×105TCID50),连续观察10 d,并记录小鼠症状和死亡情况。

2 结果
2.1 疫苗免疫剂量筛选给小鼠分别免疫未稀释和用生理盐水稀释10,50,100倍后的PRV灭活疫苗,检测免疫后2周小鼠血清gB抗体水平。由图1可知,随着稀释倍数的增加,疫苗诱导小鼠产生的gB 抗体水平也逐渐降低。为更好观察GSLS-Se对PRV灭活疫苗的佐剂效果,最终选择100倍作为后续试验疫苗的稀释倍数。
2.2 GSLS-Se对小鼠血清特异性PRV gB抗体水平的影响由图2可知,与PRV疫苗对照组相比,免疫前口服GSLS或者在疫苗中添加Se可显著提高抗体水平,免疫前口服GSLS联合在疫苗中添加Se可产生更高的抗体水平。
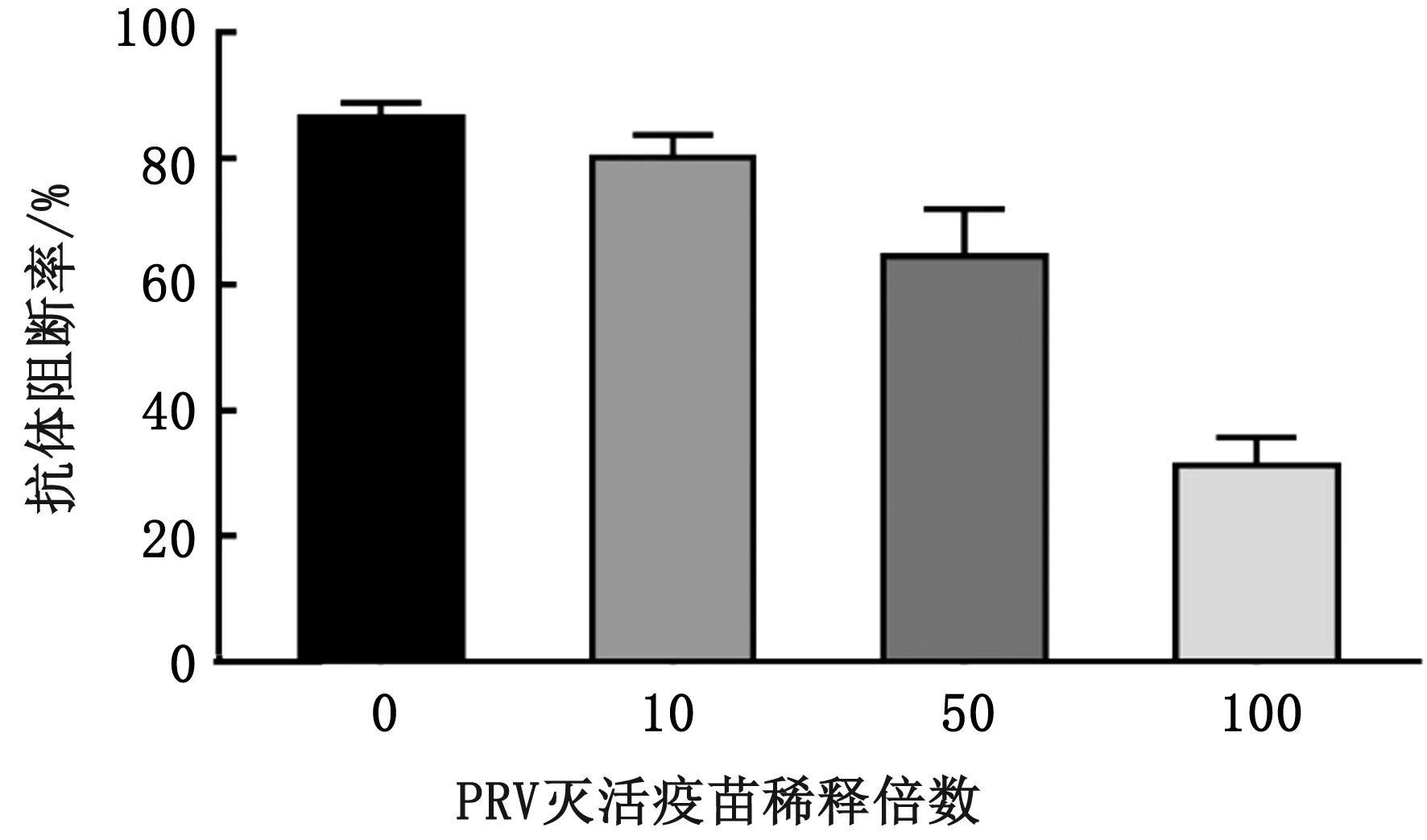
图1 不同稀释倍数对PRV灭活疫苗诱导的小鼠gB抗体水平的影响

*.示P<0.05;**.示P<0.01;***.示P<0.001。下同
2.3 GSLS-Se对小鼠血清特异性PRV gB抗体亚类水平的影响与PRV疫苗对照组相比,免疫前口服GSLS联合在疫苗中添加Se显著提高了小鼠血清中特异性PRV gB抗体的IgG1和IgG2a水平(图3)。
2.4 GSLS-Se对小鼠脾淋巴细胞增殖及产生细胞因子的影响与PRV疫苗对照组相比,免疫前口服GSLS联合在疫苗中添加Se显著提高了小鼠脾淋巴细胞在体外受ConA、LPS和PrV抗原刺激后的增殖能力(图4),并显著上调了淋巴细胞产生细胞因子(INF-γ、IL-2和IL-6)水平(图5)。
2.5 小鼠攻毒保护试验用强毒(fPRV)腹腔注射小鼠,空白组小鼠和口服GSLS组小鼠在攻毒后36 h 均出现啃咬后背,后肢抽搐和共济失调等神经症状,并从48 h开始死亡,60 h时2个组小鼠全部死亡。PRV疫苗组小鼠在攻毒后48 h出现神经症状,从60 h开始死亡,最终小鼠存活率为50%(5/10),而GSLS-Se+ PRV疫苗组的小鼠的存活率为70%(7/10)(图6)。

图3 小鼠血清特异性PRV gB抗体亚类IgG1 (A)和IgG2a (B)水平
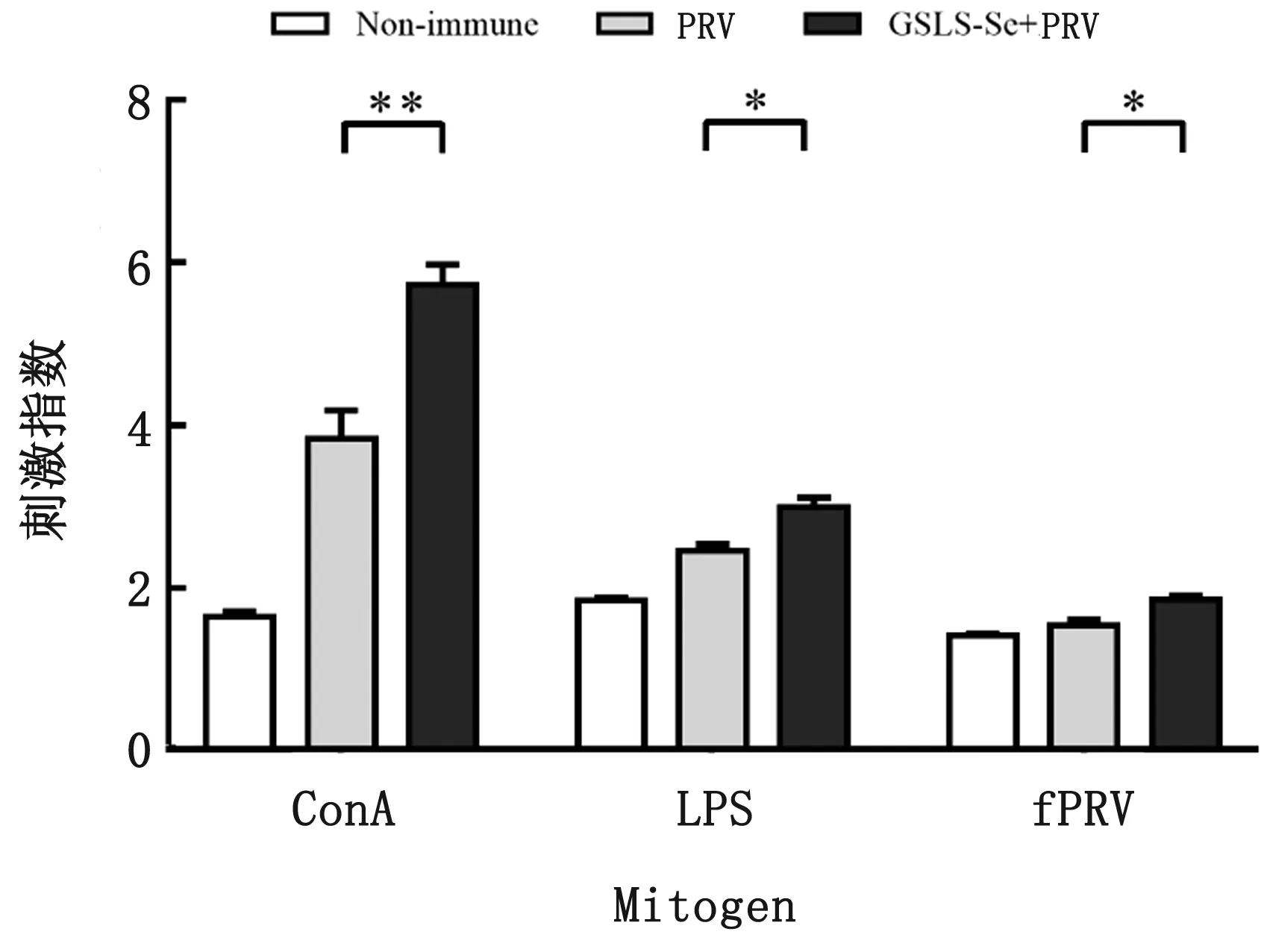
图4 小鼠脾淋巴细胞增殖水平
3 讨论
本试验结果表明,与PRV疫苗对照组相比,免疫前口服GSLS联合在PRV灭活疫苗中添加Se能够促进小鼠产生更高的特异性PRV gB抗体水平,增强动物的体液免疫应答。体液免疫在动物抗PRV的过程中发挥着重要的作用。PRV表面的gB糖蛋白是一种主要的保护性抗原,抗PRV gB抗体可以阻断病毒入侵细胞[11-12]。当病毒入侵细胞之后,细胞的免疫应答发挥重要的抗病毒作用。淋巴细胞增殖水平反映了机体细胞免疫应答水平。不同的丝裂原刺激不同的淋巴细胞发生增殖和分化,Con A刺激T淋巴细胞,而LPS刺激B淋巴细胞[13]。本试验结果表明,GSLS-Se能够显著提高ConA、LPS和PRV抗原诱导的淋巴细胞增殖水平,说明细胞免疫水平提高了。在细胞免疫应答过程中,激活的T细胞分泌多种具有免疫调节作用的细胞因子,Th1型细胞主要分泌IFN-γ、IL-2、IL-12等细胞因子,Th2型细胞主要分泌IL-4、IL-5、IL-6、IL-10等细胞因子。机体抗体亚类的产生受不同细胞因子的影响,Th1型细胞因子促进B淋巴细胞产生具有抗病毒作用的IgG2a,而Th2主要促进机体产生IgG1[14-17]。本试验发现,GSLS-Se能够显著性提高小鼠血清IgG2a和IgG1亚类水平,并显著上调免疫小鼠脾淋巴细胞经PRV抗原刺激后Th1型(IFN-γ,IL-2)和Th2型(IL-6)细胞因子的分泌水平,说明GSLS-Se对Th1型和Th2型免疫应答均有促进作用。
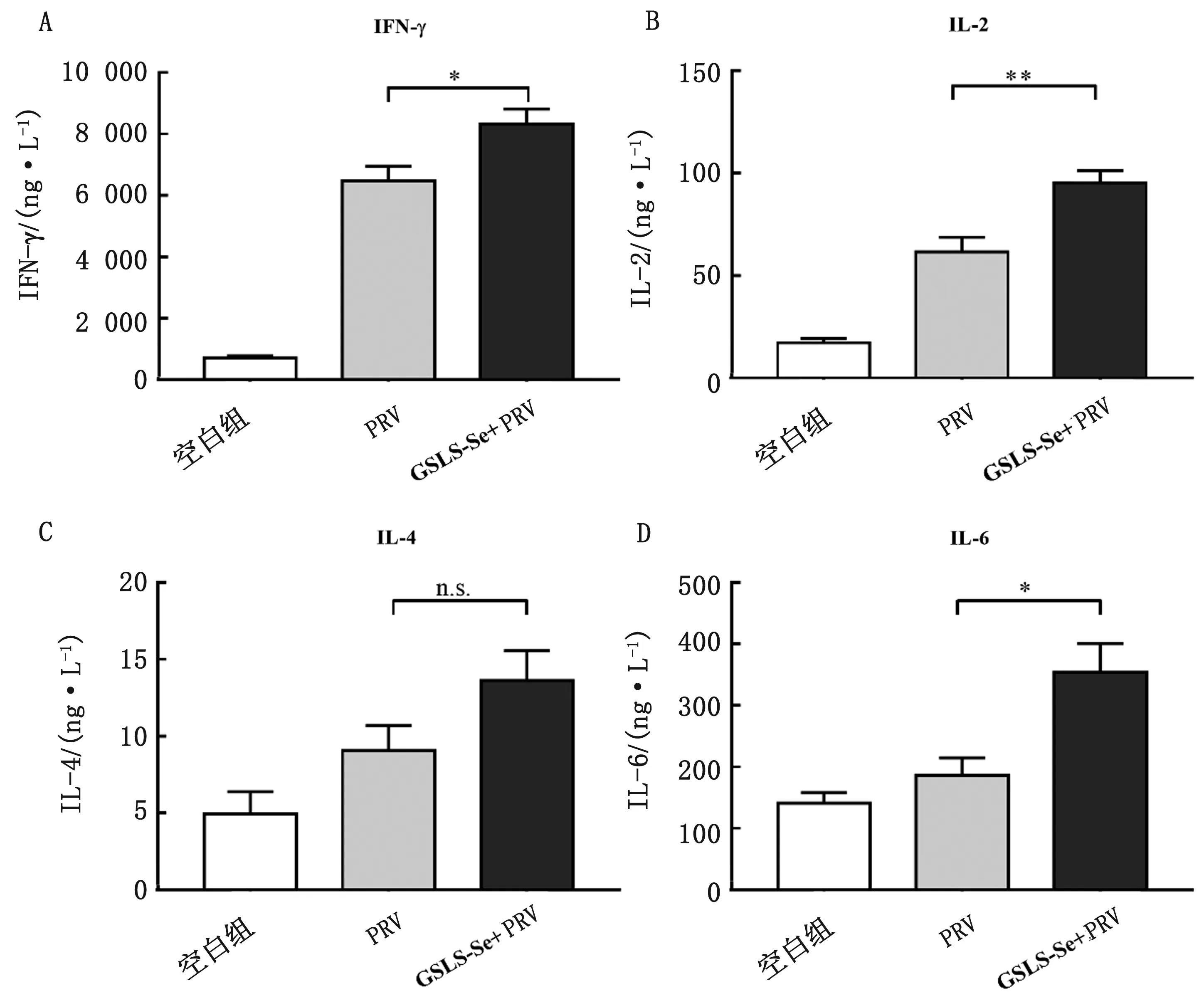
图5 小鼠脾淋巴细胞细胞因子IFN-γ(A)、IL-2 (B)、IL-4 (C)和IL-6 (D)水平

图6 小鼠攻毒后的生存率
口服是中药的传统给药途径。YU等[8]证明口服GSLS能够显著提高免疫抑制状态下的鸡对灭活鸡新城疫和流感二联疫苗的免疫应答水平。LI等[6]报道,免疫前口服GSLS能够显著性提高小鼠特异性FMD IgG及其亚类水平。Se是人和动物必需的微量元素,有研究报道在猪瘟疫苗中添加Se使动物血液中B淋巴细胞数量增多,并能够快速诱导动物产生特异性抗体,且维持较长时间[18]。毛跟年等[19]报道,在AI灭活疫苗中添加Se能显著提高鸡HI抗体水平。在本研究中,口服GSLS配合在疫苗中添加Se可显著增强PRV灭活疫苗诱导的体液免疫和细胞免疫应答水平,提高免疫动物抵抗PRV野毒感染的能力。因此,GSLS-Se的免疫增强作用是由于GSLS和Se共同起作用的结果,值得在本动物上进行进一步的研究。
