非洲猪瘟病毒锁核酸探针荧光定量PCR检测方法的建立
2021-03-10郭怡德勾红潮卞志标孙铭飞蔡汝健蒋智勇楚品品徐民生杨东霞李春玲
李 艳,郭怡德,勾红潮,卞志标,孙铭飞,蔡汝健,宋 帅,蒋智勇,楚品品,徐民生,杨东霞,李春玲*
(1.广东省农业科学院 动物卫生研究所,广东 广州 510640;2.广东省畜禽疫病防治研究重点实验室,广东 广州 510640;3.农业农村部兽用药物与诊断技术广东科学观测实验站,广东 广州 510640)
1 材料与方法
1.1 供试病毒株ASFV SY18毒株、猪瘟病毒(CSFV)、猪繁殖与呼吸综合征病毒(PRRSV)和猪圆环病毒2型(PCV2)均由广东省畜禽疫病防治研究重点实验室保存。
1.2 主要试剂和仪器克隆载体pMD19-T vector、Ex Taq以及Premix Ex Taq(Probe qPCR)购自TaKaRa公司,其他试剂均购自国内生化试剂厂商。主要仪器有荧光定量PCR仪(LightCycler96)和紫外分光光度计(BioTek)。
1.3 引物和探针设计参考ASFV SY18毒株(MH713612)P72基因核苷酸序列设计特异性引物(P1、P2)和探针,用作实时荧光定量PCR的引物和探针,序列见表1。
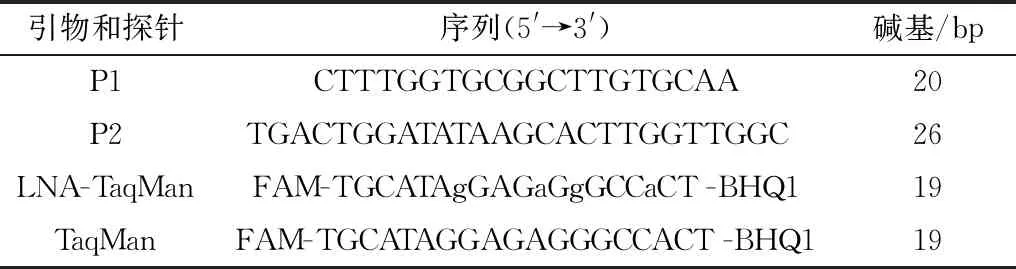
表1 特异性引物和探针信息
1.4 标准质粒样品的制备含有ASFV SY18毒株P72基因序列的质粒标准品pMD19-T-ASFV-P72由本实验室构建,其中P72基因片段由生工生物(上海)工程股份有限公司合成。阳性质粒用紫外分光光度计测浓度和纯度,D260值定量浓度,并转换成拷贝数:拷贝数=浓度×阿伏伽德罗常数/(1个碱基对的平均相对分子质量×总长度),阿伏伽德罗常数为6.02×1023。已知拷贝数的重组质粒10倍梯度稀释后作为标准品,-20℃保存备用。
1.5 实时荧光定量PCR反应体系及条件优化采用20 μL反应体系,退火温度设置为58.0,58.5,59.0,59.5,60.0,60.5,61.0,61.5℃ 等8个温度梯度。反应体系:2×Premix Ex Tag 10 μL,P1 0.6 μL(0.3 μmol/L),P2 0.6 μL(0.3 μmol/L),探针0.3 μL(0.15 μmol/L),DNA模板1 μL,用ddH2O补充至20 μL。引物浓度200,300,400,500,600 nmol/L,探针浓度50,100,150,200,250 nmol/L,分别稀释5个浓度梯度。选取最低的Ct值。循环条件:预变性95℃10 min;95℃15 s,60℃ 30 s,扩增45个循环。
1.6 实时荧光定量PCR标准曲线的建立将阳性重组质粒pMD19-T-ASFV-P72进行10倍梯度稀释,得到3.9×100~3.9×109拷贝/μL 10个稀释度的重组质粒作为标准品模板,按照1.5优化的反应条件进行荧光定量PCR,得出各自的扩增曲线,并绘制标准曲线。
1.7 特异性试验分别提取CSFV、PRRSV、PCV2的核酸,采用1.5优化的荧光定量PCR检测方法的反应体系,以pMD19-T-ASFV-P72重组质粒作为标准阳性对照,CSFV、PRRSV、PCV2基因组DNA作为其他毒株模板,无菌水作为阴性对照,进行扩增,验证所建立方法的特异性。
1.8 敏感性试验以重组质粒pMD19-T-ASFV-P72为标准阳性质粒,分别进行10倍倍比稀释,每个模板浓度设3个平行,以此为模板进行LNA-TaqMan探针和常规TaqMan探针荧光定量PCR扩增,通过观察扩增曲线确定检测到重组质粒的最低拷贝数,建立标准曲线,评估并比较LNA-TaqMan探针和常规TaqMan探针荧光定量PCR检测方法的敏感性。
在进行分区管理时一般将区域划分为3级。1级分区主要是依据行政管理进行划区;2级分区主要是1级分区中漏损严重区域,包括供水只限、用水大户等;3级分区一般为层叠式的,为上层分区中流入的。在DMA分区中要考虑的因素众多,如自然边界、地形差异、调度运行、压力管理、管网现状和用户结构等[4]。DMA分区计量管理的内容主要包括:DMA边界确定、管网水力模型建立、管网信息调研、用水用户调查、规划分析语DMA边界确定、压力控制和优化调度分析等。DMA检测漏损的具体技术流程如图2所示。
1.9 重复性试验选取不同浓度pMD19-T-ASFV-P72重组质粒为模板进行LNA-TaqMan探针荧光定量PCR检测,每个浓度设置3个重复孔,同样的反应条件分别进行3次试验,计算方法的变异系数,评估方法的重复性。
1.10 样品的检测用已建立的LNA-TaqMan探针荧光定量PCR方法对56份临床样品进行检测,并与OIE提供的qPCR方法进行比对。
2 结果
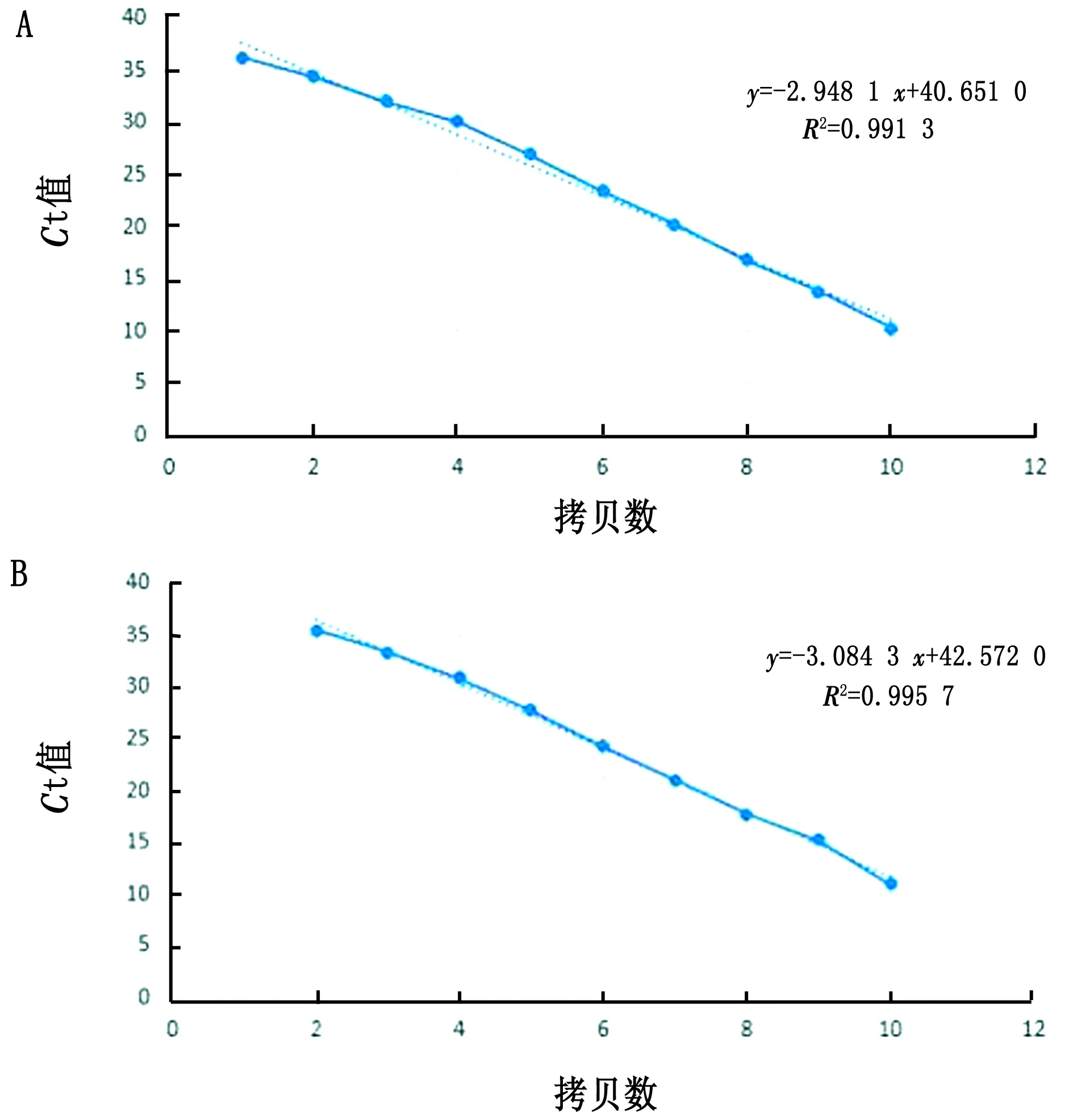
2.1 实时荧光定量PCR标准曲线的绘制将ASFV阳性重组质粒pMD19-T-ASFV-P72 10倍梯度稀释为3.9×100~3.9×109拷贝/μL共10个稀释度,进行LNA-TaqMan探针荧光定量PCR和常规TaqMan探针荧光定量PCR,获得阳性重组质粒pMD19-T-ASFV-P72的标准扩增曲线(图1)。LNA-TaqMan探针法标准曲线的浓度为3.9×100~3.9×109拷贝/μL具有很好的相关性,线性方程式y=-2.948 1x+40.651 0,R2=0.991 3;而TaqMan探针法标准曲线的浓度为3.9×101~3.9×109拷贝/μL也具有很好的相关性,线性方程式y=-3.084 3x+42.572 0,R2=0.995 7(图2)。

A.LNA-TaqMan探针法标准曲线;B.TaqMan探针法标准曲线。1~10.依次为3.9×109,3.9×108,3.9×107,3.9×106,3.9×105,3.9×104,3.9×103,3.9×102,3.9×101,3.9×100拷贝/μL
2.2 LNA-TaqMan探针荧光定量PCR检测系统的优化与建立
2.2.1LNA-TaqMan探针荧光定量PCR退火温度的优化 选取58.0,58.5,59.0,59.5,60.0,60.5,61.0,61.5℃ 8个不同的退火温度进行LNA-TaqMan探针荧光定量PCR扩增,通过对不同退火温度扩增曲线的Ct值进行比较,结果显示59.0℃时的Ct值为17.26,是8个退火温度中的最小值,因此退火温度为58.0℃时pMD19-T-ASFV-P72重组质粒的扩增效率最高。
2.2.2LNA-TaqMan探针荧光定量PCR引物浓度优化 通过对200,300,400,500,600 nmol/L 5个不同浓度的上、下游引物进行扩增,得到的扩增曲线显示,在上、下游引物浓度为300 nmol/L时,pM-D19-T-ASFV-P72重组质粒的Ct值最低,因此,上、下游引物的最佳浓度确定为300 nmol/L(图3)。
A.LNA-TaqMan探针法标准曲线;B.TaqMan探针法标准曲线
2.2.3LNA-TaqMan探针荧光定量PCR探针浓度优化 探针按照50,100,150,200,250 nmol/L稀释5个浓度梯度,进行LNA-TaqMan探针荧光定量PCR扩增,得到扩增曲线按照最低Ct值确定,LNA-TaqMan探针荧光定量PCR的最佳探针浓度为150 nmol/L(图4)。

图3 ASFV LNA-TaqMan探针荧光定量PCR引物浓度的优化
2.2.4LNA-TaqMan探针荧光定量PCR方法的灵敏性检测 pMD19-T-ASFV-P72重组质粒10倍倍比稀释后,按照优化后的反应体系和反应条件进行灵敏度检测。检测结果显示,P72基因LNA-TaqMan探针荧光定量PCR方法的检测浓度下限是3.9拷贝/μL,而常规TaqMan探针荧光定量PCR方法的检测浓度下限是39.0拷贝/μL。

图4 ASFV LNA-TaqMan探针荧光定量PCR探针浓度的优化
2.2.5LNA-TaqMan探针荧光定量PCR方法的特异性检测 对CSFV、PRRSV、PCV2的基因组核酸以及pMD19-T-ASFV-P72阳性重组质粒同时进行检测,结果显示,只有pMD19-T-ASFV-P72阳性重组质粒可产生特异性扩增曲线,其余皆为阴性(图5),证明该方法的特异性良好,可以用于ASFV的检测。

1.pMD19-T-ASFV-P72阳性重组质粒(3.9×106拷贝/μL);2.CSFV;3.PRRSV;4.PCV2;5.阴性对照
2.2.6LNA-TaqMan探针荧光定量PCR方法的重复性检测 以pMD19-T-ASFV-P72质粒标准品中的3.9×106,3.9×105,3.9×103拷贝/μL等3个浓度的DNA作为模板,每个浓度重复3次,按照优化的扩增体系和条件进行实时荧光定量PCR。结果如表2所示,变异系数小于1%,说明所建立的LNA-TaqMan探针荧光定量PCR方法重复性较好,结果稳定可靠。

表2 LNA-TaqMan探针荧光定量PCR重复性试验
2.2.7LNA-TaqMan探针荧光定量PCR方法的应用 应用所建立的检测方法对临床样品进行检测,同时用OIE推荐的实时荧光PCR方法进行检测[12]。结果显示,56份样品均无扩增曲线出现,检测结果均为阴性,与OIE推荐的实时荧光PCR法检测结果一致。
3 讨论
ASFV作为一种烈性病原体,早期临床诊断尤为重要。实时荧光定量PCR技术作为早期核酸诊断方法优势明显,是目前病原早期诊断的首选检测方法,在ASFV疫病流行和诊断中亦发挥重要作用,可对血液、粪便、分泌物、猪肉制品等多种样品中的ASFV进行核酸检测。但常规荧光定量PCR技术的检测灵敏度仍有待进一步提高,通过对探针进行修饰可有效提高实时荧光定量PCR检测方法的敏感性和特异性。目前,常用的修饰探针包含MGB探针、TaqMan探针、Scorpion探针、LNA探针等,LNA探针是4种不同探针(MGB探针、TaqMan探针、Scorpion探针、LNA探针)中敏感性最强的探针[14]。
LNA碳环的2′O位和4′-C位通过缩水作用形成亚甲基桥并连接成锁状结构,增加了磷酸盐骨架的稳定性,使PCR反应中其与DNA、RNA结合成的双链的稳定性和亲和力更高[21-22]。解链温度相同时,LNA-TaqMan探针比常规TaqMan探针更短,更短的探针,扩增干扰更少,PCR扩增效率更高,敏感性更强[23]。前期我们基于LNA探针技术建立了猪伪狂犬病病毒的LNA探针荧光定量PCR方法,方法的特异性和敏感性均较好[20]。
目前,国内尚未见LNA-TaqMan探针荧光定量PCR方法检测ASFV的研究报道,基于LNA-TaqMan探针的灵敏度及特异性等优势,本试验将LNA探针技术应用于目前肆虐养猪业的ASFV的检测,通过优化方法的引物浓度、探针浓度及退火温度,成功建立了基于P72蛋白基因的ASFV的LNA-TaqMan探针荧光定量PCR方法,结果显示该方法的检测下限为3.9拷贝/μL的pMD19-T-ASFV-P72重组质粒,而常规TaqMan探针法的检测灵敏度为39.0拷贝/μL,LNA-TaqMan探针荧光定量PCR方法的灵敏度较常规TaqMan探针法提高了10倍,敏感性更强。本试验同时对建立的LNA-TaqMan探针荧光定量PCR方法的特异性进行了检测,结果所建立方法对CSFV、PRRSV和PCV2的基因组核酸都不能产生特异性信号,特异性很好。
本试验建立了基于ASFV P72基因的LNA-TaqMan探针荧光定量PCR方法,方法的灵敏度高,特异性强,可用于ASFV临床诊断,对于开展ASFV的流行病学研究及防控工作具有重要意义,同时为ASFV诊断提供了一种新的技术选择。
