miR-130a-3p与小鼠胰岛素敏感性的相关性
2021-03-10李威特吴佳韩罗君谊孙加节张永亮习欠云
李威特,江 霖,吴佳韩,陈 婷,罗君谊,孙加节,张永亮,习欠云
(华南农业大学 动物科学学院 广东省动物营养调控重点实验室/国家生猪种业工程技术中心,广东 广州 510642)
MicroRNA(miR)是一类由内源基因编码的长度约为22个核苷酸的非编码单链RNA分子,它们参与转录后基因表达的调控[1]。作为近年来研究的新的调控介导热门分子,且在机体中参与了基本代谢中的能量代谢、糖类合成、脂肪合成、细胞发育等过程[2-4];同时,microRNA可参与疾病的进程,作为疾病治疗的新靶标[5-7]。此前,对参与胰岛素调节的microRNA的研究发现,miR-378可以靶向降低p110α基因的表达,抑制胰岛素信号的传递[8];miR-183的表达减少,会提高牙髓细胞转化为胰岛细胞的分化效率[9];另有研究发现,下调miR-181a可以上调Sirtuin-1基因表达,并改善胰岛素敏感性。但是,目前对参与到胰岛素信号传导的microRNA并没有全部被发现。本试验为了研究潜在的microRNA参与到胰岛素信号传导的过程,选择了5种microRNA(miR-146a-5p、miR-143a-3p、miR-125b-2、miR-130a-3p和miR-28a-3p)为研究目标,观察胰岛素对他们的影响,为之后进一步的研究提供有效的数据。
1 材料与方法
1.1 试验材料人胰岛素(I2643,Sigma);PCR仪(2720thermalcycle,广州吉泰生物科技有限公司);实时荧光定量PCR仪(Stratagene,古泰生物科技有限公司);罗氏血糖仪活力型(ROCHE,瑞士)。
1.2 实验动物miR-130a全身性敲除小鼠由赛业(广州)生物科技有限公司制备。试验小鼠的扩繁和饲养于华南农业大学动物实验中心,遵循SPF级动物饲养条件。实验动物的饲养和应用遵照《美国国立卫生研究院实验动物应用指南》进行,并通过了华南农业大学实验动物伦理委员会的批准。
1.3 试验设计与饲养管理
1.3.1胰岛素注射试验 选用60日龄80只生长性能相近SVF小鼠,随机分为2组,每组40只,试验组小鼠每克体质量注射胰岛素0.01 mL(0.05 U/mL),对照组注射等体积生理盐水。2组均饲喂普通饲料,试验期2周。其中,各组30只小鼠进行短期试验,10只进行长期试验。
1.3.2高脂饲喂试验 选用60日龄生长性能相近的10只miR-130a敲除鼠和10只野生型小鼠,随机分为2组饲喂高脂饲料,试验期2周。普通饲料和高脂饲料均购买于广东省医学动物实验中心。高脂饲料为60%脂肪热能,普通饲料为5%脂肪热能。在试验期间,各组小鼠自由采食与饮食,光照与黑夜各12 h,温度保持在25℃。
1.4 胰岛素注射试验
1.4.1短期试验 小鼠提前4 h禁食,保持正常饮水,每克体质量注射胰岛素0.01 mL(0.05 U/mL),分别在0.5,1.0,2.0 h对小鼠颈部脱臼处死采取各组小鼠肝脏,置于-80℃冰箱保存。
1.4.2长期试验 每48 h对小鼠注射胰岛素,每克体质量注射0.01 mL(0.05 U/mL),14 d后小鼠颈部脱臼处死采取各组小鼠肝脏,置于-80℃冰箱保存。
1.5 胰岛素耐受试验(ITT)与葡萄糖耐受试验(GTT)
1.5.1ITT试验 小鼠提前4 h禁食,保持正常饮水,在开始注射前,用剪刀剪去小鼠尾巴末端1~2 mm,轻轻挤压小鼠尾巴,让血液富集成1滴,用血糖仪测定血糖,测定值认定为 0 min 的血糖值;适应30 min后,给小鼠注射胰岛素溶液,每克体质量注射0.01 mL(0.05 U/mL),在 30,60,90,120 min测定每只小鼠各个时间点的血糖值。
1.5.2GTT试验 小鼠提前16 h禁食,保持正常饮水,在开始注射前,用剪刀剪去小鼠尾巴末端1~2 mm,轻轻挤压小鼠尾巴,让血液富集成1滴,用血糖仪测定血糖,测定值认定为 0 min 的血糖值;适应30 min后,给小鼠注射20 %葡萄糖溶液,每克体质量注射0.01 mL,在 30,60,90,120 min测定每只小鼠各个时间点的血糖值。
1.6 microRNA靶基因预测通过starBase(http://starbase.sysu.edu.cn)网站对挑选的miRs进行靶基因预测。
1.7 实时荧光定量PCR组织中总RNA的提取依据TRIzol 一步法的说明书进行,纯化并定量后,取2 μg总RNA逆转录合成cDNA,设计的反转录引物如表1。然后采用SYBR GreenⅠ Real-time PCR的方法检测目的基因的相对表达量,设计的定量引物如表2。

表1 反转录引物

表2 定量引物
1.8 数据处理采用SPSS 17.0软件进行数据统计分析,两组间采用t-test检验进行比较,以P<0.05作为差异显著性判断标准。
2 结果
2.1 胰岛素对相关microRNA表达影响注射胰岛素后可影响相关microRNA的表达,在短期试验中,注射胰岛素后,不同时间对microRNA的表达效果不同,说明胰岛素对microRNA表达影响存在时效性。在注射胰岛素0.5 h后,与对照组相比,试验组中miR-146a-5p、miR-143a-3p、miR-125b-2表达量显著下调,miR-130a-3p表达量显著上调(P<0.05),miR-28a-3p表达量则不变(图1A);在注射胰岛素1.0 h时,miR-146a-5p、miR-143a-3p、miR-125b-2表达量显著下调(P<0.05),miR-130a-3p表达量显著上调(P<0.05),miR-28a-3p表达量则不变,且与0.5 h相比下调与上调的趋势更显著(图1B);在2.0 h时,2组的各microRNA表达量不存在显著性差异(图1C)。另外,在1.0 h时检测相关基因的表达量,与对照组相比,试验组中GSK、HK、CD36、FATP1基因表达显著的下调(P<0.05)(图1D);在长期试验后,与对照组相比,试验组中miR-146a-5p、miR-143a-3p、miR-125b-2表达显著下调(P<0.05),而miR-130a-3p表达显著上调(P<0.05)(图1E)。另外检测相关基因的表达量,与对照组相比,试验组中GSK和HK基因表达显著下调(P<0.05),GS和FATP1基因表达是显著上调(P<0.05),而CD36则差异不显著(图1F)。
2.2 小鼠miR-130a敲除后对胰岛素敏感性的影响由图2可以得知,miR-130a在胰岛素调节的过程中起着一定的作用。miR-130a敲除可导致小鼠的葡萄糖耐受以及胰岛素抵抗,可以发现试验组胰岛素抵抗的曲线下面积(AUC)显著大于对照组(P<0.05)(图3A,C);试验组中葡萄糖耐受试验的AUC显著大于对照组(P<0.05)(图3B,D)。在肝脏中检测有关基因的表达也发现,试验组中GSK、HK表达量显著下调(P<0.05),CD36、FATP1、GS基因表达量显著上调(P<0.05)(图3E)。

A.在注射胰岛素0.5 h后肝脏中相关microRNA的表达量;B.在注射胰岛素1.0 h后肝脏中相关microRNA的表达量;C.在注射胰岛素2.0 h后肝脏中相关microRNA的表达量;D.在注射胰岛素1.0 h后肝脏中相关基因的表达量;E.连续注射14 d后肝脏中相关microRNA的表达量;F.连续注射14 d后肝脏中相关基因的表达量。*.表示试验组与对照组比较差异性显著(P <0.05);**.表示试验组与对照组比较差异性极显著(P <0.01)。下同

图2 相关microRNA靶基因预测
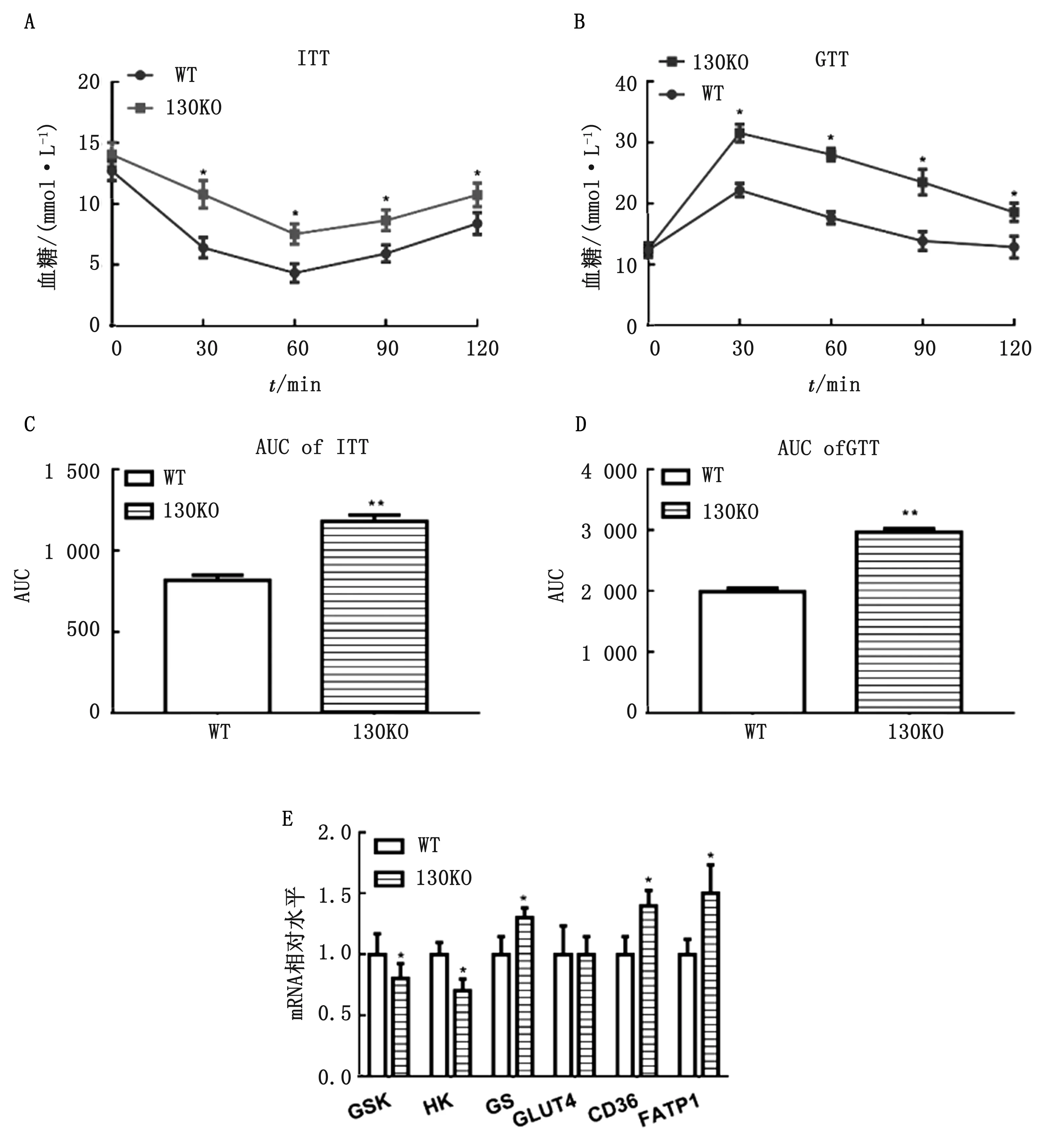
A.胰岛素耐受试验;B.葡萄糖耐受试验;C.ITT曲线下面积(AUC);D.GTT曲线下面积(AUC);E.肝脏中相关基因的表达量
3 讨论
3.1 胰岛素对相关microRNA表达影响microRNA作为一种信号分子,能协助机体内组织间相互调节信号传递,并且利用特异性靶向结合靶基因的特点参与机体基本活动的调节,特定的碱基序列决定了靶基因的特异性,进而可实现精准调节;microRNA参与调节揭露了一种新信号互作方式,成为维护机体稳态的重要组成部分。其中,miR-146a-5p已经被证实参与机体风湿性关节炎、前列腺癌、胰腺癌等生命活动[10]。miR-146a-5p在体内外周循环的增加可以被当成机体产生胰岛素抵抗的生物标志分子[11-12];miR-143a-3p已经被证实参与了脂肪发育、心肌肥大、平滑肌发育及癌症发生等生物学过程[13],在胰岛素调节中,胰岛素信号传递的受阻会上调miR-143a的表达量[14]。miR-125b-2已经被证实参与脂肪发育、精子生成、癌细胞发育、糖酵解等生命活动[15],miR-125b-2的降低可以增加胰岛素信号的传递[16-17]。miR-130a已经被证实参与脂肪发育、平滑肌活力调节、血管重构、抑制癌症发生等生命活动[18]。有研究表明,miR-130a参与了胰岛素信号的传递,在肝脏中表达增加有利于提高肝脏合成糖原的能力[19]。而miR-28a参与相关炎症发生[20],而对于胰岛素调节相关的研究较少。经过靶基因的预测以上microRNA除去miR-28a,其他均有参与胰岛素调节的作用中。从定量的结果可以发现,小鼠在注射胰岛素0.5 h后miR-146a-5p、miR-143a-3p、miR-125b-2、miR-130a的表达水平均发生变化(P<0.05),1.0 h时变化程度增大,到2.0 h时试验组与对照组相比无显著性差异;而miR-28a表达量始终无显著性差异。可以看出胰岛素对microRNA表达量的影响存在时效性,而连续注射胰岛素14 d后发现胰岛素对miR-146a-5p、miR-143a-3p、miR-125b-2、miR-130a的表达量已经产生不可恢复的影响。
3.2 小鼠miR-130a敲除后对胰岛素敏感性的影响此前的研究发现,miR-130a可以参与脂肪合成代谢的调控[21],同时脂肪的合成代谢是胰岛素调节通路中的重要部分,而且根据靶基因预测的结果,可得miR-130a-3p是可以通过抑制PHLPP2基因的表达,进而提高组织对糖类的吸收转运。本研究构建了全身性敲除miR-130a的小鼠,通过高脂诱导饲养发现在敲除鼠中产生了胰岛素抵抗与葡萄糖的耐受。另一方面,基因敲除的小鼠中,糖类合成的相关基因GSK、HK的表达量显著下调(P<0.05);脂肪合成的相关基因CD36、FATP1的表达量显著上调(P<0.05)。可以得出miR-130a不仅受到胰岛素调节,而且在缺失的时候影响胰岛素信号的传递。已知miR-130a可以通过靶向PPAR-γ基因,抑制脂肪的合成代谢[21];另外可以上调Gax基因的表达,促进平滑肌细胞的生成[22];还发现在胰岛素抵抗的小鼠中,增加miR-130a的表达量可以恢复胰岛素的敏感性19,23]。miR-130a-3p不仅影响脂质代谢,也影响糖类代谢,可大胆推测miR-130a-3p不仅是机体组织器官中参与胰岛素调节的重要组成部分,而且是连接糖脂代谢的重要介质。关于miR-130a具体参与胰岛素调节的分子机制尚需进一步的探讨,希望本研究可对进行此方面的研究提供有效的线索以及思路。
