猪葡萄球菌437-2株的分离鉴定及生物学特性
2021-03-10李秀丽董志民田向学任卫科燕晓翠李富强鄢明华
李秀丽,董志民,田向学,任卫科,燕晓翠,李富强,张 莉,鄢明华*
(1.天津市畜牧兽医研究所,天津 300381;2.农业农村部兽用药物与诊断技术天津科学观测实验站,天津 300381;3.天津市宁河区芦台第一中学,天津 301500)
猪葡萄球菌(Staphylococcushyicus)是仔猪渗出性皮炎的主要病原,感染后可引起仔猪发热、脱水、消瘦和死亡。病猪皮肤发红、溃疡、油性结痂,呈典型渗出性、湿疹性皮炎病变。猪渗出性皮炎俗称“油皮病”,哺乳仔猪对该病最易感,断奶仔猪也可发病。该病一年四季均可发生,但温暖潮湿的夏、秋季节多发。临床上以接触传播为主,病猪发病率为10%~90%,病死率可达70%以上,病程较长的存活仔猪生长缓慢,严重者成为僵猪,给猪场造成较为严重的经济损失[1-3]。该病在全球分布较广,丹麦、德国、俄罗斯和日本等许多国家均有该病发生的报道[2-5]。
在我国,邓朝阳等[6]报道了广西某猪场发生的仔猪渗出性皮炎及其治疗情况;殷凤斌等[7]报道黑龙江省齐齐哈尔市发生了猪渗出性皮炎临床病例;睢艳平等[8]、段晓军等[9]分别报道在北京和河北省永清县发现了该病;段玉鹏等[10]报道宁夏海原县某猪场发生仔猪葡萄球菌病。李艳等[11]从广东增城某猪场分离鉴定了1株猪葡萄球菌强毒株,并对其致病性和耐药特性进行了研究;徐国等[12]、陈亚强[13]分别报道贵州省和重庆市发生了仔猪渗出性皮炎。以上研究显示,该病已广泛分布于我国华南、东北、华北和西南等地区。在临床案例中,虽然该病以散发为主,但对于发病猪场而言,由于药物治疗效果较差且病死率和淘汰率很高,往往造成较大的经济损失,其危害不容忽视。
本试验从河北省秦皇岛市某猪场具有典型皮炎症状的发病仔猪体内分离到1株病原菌,经培养特征、生化特性和16S rRNA的检测与分析,确定为猪葡萄球菌。进一步对该分离株进行了耐药性、致病力和脱落毒素基因的测定,为深入开展仔猪渗出性皮炎的防治研究奠定基础。
1 材料与方法
1.1 病料来源病料取自2017年河北省秦皇岛某猪场具有皮炎症状8日龄哺乳仔猪。
1.2 主要试剂与培养基哥伦比亚血琼脂平板,购自比克曼生物科技有限公司;THB培养基和普通琼脂培养基,购自青岛海博生物技术有限公司;Gibico胎牛血清,购自上海觅拓生物科技有限公司;葡萄球菌属微量生化鉴定管,购自杭州天和微生物试剂有限公司;药敏纸片,购于杭州滨和微生物试剂有限公司;DNA提取试剂盒,购自宝生物工程(大连)有限公司。
1.3 试验动物6周龄BALB/c小鼠,购自北京维通利华实验动物技术有限公司。杜洛克×长白×大白三元8日龄健康哺乳仔猪,购自天津某猪场,试验前用一次性无菌棉签在仔猪耳后与后腿内侧部位的皮肤分别取样进行细菌分离,分离菌经16S rRNA基因测序鉴定均为猪葡萄球菌阴性。仔猪人工饲喂不含抗生素的奶粉,置于26~28℃环境中饲养,适应环境3 d后开始试验。
1.4 病原菌分离及形态学观察无菌采集具有皮炎症状病猪的肝脏、肺脏及病变皮肤,接种哥伦比亚鲜血平板,37℃静置培养18 h,观察并挑选形态一致的优势菌落进行革兰染色、镜检。
1.5 生化特性鉴定将分离纯化的细菌接种于普通琼脂平板及哥伦比亚血琼脂平板,观察菌落是否产生色素及溶血情况。同时挑取菌落进行触酶试验,并接种葡萄糖、麦芽糖、果糖、蔗糖、乳糖、七叶苷、甘露醇等微量生化鉴定管,37℃培养48 h,统计试验结果。
1.6 16S rRNA基因扩增及测序参考文献[14]委托北京六合华大生物科技有限公司合成细菌16S rRNA 基因通用引物(上游引物P1:AGAGTTTGA-TCCTGGCTCAG;下游引物P2:AAGGAGGTGATCCAGCC。退火温度为60℃,产物大小为1 411 bp)。用DNA提取试剂盒提取分离菌株基因组DNA作为模板,以16S rRNA通用引物进行PCR扩增,反应体系为20 μL:模板0.5 μL,P1、P2各0.5 μL,LA Taq酶10 μL,高压灭菌水8.5 μL。反应条件:95℃ 5 min;95℃ 30 s,60℃ 30 s,72℃ 1 min,30个循环;72℃ 7 min,16℃终止反应。将阳性产物送北京六合华大基因科技有限公司测序,并将结果用BLAST进行同源性比对,构建系统发育树,进行遗传进化分析。
1.7 体外生长曲线测定将分离菌株(菌落总数为0.5×108CFU/mL)按1%量接种至150 mL THB培养液中,混匀后分装(5 mL/管),37℃、150 r/min振荡培养30 h,每隔2 h取出2支试管,做好标记,保存于4℃。对所有时间点样品一起进行菌落计数,绘制生长曲线。
1.8 耐药性测定分离株药敏试验参照美国临床和实验室标准化委员会标准(CLSI2013)推荐的纸片扩散法进行,判定其对测试药物敏感性。
1.9 致病性试验
1.9.1菌液制备 将试验菌株液体培养物按1%量接种于THB培养液(含5% Gibico胎牛血清),37℃振荡培养7 h至对数生长期,3 500 r/min离心15 min,弃上清,用无菌THB洗涤菌落沉淀2次,然后进行菌落计数,根据计数结果调整菌液浓度至1×109CFU/mL备用。
1.9.2小鼠致病性试验 将10只6周龄BALB/c小鼠随机分为2组,每组5只,第1组每只腹部皮下注射1×109CFU/mL的分离株菌液,0.5 mL/只;第2组皮下注射相同剂量THB稀释液作为对照。试验周期14 d,每天观察、记录小鼠临床症状,出现症状的小鼠取皮肤样品进行细菌分离鉴定。
1.9.3仔猪致病性试验 将7头12日龄健康仔猪随机分成2组,试验组5头,于耳后、腹部皮下分点注射1×109CFU/mL的试验菌株菌液,1.0 mL/头。对照组2头,每头接种相同剂量的THB稀释液。攻菌后逐日观察仔猪临床症状,7 d后剖杀出现典型症状的仔猪,观察并记录各脏器组织病变情况。采集肝脏、脾脏、肺脏、肾脏及皮肤进行细菌分离,同时用4%中性甲醛溶液将组织固定24 h,依次进行石蜡包埋、HE染色,显微镜观察病变。
1.10 脱落毒素基因检测参考文献[15-16]报道的6种葡萄球菌表皮脱落毒素基因(ExhA、ExhB、ExhC、ExhD及ShetA、ShetB)的扩增引物(表1),由北京六合华大生物科技有限公司进行合成。提取试验菌株基因组DNA,采用PCR方法检测猪葡萄球菌携带的脱落毒素基因。

表1 葡萄球菌脱落毒素基因引物序列、产物长度及退火温度
2 结果
2.1 细菌分离及生化鉴定结果猪场送检病猪肺脏、肝脏及病变皮肤均分离到白色、光滑、圆形、中等大小菌落,革兰染色镜检可见蓝紫色、球形细菌,多呈葡萄串状分布。该分离菌株不产生色素、不溶血,触酶阳性,能够利用葡萄糖、果糖、蔗糖、乳糖和七叶苷,不能分解麦芽糖和甘露醇。
2.2 16S rRNA 的PCR扩增及序列分析分离菌株的基因组DNA进行PCR扩增后获得了1条特异性条带,与预期大小(1 411 bp)相符,阴性对照无条带(图1)。扩增产物经测序后进行核苷酸序列比对分析,发现该基因与GenBank中发布的猪葡萄球菌16S rRNA基因的同源性为99.86%~100.00%(图2)。因此,判定该菌株为猪葡萄球菌,并命名为437-2株。应用MEGA 7.0软件对437-2菌株与GenBank中发布的猪葡萄球菌的遗传进化关系进一步进行分析,结果显示437-2菌株与猪葡萄球菌NCTC10350、ATCC11249、D.Sompolinsky No.1和3RMW21等4个菌株同处一个分支,表明他们之间的进化关系较近,而与2012年天津分离的猪葡萄球菌Z371株的遗传距离相对较远(图2)。

M.DL2000 DNA Marker;1.疑似猪葡萄球菌分离株样品;2.阴性对照

1.MK015776.1,阿涅蒂斯葡萄球菌PL439 2019年荷兰分离株;2.CP045927.1,阿涅蒂斯葡萄球菌1379 2020年美国分离株;3.CP031266.1,阿涅蒂斯葡萄球菌12B 2019年巴西分离株;4.CP009623.1,阿涅蒂斯葡萄球菌908 2020年美国分离株;5.MH393510.1,阿涅蒂斯葡萄球菌Fop 193 2018年印度分离株;6.MF678861.1,阿涅蒂斯葡萄球菌DSM 23656 2019年荷兰分离株;7.JN644511.1,阿涅蒂斯葡萄球菌JB2_A 2011年印度分离株;8.JN64449.1,阿涅蒂斯葡萄球菌BB17 2011年印度分离株;9.KC212040.1,猪葡萄球菌Z371 2012年中国天津分离株;10.LS483304.1,猪葡萄球菌NCTC10350 2018年英国分离株;11.MF678885.1,猪葡萄球菌PCM 2192 2019年荷兰分离株;12.MK954145.1,葡萄球菌S5 2013年印度分离株;13.CP008747.1,猪葡萄球菌ATCC11249 2014年美国分离株;14.NR_036905.1,猪葡萄球菌D.Sompolinsky No.1 2010年美国分离株;15.437-2,猪葡萄球菌2017年中国天津分离株;16.KJ783382.1,猪葡萄球菌3RMW21 2014年美国分离株
2.3 体外生长曲线测定结果437-2株接种THB培养液2 h内未见明显增长,此时细菌基本处于静止期。接种后4 h,细菌含量迅速上升,6 h达到对数生长期,10 h之后增殖速度放缓,进入平台期,至20 h达到峰值2.1×109CFU/mL。此后细菌含量缓慢下降,至32 h细菌含量仍然维持在9.7×107CFU/mL。生长曲线见图3。

图3 437-2株体外培养生长曲线
2.4 耐药性测定结果试验结果表明,437-2株对14种临床常用抗生素中的痢菌净、氟苯尼考、头孢曲松钠、阿米卡星高度敏感(判定标准参考CLSI2013),但对其他8种药物均表现有不同程度的耐药性,抑菌圈直径见表2。
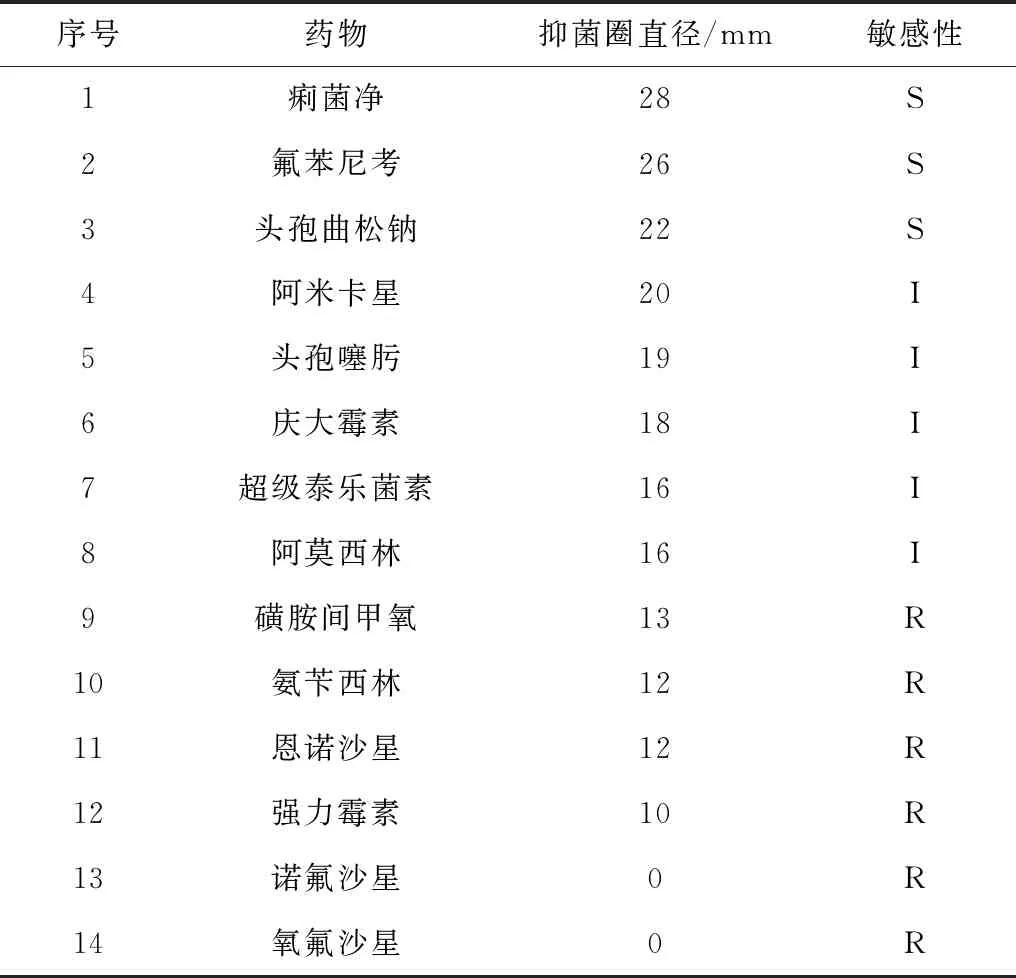
表2 猪葡萄球菌437-2株对常用抗生素的药敏试验结果
2.5 小鼠致病性试验用0.5×109CFU/mL的437-2株接种BALB/c小鼠后7 d,试验组5只小鼠均发病,表现为接种部位皮肤有炎性渗出物分泌,周围被毛有脱落,出现硬痂(图4);攻菌后14 d,炎症渗出物增多。用棉签在伤口擦拭采集样品进行细菌分离,可分离到葡萄球菌,经16S rRNA的PCR扩增和序列分析,结合细菌形态和生化特性,鉴定为猪葡萄球菌。

图4 437-2株感染BALB/c小鼠后接种部位出现硬痂、分泌物增多
2.6 哺乳仔猪致病性试验攻菌仔猪于接种后2 d发病,注射部位出现表皮脱落、发红、破溃和有炎性渗出,后期破溃处结黄色的硬痂(图5A)。眼圈周围皮肤发红,眼角有白色分泌物;攻菌后3~5 d仔猪食欲减退,迅速消瘦(图5B),毛少的部位(耳朵、腹部)开始出现红斑和黄褐色硬痂(图5C);攻菌后6~7 d仔猪全身皮肤发绀,痂皮变硬变厚,1头死亡。剖杀其余4头存活试验仔猪,可见腹股沟淋巴结肿大,肝脏、脾脏、肺脏均未见明显病变。将病变处皮肤及肝脏、脾脏、肺脏、肾脏接种哥伦比亚血琼脂平板,均分离到葡萄球菌。取病变皮肤进行病理学染色观察,可见局部角质层角化过度,表皮棘层显著增厚,真皮弥漫性炎症细胞浸润,纤维组织增生且明显增厚(图5D);有些部位整个皮肤组织表皮完全消失,可见溃疡性炎症病变深达真皮,充满大量炎症细胞及坏死组织(图5E)。对照组试验猪无任何临床表现,剖杀后无菌采集仔猪组织脏器和皮肤样品均未分离到细菌。

A.攻菌猪耳后注射部位出现表皮脱落、发红、黄色痂皮;B.攻菌仔猪消瘦;C.攻菌猪腹部出现红斑和黄褐色硬痂;D.表皮棘层显著增厚,真皮弥漫性炎症细胞浸润(100×);E.皮肤组织表皮完全消失(100×)
2.7 脱落毒素基因检测应用PCR方法检测437-2株携带的脱落毒素相关基因并测序,结果显示该菌株携带ExhD和ShetA基因(图6)。ExhA、ExhB、ExhC和ShetB基因的检测结果为阴性。将测序获得的ExhD和ShetA基因的核苷酸序列分别BLAST比对,结果发现ShetA基因的核苷酸序列与GenBank中报道的该基因的核苷酸序列同源性为95.89%~100.00%(图7),ExhD基因的同源性为96.73%(图8)。
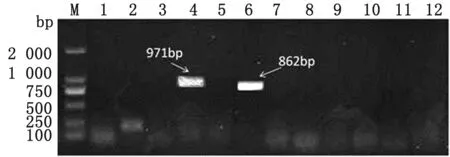
M.DL2000 DNA Marker;1~12.ShetB阴性、ShetB、ShetA阴性、ShetA、ExhD阴性、ExhD、ExhC阴性、ExhC、ExhB、ExhB阴性、ExhA、ExhA阴性;阴性对照均以高压灭菌后的去离子水为模板

1.437-2,猪葡萄球菌2017年天津分离株;2.AB036768.1,猪葡萄球菌2000年日本分离株;3.CP031266.1,葡萄球菌2018年巴西分离株,4.CP045927.1,葡萄球菌2019年美国分离株;5.MF399264.1,猪葡萄球菌2017年印度分离株;6.MF383339.1,猪葡萄球菌2017年印度分离株,7.AM901042.1,猪葡萄球菌2007年德国分离株;8.CP008747.1,猪葡萄球菌2014年美国分离株;9.LS483304.1,猪葡萄球菌2018年英国分离株

1.437-2,猪葡萄球菌2017年天津分离株;2.AF515456.1,猪葡萄球菌2002年丹麦分离株;3.AM946621.1,猪葡萄球菌2016年德国分离株;4.AM950188.1,猪葡萄球菌2016年德国分离株;5.JQ728532.1,猪葡萄球菌GC 2012年中国分离株;6.JQ728534.1,猪葡萄球菌HZ-2 2012年中国分离株;7.MF399267.1,猪葡萄球菌2017年印度分离株ExhB基因部分序列;8.JQ728529.1,猪葡萄球菌ZQ-3 2012年中国分离株; 9.JQ728530.1,猪葡萄球菌ZC-2 2012年中国分离株;10.AB036768.1,猪葡萄球菌2000年日本分离株
3 讨论
研究表明,猪葡萄球菌接种仔猪后可引起发病甚至死亡。张曦等[17]报道,健康仔猪皮下分点注射5 mL猪葡萄球菌分离株液体培养物,试验猪在10 d内全部发病和死亡。李艳等[11]认为,用广东分离株ZC-4株进行攻毒,3×109CFU/mL颈部肌肉注射3 mL,攻菌48 h后,5头25日龄健康仔猪全部发病,病猪表现鼻镜、耳朵、背部、臀部皮肤形成厚厚的结痂,腹部皮肤脱落部位形成黄色结痂,消瘦等症状;5 d后试验仔猪全部死亡。本试验结果显示,猪葡萄球菌437-2株对哺乳仔猪具有较强的致病性。当接种剂量为1×109CFU/头时,8日龄健康哺乳仔猪的发病率为100%,且表现出典型的皮炎症状及病程,试验猪病死率为20.0%(1/5),从病、死猪病变处皮肤及肝脏、脾脏、肺脏、肾脏分离到猪葡萄球菌,证实437-2株可引起仔猪渗出性皮炎。
小鼠因体型小、饲养方便、成本低、省时省力等原因,常用作动物疫病病原的人工模型动物。国内外研究表明,多个品系的小鼠均对猪葡萄球菌敏感。杨彩娟等[18]用猪葡萄球菌GZ1株经肌肉注射感染裸鼠和BALB/c小鼠,结果表明两者均可感染,其中BALB/c鼠更为敏感,感染2~3 d后死亡,死亡前一般无明显的眼观病变;裸鼠的敏感性相对较低,于接种细菌后2~3 d,面部和背部皮肤出现大量红色囊泡,有些地方的皮肤会有炎性渗出,随着病程的延长,皮肤出现糜烂、结痂等。本试验用猪葡萄球菌437-2株接种BALB/c小鼠,结果显示接种剂量为0.5×109CFU/只 时,小鼠发病率为100%,临床表现为接种部位的皮肤分泌大量炎性渗出物,周围被毛脱落、结痂。再次证实BALB/c小鼠可以作为猪葡萄球菌的模型动物。
脱落毒素是猪葡萄球菌感染后引起猪渗出性皮炎的主要毒力因子之一,能否产生脱落毒素,通常作为判定猪葡萄球菌是否有毒力的重要指标[19]。迄今,已有2种类型 6 种脱落毒素被证实,第1种类型是丹麦学者ANDRESEN等[20]鉴定的 Exh 型,包括 A、B、C 和 D 等4 种;第2种类型是日本学者SATO等[21]鉴定的SHET型,分为 A 和 B等2种。FUDABA等[22]对猪葡萄球菌的脱落毒素进行了克隆和表达,并将ExhA、ExhB、ExhC、ExhD和金黄色葡萄球菌产生的 SHETA 和 SHETB分别注入猪体内,结果所有毒素均可引起表皮生成大水疱和结痂。研究还发现,猪葡萄球菌脱落毒素可选择性消化桥粒蛋白(desmoglein,Dsg),当正常的猪表皮细胞被脱落毒素感染的时候,覆盖在细胞表面的Dsg被完全消化,引起仔猪皮肤上出现与渗出性皮炎相类似的病变,纯化的脱落毒素可使表皮中的细胞分离,有助于细菌在表皮中快速扩散,造成皮肤脱落并产生大量皮脂分泌物和浆液分泌物[23]。研究表明,不同国家和地区脱落毒素的类型和不同脱落毒素的检出率存在差异,其中俄罗斯分离的菌株以分泌ExhD为主,德国分离株以分泌ExhC和ExhD为主,而日本学者对38 个猪场的 424 头猪的猪葡萄球菌外毒素蛋白的检测结果表明,该国的流行株主要产生ExhA型脱落毒素[24]。在我国,陈亚强等[13]应用多重PCR检测方法对广东省9株猪葡萄球菌的脱落毒素进行检测,其中6株产生ExhA、ExhC和ShetA。岑静等[25]对湖南省岳阳市2个规模化猪场分离的29株含脱落毒素基因的葡萄球菌的检测结果显示,A 场可检出ExhA、ExhC、ExhD和ShetA,B 场可检出ExhA、ExhD和ShetA,其中ShetA的检出率在 2 个猪场中均为最高。本研究对437-2株携带的6种脱落毒素相关基因进行检测并测序,结果显示该菌株携带ExhD和ShetA基因,表明我国不同地区猪葡萄球菌流行株携带的脱落毒素基因类型存在差异,但ShetA分布范围较广。
根据药敏试验结果筛选敏感药物用于指导猪场临床用药,可以提高用药的针对性和治疗效果,已被养殖户普遍接受。本试验结果显示437-2株对痢菌净、氟苯尼考(氟乐泰)、头孢曲松钠、阿米卡星等药物高度敏感,这几类药物可作为猪场预防和治疗该病的候选药物。值得注意的是,该菌株对14种兽医临床常用药物中的8种药物均具有不同程度的耐药性,提示养殖户应科学选择药物用于该病的防治,避免盲目用药。
